शीर्षक: यूनिट 7 पी ब्लॉक के तत्व
कक्षा XI में, आपने सीखा है कि
कक्षा XI में पेरियाडिक सारणी के
7.1 समूह 15 तत्व
समूह 15 में नाइट्रोजन, फॉस्फ़ोरस, आर्सेनिक, एन्टीमनी, बिस्मथ और मॉस्कोवियम शामिल हैं। हम इस समूह में नीचे जाते हैं, वहां गैर-धात्विक से धात्विक द्वारा धातुकोवीय में बदलाव होता है। नाइट्रोजन और फॉस्फ़ोरस गैर-धात्व होते हैं, आर्सेनिक और एन्टीमनी अधात्व होते हैं, बिस्मथ और मॉस्कोवियम टिपिकल धातु होते हैं।
7.1.1 प्रकट होने वाले
आकाशमंडल के आयतन के ध्वनि मांगलिक नाइट्रोजन का
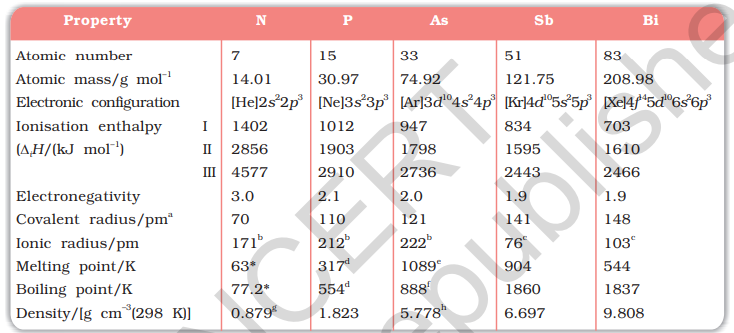
समूह की कुछ परमाणु, भौतिक और रासायनिक गुणधर्मों की प्रवृत्तियाँ नीचे विचार की गई हैं।
7.1.2 इलेक्ट्रॉनिक कॉन्फ़िगरेशन
इन तत्वों की वेलेंस छल इलेक्ट्रॉनिक कॉन्फ़िगरेशन ns2np3 होती है। इन तत्वों में s ऑर्बिटल पूरी तरह भरी हुई होती है और p ऑर्बिटल आधी तरह भरी होती हैं, जो इनकी इलेक्ट्रॉनिक कॉन्फ़िगरेशन को अतिरिक्त स्थायी बनाती हैं।
7.1.3 परमाणु और आयनिक तत्व के आयतन ऊर्जा के अनुयायियों के विस्तार
कोवेलेंट और आयनिक (एक विशेष अवस्था में) अपशिष्ट इसमें यह ऊंचा हो जाता है। N से P तक कोवेलेंट अपशिष्ट में एक पर्याप्त वृद्धि होती है। हालांकि, As से Bi तक कोवेलेंट अपशिष्ट में केवल एक छोटी वृद्धि देखी जाती है। इसका कारण भारी सदस्यों में पूरी तरह से भरी गई d और/द्वारा विकिरण की उपस्थिति होती है।
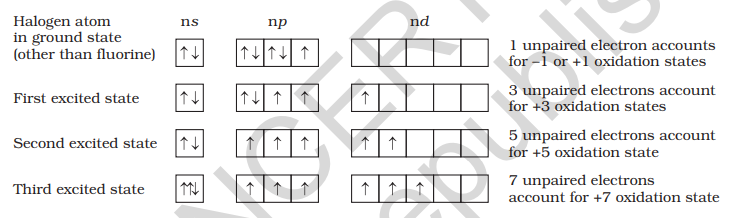
7.1.4 आयनीकरण आंतरल्पण
आयनीकरण उष्णता समैती हो जाता है क्योंकि धीमी रूप से परमाणु आकार में वृद्धि होती है। अत: अतिरिक्त स्थिर पाई-महित खंडयों परमाणु की आयनीकरण उष्णता दल तुलनात्मक मात्रा से बहुत अधिक होती है। उम्मीदित ऑर्डर के अनुसार क्रम,
7.1.5 इलेक्ट्रोप्रभावशीलता
सामान्य रूप में, इलेक्ट्रोप्रभावशीलता मान, परमाणु आकार के वृद्धि के साथ नीचे बढ़ता है। हालांकि, भारी तत्वों में अंतर इतना प्रखर नहीं होता है।
7.1.6 भौतिक गुण
इस समूह के सभी तत्व बहुमुखी होते हैं। डाईनाइट्रोजन एक दोमुखी गैस है जबकि अन्य सभी (साल्फर डॉइड, -NN) कठोर हैं। धातुवादी गुणधर्म समूह में बढ़ते हैं। नाइट्रोजन और फॉस्फोरस गैर-धातु, आरसेनिक और स्वार्थभावी धातुवै और बिस्मूथ एक धातु होती है। इसका कारण आयनीकरण उष्णता में कमी और परमाणु आकार में वृद्धि होने की है। इस समूह में उबाल बिंदु, सामान्य रूप से सबसे ऊपर से नीचे तक बढ़ता है, लेकिन दहन बिन्दु अर्सेनिक तक बढ़ता है और उसके बाद बिंदु बिस्मूथ तक कम होता है। नाइट्रोजन को छोड़कर, सभी तत्व बहुलन को दिखाते हैं।
7.1.7 रासायनिक गुण
ऑक्सीकरण की अवस्थाएं और रासायनिक प्रतिक्रिया में रुझान
इन तत्वों के सामान्य ऑक्सीकरण की अवस्थाएं
इसी तरह, फॉस्फोरस के मामले में, लगभग सभी बीच की ऑक्सीकरण अवस्थाएं को उबाल और अम्ल में +5 और -3 दोनों में विभाजित कर देती हैं। हालांकि, अर्सेनिक, एंटिमनी और बिस्मूथ के मामले में, +3 ऑक्सीकरण अवस्था घटती हुई स्थिर होती है।
नाइट्रोजन कोवेलेंसी की अधिकतम सीमा 4 तक सीमित है क्योंकि केवल चार (एक
नाइट्रोजन की विलक्षण गुणांक
नाइट्रोजन इस समूह के बाकी सदस्यों से अपनी छोटी आकार, उच्च वैद्युतीकरण साख के कारण, उच्च आयनन ऊष्मिकता और
(i) हाइड्रोजन के प्रति प्रतिक्रिया: समूह 15 के सभी तत्व जैसे
तालिका 7.2: समूह 15 तत्वों की हाइड्राइडों के गुण
| गुण |
कंटेंट का हिंदी संस्करण क्या है: | :— | —: | —: | —: | —: | :—: |
| पिघलने का समय/केवी | 195.2 | 139.5 | 156.7 | 185 | - |
| उबलने का समय/केवी | 238.5 | 185.5 | 210.6 | 254.6 | 290 |
| (ई-एच) दूरी/पीएम | 101.7 | 141.9 | 151.9 | 170.7 | - |
| HEH कोण (’’) | 107.8 | 93.6 | 91.8 | 91.3 | - |
|
(ii) ऑक्सीजन के प्रति प्रतिक्रिया: सभी इन तत्वों का दो तरह के ऑक्साइड बनते हैं:
(iii) हैलीजन के प्रति प्रतिक्रिया: इन तत्वों के प्रति दो श्रृंगीय हैलाइडों का निर्माण होता है:
(iv) धातुओं के प्रति प्रतिक्रिया: ये सभी तत्व धातुओं के साथ प्रतिक्रिया करके अपने बाइनरी यौगिकों को बनाते हैं, जो -3 ऑक्सीकरण अवस्था प्रदर्शित करते हैं, जैसे,
इंटेक्स्ट प्रश्न
7.1 प के पेंटाहैलाइड्स, ए एस, एसी और बी त्रिहैलाइड्स से अधिक सह-संयुक्तीय क्यों होते हैं?
7.2 समूह 15 तत्वों के सभी हाइड्राइडों में BiH3 सबसे ताकतवर कम करने वाला एजेंट क्यों होता है?
####7.2 दाइनाइट्रोजन
तैयारी
वाणिज्यिक रूप से दाइनाइट्रोजन वायु का पुष्टिकरण और फ्रैक्शनल डिस्टिलेशन द्वारा उत्पन्न किया जाता है। प्रयोगशाला में, दाइनाइट्रोजन अमोनियम क्लोराइड के जलीय विलय से सोडियम नाइट्राइट के साथ इलाज करके तैयार किया जाता है।
इस प्रतिक्रिया में थोड़ी मात्रा में
$$
उत्सर्जन उत्सर्जन न्यूनतम रुप से, बिना गँध के, स्वादहीन और अविष्कारहीन गैस होता है। नाइट्रोजन परमाणु के दो स्थिर आइसोटोप होते हैं:
छोटी स्केल पर, अमोनिया अमोनियम नमकों से प्राप्त होता है जो कॉस्टिक सोडा या कैल्शियम हाइड्रॉक्साइड के साथ विघटित होते हैं।
२ NH₄Cl + Ca(OH)₂ → 2 NH₃ + 2 H₂O + CaCl₂
(NH₄)₂SO₄ + 2 NaOH → 2 NH₃ + 2 H₂O + Na₂SO₄
बड़े माप पर, अमोनिया को हैबर की प्रक्रिया द्वारा उत्पन्न किया जाता है।
N₂(g) + 3 H₂(g) ⇌ 2 NH₃(g) ; ΔfH° = -46.1 kJ mol⁻¹
Le Chatelier’s principle के अनुसार, अधिक दबाव अमोनिया के गठन को बढ़ावा देगा। अमोनिया के उत्पादन के लिए सर्वोत्तम शर्तें
गुण
अमोनिया एक बिना रंग का गैस है जिसमें एक तिक्ष्ण दुर्गन्ध होती है। इसका जमने और उबलने का बिंदु क्रमश: 198.4 और
अमोनिया गैस पानी में अधिक घुलनशील होता है। इसका तरल प्रभावहीन हल अग्रेज़न के कारण
NH₃(g) + H₂O(l) ⇌ NH₄⁺(aq) + OH⁻(aq)
यह अम्लों के साथ अमोनियम नमक उत्पन्न करता है, जैसे
ZnSO₄(aq) + 2 NH₄OH(aq) → Zn(OH)₂(s) + (NH₄)₂SO₄(aq) (सफेद ppt)
FeCl₃ aq + NH₄OH aq + Fe₂O₃ · x H₂O + NH₄Cl aq भूरे रंगदार ppt
नित्रोजन अणु के अमोनिया अणु के नाइट्रोजन अणु पर एक अकेला इलेक्ट्रॉन का होना उसे एक ल्यूइस बेस बनाता है। यह इलेक्ट्रॉन जोड़ता है और धातु आयनों के साथ लिंकेज बनाता है और ऐसे समयखंडीय यौगिकों के निर्माण का उपयोग में लाना में विशेषताएं मिलती है कि, धातु आयनों की पहचान में
प्रयोग: अमोनिया का उपयोग विभिन्न संयोजक उर्वरक (अमोनियम नाइट्रेट, यूरिया, अमोनियम फॉस्फेट और अमोनियम सल्फेट) का निर्माण करने में किया जाता है और कुछ अयानिक नाइट्रोजन यौगिकों के निर्माण में उपयोग किया जाता है, जिनमें सबसे महत्वपूर्ण होता है नाइट्रिक एसिड। तरल अमोनिया को भी जलीयधारक के रूप में उपयोग किया जाता है।
उदाहरण 7.2 क्यों
समाधान
इंटेक्स्ट प्रश्न
7.4 अमोनिया के उत्पादन का यील्ड अधिकतम करने के लिए आवश्यकताएं उल्लेख कीजिए।
7.5 अमोनिया संयोजन
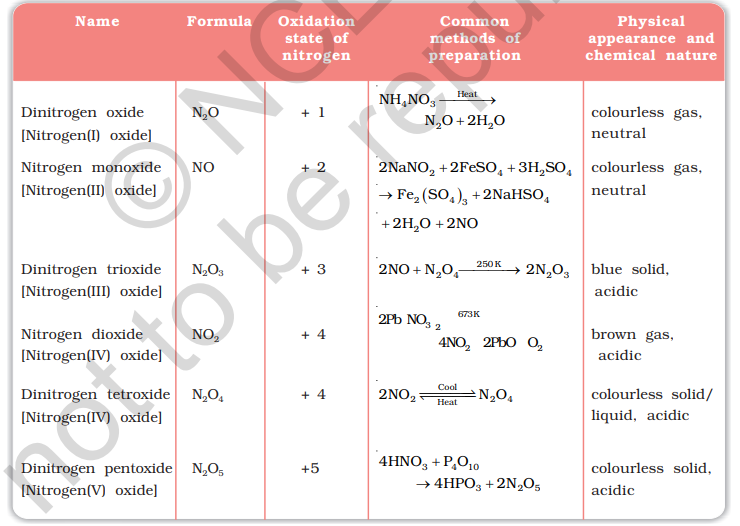
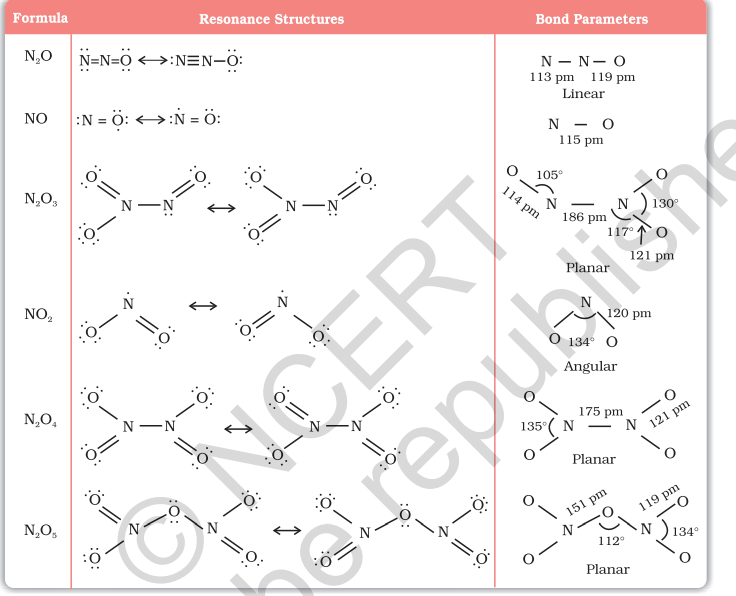
7.4 नाइट्रोजन के ऑक्साइड
नाइट्रोजन भिन्न ऑक्सीकरण स्थिति में कई ऑक्साइड बनाता है। इन ऑक्साइडों के नाम, सूत्र, तैयारी और भौतिक दिखावट टेबल 7.3 में दिए गए हैं।
उदाहरण 7.3
समाधान
इंटेक्स्ट प्रश्न
7.6
7.5 नाइट्रिक एसिड
नाइट्रोजन
तैयारी प्रयोगशाला में नाइट्रिक एसिड उद्घटन (ढांचा) में
बड़ी स्थिति में, यह अधिकांशत: आस्टवाल्ड प्रक्रिया द्वारा तैयार किया जाता है।
इस विधि में पर्यावृत ऑक्सीकरण द्वारा
$$
४ NH₃(g) + (from air) ५ O₂(g) Pt/Rh gauge catalyst/५०० K, ९ bar ४ NO(g) + ६ H₂O(g)
Nitric oxide thus formed combines with oxygen giving NO₂.
२ NO(g) + O₂(g) ⇌ २ NO₂(g)
Nitrogen dioxide so formed, dissolves in water to give HNO₃.
३ NO₂(g) + H₂O(l) → २ HNO₃(aq) + NO(g)
NO thus formed is recycled and the aqueous HNO₃ can be concentrated by distillation upto ~ 68% by mass. Further concentration to 98% can be achieved by dehydration with concentrated H₂SO₄.
Properties
It is a colourless liquid (f.p. २३१.४ K and b.p. ३५५.६ K). Laboratory grade nitric acid contains ~ 68% of the HNO₃ by mass and has a specific gravity of 1.504.
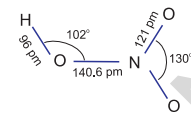
In the gaseous state, HNO₃ exists as a planar molecule with the structure as shown.
In aqueous solution, nitric acid behaves as a strong acid giving hydronium and nitrate ions.
HNO₃(aq) + H₂O(l) → H₃O⁺(aq) + NO₃⁻(aq)
Concentrated nitric acid is a strong oxidising agent and attacks most metals except noble metals such as gold and platinum. The products of oxidation depend upon the concentration of the acid, temperature and the nature of the material undergoing oxidation.
३ Cu + ८ HNO₃ (dilute) → ३ Cu(NO₃)₂ + २ NO + ४ H₂O Cu + ४ HNO₃ (conc.) → Cu(NO₃)₂ + २ NO₂ + २ H₂O
Zinc reacts with dilute nitric acid to give N₂O and with concentrated acid to give NO₂.
४ Zn + १० HNO₃ (dilute) → ४ Zn(NO₃)₂ + ५ H₂O + N₂O Zn + ४ HNO₃ (conc.) → Zn(NO₃)₂ + २ H₂O + २ NO₂
Some metals (e.g., Cr, Al) do not dissolve in concentrated nitric acid because of the formation of a passive film of oxide on the surface.
Concentrated nitric acid also oxidises non-metals and their compounds. Iodine is oxidised to iodic acid, carbon to carbon dioxide, sulphur to H₂SO₄, and phosphorus to phosphoric acid.
what is the hi version of content: & \mathrm{I}_2 + 10 \mathrm{HNO_3} \rightarrow 2 \mathrm{HIO}_3+10 \mathrm{NO}_2 + 4 \mathrm{H}_2 \mathrm{O} \ & \mathrm{C}+4 \mathrm{HNO_3} \rightarrow \mathrm{CO_2}+2 \mathrm{H}_2 \mathrm{O}+4 \mathrm{NO}_2 \ & \mathrm{~S}_8+48 \mathrm{HNO}_3 \rightarrow 8 \mathrm{H}_2 \mathrm{SO}_4+48 \mathrm{NO}_2+16 \mathrm{H}_2 \mathrm{O} \ & \mathrm{P}_4+20 \mathrm{HNO}_3 \rightarrow 4 \mathrm{H}_3 \mathrm{PO}_4+20 \mathrm{NO}_2+4 \mathrm{H}_2 \mathrm{O} \end{aligned} $$
Brown Ring Test: The familiar brown ring test for nitrates depends on the ability of
Uses: The major use of nitric acid is in the manufacture of ammonium nitrate for fertilisers and other nitrates for use in explosives and pyrotechnics. It is also used for the preparation of nitroglycerin, trinitrotoluene and other organic nitro compounds. Other major uses are in the pickling of stainless steel, etching of metals and as an oxidiser in rocket fuels.
7.6 Phosphorus — Allotropic Forms
Phosphorus is found in many allotropic forms, the important ones being white, red and black.
White phosphorus is a translucent white waxy solid. It is poisonous, insoluble in water but soluble in carbon disulphide and glows in dark (chemiluminescence). It dissolves in boiling NaOH solution in an inert atmosphere giving PH3.White phosphorus is a translucent white waxy solid. It is poisonous, insoluble in water but soluble in carbon disulphide and glows in dark (chemiluminescence). It dissolves in boiling NaOH solution in an inert atmosphere giving PH3.
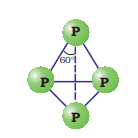
White phosphorus is less stable and therefore, more reactive than the other solid phases under normal conditions because of angular strain in the P4 molecule where the angles are only 60 degree. It readily catches fire in air to give dense white fumes of P4O10.
$$ \mathrm{P_4}+5 \mathrm{O_2} \rightarrow \mathrm{P_4} \mathrm{O_10}
ही संस्करण:
इसमें छिन्न त्रिकोणीय
लाल फास्फोरस बर्फीले फास्फोरस को निर्दोष वायुमंडल में
यह बहुराशीय होता है, जिसमें
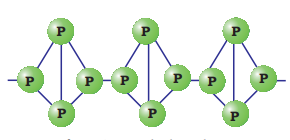
काला फास्फोरस के दो रूप होते हैं,
7.7 फासफिन
तैयारी फासफिन को कैल्शियम फासफाइड के पानी या हल्के हाइड्रोक्लोरिक अम्ल के संश्लेषण से की जाती है।
प्रयोगशाला में, यह सफेद फास्फोरस को पक्षीय वायुमंडल में संक्रमित
साफ होने पर, यह सुगंधहीन गैस होता है और बहुत ही जहरीला होता है। यह हल्के जलने वाले मछली की गंध होती है और
यह पानी में थोड़े-से विश्रामशान होता है। पानी में फासफिन का समाधान प्रकाश के सामरिक प्रदूषण के साथ टूटता है, जिससे लाल फास्फोरस और
$$ \begin{aligned} & 3 \mathrm{CuSO_4}+2 \mathrm{PH_3} \rightarrow \mathrm{Cu_3} \mathrm{P_2}+3 \mathrm{H_2} \mathrm{SO_4} \
विषय: & 3 \ \mathrm{HgCl_2}+2 \ \mathrm{PH_3} \rightarrow \mathrm{Hg_3} \ \mathrm{P_2}+6 \ \mathrm{HCl} \end{aligned} $$ फॉस्फ़ीन कमज़ोर आधारिक होता है और जैसे अमोनिया, एसिड के साथ फॉस्फोनियम यौगिकों को देता है।
उपयोग: फॉस्फ़ीन का स्वतः जलना Holme के संकेतों में तकनीकी रूप से उपयोग होता है। कैल्शियम कार्बाइड और कैल्शियम फॉस्फाइड वाले कंटेनर चुभते हैं और जब असरित गैस जलते हैं और संकेत के रूप में काम करते हैं। इसका उपयोग धुंधले परदों में भी किया जाता है।
उदाहरण 7.4 €03 उर्जाओं का उदय होने का अपशिष्ट संकेत तकनीकी रूप से कैसे उपयोग किया जा सकता है? (च) गहरी NaOH और एक निष्क्रिय CO2 के वायुमंडल में गर्म करने पर सफेद अग्निधारक क्या होता है?
7.8 फॉस्फोरस हैलाइड
फॉस्फोरस दो प्रकार के हैलाइड बनाता है, €PX_3(X=F, Cl, Br, I)
7.8.1 फॉस्फोरस त्रिक्लोराइड
तैयारी इसे गर्म और सूखे बहुक्षीर से गुज़रते हुए अंधकार भाग के साथ ड्राईक्लोरीन पास करके प्राप्त किया जाता है।
यह सूखे फॉस्फत के साथ थायनाइल क्लोराइड के क्रिया के द्वारा भी प्राप्त किया जाता है।
P_4+8SOCl_2 \rightarrow 4PCl_3+4SO_2+2S_2Cl_2
गुणउदाहरण** यह एक रंगहीन तेलीय तरल होता है और आपदा के मौजूदगी में उद्वेग।
यह
इसमें फॉस्फ़ोरस
7.8.2 फॉस्फ़ोरस पेंटाक्लोराइड
प्रक्रिया फॉस्फ़ोरस पेंटाक्लोराइड सफेद अग्निधारक के साथ अधिकतम और सूखे ड्राईक्लोरीन के प्रतिक्रिया से तैयार किया जाता है।
Phosphorus pentachloride is prepared by the reaction of white phosphorus with excess of dry chlorine.
इसे €SO_2Cl_2$ के क्रिया के द्वारा भी तैयार किया जा सकता है।
संपत्तियाँ
जब गर्म किया जाता है, तो यह वाष्प बनने के साथ अपघटित होता है।
यह ऑर्गेनिक यौगिकों के साथ प्रतिक्रिया करता है जिनमें –OH समूह होता है, और उन्हें क्लोरो विभाज्य से परिवर्तित करता है।
सुंदर विंग्योटित धातुओं के गर्म किये जाने पर
यह कुछ ऑर्गेनिक यौगिकों की संश्लेषण में प्रयोग होता है, जैसे
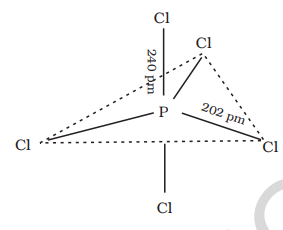
गैसी और तरल अवस्था में, इसकी त्रिकोणीय बाइपिरिमिडल संरचना होती है जैसा कि दिखाया गया है। तीन म्युक्तिसमुच्चयी
उदाहरण 7.5
समाधान पट्टापोषक आंधकारों की मौजूदगी में
उदाहरण 7.6 क्या
समाधान
इंटेक्स्ट क्वेश्चन्स
7.9
7.10
7.9 फायफोएसिक्स के ऑक्सोएसिड्स
फायफोएसिक्स एक संख्या में ऑक्सोएसिड्स बनाता है। उनके साथ दिए गए प्रमुख फायफोएसिक्स ऑक्सोएसिड्स के नाम, सूत्रों के तरक्की और उनकी संरचनाओं में कुछ चरित्रित बंधों की मौजूदगी तालिका 7.5 में दी गई है।
तालिका 7.5: फायफोएसिक्स के ऑक्सोएसिड्स
| नाम | सूत्र | भास्करण अवस्था की ओंक |
चरित्रित बंधों और उनकी मौजूदगी की संख्या |
तैयारी |
|---|---|---|---|---|
| हिफोफायफोस्फोयस (फायफोनिक) |
+1 | एक P - OH दो P - H एक P = O |
सफेद |
| ऑर्थोफास्फोरस
(फॉस्फोनिक) |
एक P - H
एक P
दो P - H
दो P = O |
दो P = O
एक P - P | लाल
एक P = O |
दो
एक
एसिड |
| मेटाफॉस्फोरिक* |
तीन
तीन
सीलिंग ट्यूब में |
ऑक्सो एसिडों की संरचनाएँ
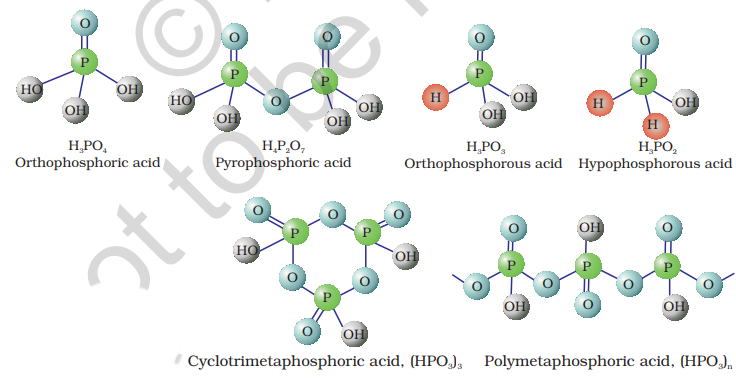
ऑक्सो एसिडों में फास्फोरस को अन्य अणुओं द्वारा चतुर्भुजीय रूप में घेरा होता है। इन सभी एसिडों में कम से कम एक
यहां गैर ही सम्प्रदायकता की बोंडें
इन टेक्स्ट प्रश्नों मेंभाषी प्रतिक्रिया
7.11
7.12
7.10 16 वां समूह के तत्व
ऑक्सीजन, सल्फर, सेलेनियम, टेलरियम, पोलोनियम और लीवर्मोरियम पीरियॉडिक सारणी के समूह 16 का हिस्सा हैं। यह कभी-कभी चाकोजनों के समूह के रूप में भी जाना जाता हैं। इसका नामत्व तांबे के साथ सल्फर और इसके संगबंधियों की एकता के साथ हैं। ज्यादातर तांबे के खनिजों में विशेष रूप से ऑक्सीजन या सल्फर, और अक्सर इस समूह के अन्य सदस्य होते हैं।
उदाहरण 7.7 संरचना के आधार पर
समाधान
7.10.1 प्राकृतिकता
ऑक्सीजन पृथ्वी पर सभी तत्वों में सबसे अधिक जलवे समता हैं। ऑक्सीजन पृथ्वी के गर्भ में मानसिक रूप से
हालांकि, पृथ्वी के गर्भ में सल्फर की उपस्थिति केवल 0.03-0.1% हैं। कंडालिजित सल्फर के रूप में मुख्य रूप से सल्फेट जैसे जिप्सम
सेलेनियम और टेलरियम भी सल्फाइड अयस्क में धातु सेलेनाइड और टेलुराइड के रूप में पाए जाते हैं। पोलोनियम प्राकृतिकता में थोरियम और यूरेनियम खनिजों के अपघटन के उत्पाद के रूप में पाया जाता हैं। लीवर्मोरियम एक संश्लेषित रेडियोधर्मिक तत्व हैं। इसका प्रतीक Lv हैं, परमाणु क्रमांक 116, परमाणु मास 292 और इलेक्ट्रॉनिक विन्यास [Rn] 5f 146d107s27p4 हैं। इसे केवल बहुत कम मात्रा में प्रदर्शित किया गया हैं और इसकी अर्धजीवन बहुत कम होती हैं (केवल एक सेकंड के छोटे संख्यांश भाग ही)। यह Lv की गुणों का अध्ययन सीमित करता हैं।
यहां, लीवर्मोरियम को छोड़कर, समूह 16 के अन्य तत्वों के महत्वपूर्ण परमाणु और भौतिक गुणों के साथ उनके इलेक्ट्रॉनिक विन्यास दिए गए हैं। कुछ वैद्युतीय, भौतिक और रासायनिक गुणों और उनके रुझानों की चर्चा नीचे की गई हैं।
7.10.2 इलेक्ट्रॉनिक विन्यास
समूह 16 के तत्वों के बाहरी परत में छः इलेक्ट्रॉन होते हैं और उनके पास ns2np4 साधारित इलेक्ट्रॉनिक विन्यास होता हैं।
7.10.3 परमाणु और आयोक अर्द्ध विकर्णी
शेलों की संख्या में वृद्धि के कारण, ग्रुप में ऊतक और आयनिक तत्व ऊपर से नीचे की ओर बढ़ते हैं। हालांकि, ऑक्सीजन अणु का आकार अत्यधिक छोटा है।
7.10.4 विनियमन उर्जा
विनियमन उर्जा समूह में नीचे की ओर कम होती है। यह आकार में वृद्धि के कारण होता है। यहांग्रुप 15 के तत्वों के तुलना समय के संबद्ध पीरियड के उन पैमानों के अपेक्षा इस समूह के तत्वों में निचली विनियमन उर्जा मान होती है। इसका कारण है कि ग्रुप 15 तत्वों में अतिरिक्त स्थिर हाफभरे पी ऑर्बिटल इलेक्ट्रॉनिक व्यवस्थाएं होती हैं।
7.10.5 इलेक्ट्रॉन गेन उर्जा
ऑक्सीजन अणु के संकुचित स्वभाव के कारण, सल्फर से कम नेगेटिव इलेक्ट्रॉन गेन उर्जा होती है। हालांकि, सल्फर से आगे मूल्य फिर से नेगेटिव होते हैं जबकि पोलोनियम तक।
7.10.6 इलेक्ट्रोनिगेटिविटी
फ्लोरीन के बाद, ऑक्सीजन तत्व में तत्वों में सबसे अधिक इलेक्ट्रोनिगेटिविटी मान होता है। समूह के भीतर, इलेक्ट्रोनिगेटिविटी परमाणु क्रम में बढ़ने के साथ कम होती है। इसका अर्थ है कि धातुवादी गुणकर्म ऑक्सीजन से पोलोनियम की ओर बढ़ती है।
उदाहरण 7.8
ग्रुप 15 तत्वों के अतिरिक्त स्थिर हाफभरे
समाधान
ग्रुप 16 तत्वों की तुलना में, ग्रुप 16 तत्वों के पारा इलेक्ट्रॉन्स को हटाने के लिए अधिक मात्रा में ऊर्जा की आवश्यकता होती है।
7.10.7 भौतिक गुण
ग्रुप 16 तत्वों के कुछ भौतिक गुणों को तालिका 7.6 में दिया गया है। ऑक्सीजन और सल्फर अधातुएं होती हैं, सेलेनियम और टेलुरियम मेटालॉयड होते हैं, जबकि पोलोनियम एक धातु होता है। पोलोनियम रेडियोएक्टिव होता है और छोटी समय जीवित (अर्ध-जीवन 13.8 दिन)। ये सभी तत्व अल्लोट्रोपी प्रदर्शित करते हैं। पिघलने और उभरने के बिंदु ग्रुप में एटमिक नंबर में वृद्धि के साथ बढ़ते हैं। ऑक्सीजन और सल्फर के मेल्टिंग और उबलने के बिंदु में बड़ा अंतर इसकी परमाणुता की आधार पर समझाया जा सकता है; ऑक्सीजन द्विपारमाणु अणु (O2) के रूप में मौजूद होती है जबकि सल्फर बहुपारमाणु अणु (S8) के रूप में मौजूद होती है।
7.10.8 रासायनिक गुण
ऑक्सीकरण अवस्थाएं और रासायनिक प्रतिक्रिया में रुझान
ग्रुप 16 के तत्वों में कई ऑक्सीकरण अवस्थाएं मान्य होती हैं (तालिका 7.6)। -2 धातुवाद की स्थिरता ग्रुप के नीचे गिरती होती है। पोलोनियम में केवल -2 ऑक्सीकरण अवस्था होती है। ऑक्सीजन की इलेक्ट्रोनिगेटिविटी बहुत ऊची होती है, इसलिए यह केवल -2 के रूप में नकारात्मक ऑक्सीकरण अवस्था दिखाता है, अद्यतन
7.6: ग्रुप 16 तत्वों की कुछ भौतिक गुण
| गुण | 0 | से | Te | पो | |
|---|---|---|---|---|---|
| परमाणु क्रमांक | 8 | 16 | 34 | 52 | 84 |
| परमाणु मास |
16.00 | 32.06 | 78.96 | 127.60 | 210.00 |
| इलेक्ट्रॉनिक प्रतिरचना | |||||
| कोवलेंट अर्द्ध विकर्ण |
66 | 104 | 117 | 137 | 146 |
| आयोनिक अर्द्धवृत्ति, |
140 | 184 | 198 | 221 |
| विद्युत अर्जन ऊष्मा,
- ऑक्सीजन ऑक्सीडेशन स्थिति +2 है जबकि ऑक्सीजन फ्लोराइड में
इस मामले में
ऑक्सीजन का विसंगत व्यवहार
ऑक्सीजन का विसंगत व्यवहार, जैसे कि द्वितीय अवधि में पाये जाने वाले
ऑक्सीजन में
(i) हाइड्रोजन के साथ प्रतिक्रिया: समूह 16 के सभी तत्व
7.7 टेबल: समूह 16 तत्वों के हाइड्राइडों की गुणधर्म
| संपत्ति | ||||
|---|---|---|---|---|
| 273 | 188 | 208 | 222 | |
| b.p/K | 373 | 213 | 232 | 269 |
| 96 | 134 | 146 | 169 | |
| 104 | 92 | 91 | 90 | |
| -286 | -20 | 73 | 100 | |
| 463 | 347 | 276 | 238 | |
| विवेचनात्मक स्थिरता |
(ii) आक्सीजन के प्रति प्रतिक्रिया: इन सभी तत्वों का
(iii) हैलोजनों के प्रति प्रतिक्रिया: 16 समूह के तत्व हैलिडों की एक बड़ी संख्या बनाते हैं,
चरणों तक बाएँ ,
ऑक्सीजन के अलावा सभी तत्व द्व्या-क्लोराइड और द्विब्रोमाइड भी बनाते हैं। ये नाभिकीयकरण द्वारा बने होते हैं और इसलिए घनी संरचना होती है। प्रसिद्ध मोनोहेलाइडों में द्विधातुक संरचना होती हैं। उदाहरण हैं
उदाहरण 7.9
समाधान
बांड
इंटेक्स्ट प्रश्न
7.13 सल्फर के महत्वपूर्ण स्रोतों की सूची लिखें।
7.14 समूह 16 तत्वों के हाईड्राइड्स की ऊष्मिक स्थिरता का क्रम लिखें।
7.15
7.11 दाइऑक्सीजन
तैयारी दाइऑक्सीजन लैबोरेटरी में निम्नलिखित तरीकों से प्राप्त की जा सकती है:
(i) क्लोरेट्स, नाइट्रेट्स और पर्मैंगनेट्स जैसे ऑक्सीजन युक्त लवणों को गर्म करके।
(ii) धातुओं के ऑक्साइडों के थर्मल विघटन और कुछ धातुओं के उच्च ऑक्साइडों के विघटन से।
(iii) हाइड्रोजन पेरॉक्साइड को पुनर्विच्छेदित किया जा सकता है जल और दिविदित धातुओं और मैंगनीज डाइऑक्साइड जैसे कैटलिस्टों के द्वारा।
बड़ी मात्रा में इसे पानी या हवा से तैयार किया जा सकता है। पानी का इलेक्ट्रोलाइसिस काथोड पर हाइड्रोजन की उपसर्गन और एनोड पर ऑक्सीजन की उपसर्गन के साथ होता है।
उद्योगिक रूप से, दाइऑक्सीजन को हवा से प्राप्त किया जाता है, सबसे पहले कार्बन डाइऑक्साइड और वाष्प निकाल दिया जाता है और फिर, शेष गैस को शुद्ध किया जाता है और तथाकथित तरल तत्वों से अलग किया जाता है ताकि दाइऑसिजन प्राप्त हो।
गुण
दाइऑक्सीजन एक रंगहीन और सुगंधरहित गैस है। इसकी पानी में घुलनशीलता
दाइऑक्सीजन लगभग सभी धातुओं और अधातुओं के साथ सीधे प्रतिक्रिया करता है, कुछ धातुओं (जैसे, Au, Pt) और कुछ महान गैसों को छोड़कर। अन्य तत्वों के साथ इसका मिश्रण आमतौर पर बहुत उत्कट होता है जो प्रतिक्रिया को जारी रखने में मदद करता है। हालांकि, प्रतिक्रिया को प्रारंभ करने के लिए, कुछ बाह्य तापन की आवश्यकता होती है क्योंकि ऑक्सीजन-ऑक्सीजन द्वाइगुणी बांडन शोषण समाधान उच्च होता है (
दाइऑक्सिजन का कुछ प्रतिक्रियाओं को धातुओं, अधातुओं और अन्य यौगिकों के साथ निम्नलिखित हैं:
$$ \begin{aligned} & 2 \mathrm{Ca}+\mathrm{O_2} \rightarrow 2 \mathrm{CaO} \
इसका ही संस्करण है:
कुछ यौगिकों को कैटलिटिक रूप से ऑक्सीकरण होता है। उदाहरण के लिए,
उपयोग: सामान्य साँस और जलने की प्रक्रियाओं के अलावा, ऑक्सीजन को ऑक्सीएसिटिलीन वेल्डिंग में, धातुओं के निर्माण में, विशेष रूप से स्टील में इस्तेमाल किया जाता है। अस्थायी पर्यावरण में, नदी ओसीनिलाय पर्वतारोहण में ऑक्सीजन सिलेंडर व्यापक रूप से प्रयुक्त होते हैं। तेल के भप के साथ, उदाहरण के लिए, द्रुत परमाणु इंजन में भरोसेमंद धक्का प्रदान करता है।
संदर्भ प्रश्न
7.16 निम्नलिखित में से कौन सा ऑक्सीजन के साथ सीधे अक्रिय नहीं होता है? Zn, Ti, Pt, Fe
7.17 निम्नलिखित प्रतिक्रिया को पूरा करें:
(i)
(ii)
7.12 सरल ऑक्साइड
किसी अन्य तत्व के साथ ऑक्सीजन के एक बाइनरी यौगिक को ऑक्साइड कहा जाता है। पहले ही कहा जा चुका है कि ऑक्सीजन पीरियडिक सारणी के अधिकांश तत्वों के साथ प्रतिक्रिया करके ऑक्साइड बनाता है। कई मामलों में एक तत्व दो या उससे अधिक ऑक्साइड बनाता है। ऑक्साइड अपनी प्रकृति और गुणों में विभिन्नता रखते हैं।
ऑक्साइड सरल (उदाहरण के लिए,
सामान्य नियम के अनुसार, केवल अयामी ऑक्साइड्स अम्लीय होते हैं, लेकिन आयामी ऑक्साइड्स के भी अम्लीय गुण होते हैं (उदाहरण के लिए,
सामान्य रूप में, धातुयुक्त ऑक्साइड्स आधारीय होते हैं।
कुछ धातुयुक्त ऑक्साइड एक द्वैध्रुव प्रवर्तन दिखाते हैं। उनमें अम्लात्मक और वास्तविक ऑक्साइड दोनों की विशेषताएं होती हैं। ऐसे ऑक्साइड को अम्फोटेरिक ऑक्साइड कहा जाता है। उन्हें अम्लों और क्षारों दोनों के साथ प्रतिक्रिया करते हैं। उदाहरण के लिए,
7.13 ओजोन
ओजोन ऑक्सीजन का एक सभी रूप है। यह धारा स्तर पर देर तक महसूस करने के लिए अत्यधिक प्रतिक्रियाशील होता है। लगभग 20 किलोमीटर की ऊचाई पर इसे सूर्य की उपस्थिति में हवाई ऑक्सीजन से बनाया जाता है। यह ओजोन परत प्राथमिकता से भूमि की सतह को अत्यधिक भारी-लोसिसणु (यूवी) किरणों की अधिकांश मात्रा से सुरक्षित करती है।
तैयारी जब धीमी सुखी ऊष्मा की धारा ऑक्सीजन के माध्यम से चुपके चलाई जाती है, तो ऑक्सीजन से ओजोन (10%) के रूप में रूपांतरण होता है। इस उत्पाद को ओजोनीकृत ऑक्सीजन के नाम से जाना जाता है।
ओजोन को ऑक्सीजन से रूपांतरण के लिए एक ऊष्मा सुसमय विद्युतीय आपदा का उपयोग करना आवश्यक होता है क्योंकि इसका विघटन हो सकता है।
यदि 10 प्रतिशत से अधिक मात्रा में ओजोन की आवश्यकता हो, तो ओजोनाईजर का बैटरी उपयोग की जा सकती है, और शुद्ध ओजोन (बीपी 101.1K) को तरल ऑक्सीजन द्वारा घिरे एक वस्त्र में संघटित किया जा सकता है।
गुण शुद्ध ओजोन एक हल्की नीली गैस, गहरी नीली तरल और बैंगनी काले ठोस होता है। ओजोन की एक विशेष गंध होती है और छोटी मात्रा में यह अहानिकर्षक नहीं होता है। हालांकि, यदि मात्रा लगभग 100 प्रतिशत से ऊपर बढ़ती है, तो सांस लेना असहज हो जाता है जिससे सिरदर्द और मतली होती है।
ओजोन ओक्सीजन के साथ तापगतिक रूप में अस्थिर है क्योंकि इसका अपघटन ऑक्सीजन में बदल जाता है जिससे ऊर्जा (
नकारात्मक योजक जैसे कि रसायनिक योजकों के रूप में निकलने के आसान तरीके के कारण जब इसे नाश्तरीकरण करता है
विषयः $2 \mathrm{I}^{-}(\mathrm{विस्तृत आम्द्रव्)+\mathrm{H_2} \mathrm{O}(\mathrm{द्रव्य-लिंग})+\mathrm{O_3}(\mathrm{वायु (गैशिक)}) \rightarrow 2 \mathrm{OH}^{-}(\mathrm{विस्तृत आम्द्रव्})+\mathrm{I_2}(\mathrm{ठोस})+\mathrm{O_2}(\mathrm{अम्ध् गैशिक})$
जब ओजोन बोरेट बफऱ्र् से संतुष्ट पोटैसियम आयोडाइड विलयन के साथ प्रभावि में प्रति एक क tally नाह परा मोली आयोडिन उप्ययोगी• इत्वांते ऊद्र्यांगतो थाल्पि अम्बारीतो संज्ञायम्बकोने सेकणास्थ्यितस्य खलितं ज्यात्यंतं ज्ञातयत्रा । एकः धराक्रमिक्रा सोडातुल्यितं, इत्वांतः एकं धराक्रमिक्रा संकलयतुल्यितमित्यत्राङ्गुलनुमानेन 128 pm। तत्र खलुःण्ड्यस्तंस्पांदकसंख्या ११७। प्रमुखार्धीभेदिन्योर्जन्यत्वे भिज्ञाः अस्ति खलुःण्ड्यस्तंस्पांदकसंख्या ११७। प्रमुखार्धीभेदिन्योर्जन्यत्वे भिज्ञाः अस्ति खलुःण्ड्यस्तंस्पांदकसंख्या ११७। प्रमुखार्धीभेदिन्योर्जन्यत्वे भिज्ञाः अस्ति खलुःण्ड्यस्तंस्पांदकसंख्या ११७। प्रमुखार्धीभेदिन्योर्जन्यत्वे भिज्ञाः अस्ति खलुःण्ड्यस्तंस्पांदकसंख्या ११७। प्रमुखार्धीभेदिन्योर्जन्यत्वे भिज्ञाः अस्ति खलुःण्ड्यस्तंस्पांदकसंख्या ११७। प्रमुखार्धीभेदिन्योर्जन्यत्वे भिज्ञाः अस्ति खलुःण्ड्यस्तंस्पांदकसंख्या ११७। प्रमुखार्धीभेदिन्योर्जन्यत्वे भिज्ञाः अस्ति खलुःण्ड्यस्तंस्पांदकसंख्या ११७। प्रमुखार्धीभेदिन्योर्जन्यत्वे भिज्ञाः अस्ति खलुःण्ड्यस्तंस्पांदकसंख्या ११७। प्रमुखार्धीभेदिन्योर्जन्यत्वे भिज्ञाः अस्ति खलुःण्ड्यस्तंस्पांदकसंख्या ११७। प्रमुखार्धीभेदिन्योर्जन्यत्वे भिज्ञाः अस्ति खलुःण्ड्यस्तंस्पांदकसंख्या ११७। प्रमुखार्धीभेदिन्योर्जन्यत्वे भिज्ञाः अस्ति
बोथ रोंबिक और मोनोक्लिनिक सल्फर में
पिछले दो दशकों में, सल्फर के 6-20 सल्फर एटम प्रति रिंग वाले कई अन्य संशोधनों का संश्लेषण किया गया है। साइक्लो-
7.15 सल्फर डाइऑक्साइड
तैयारी सल्फर जलते हुए हवा या ऑक्सीजन में जलते हैं तो थोड़ा सा (6-8%) सल्फर त्राई ऑक्साइड के साथ बनता है:
प्रयोगशाला में, यह हलके ध्यान द्वारा सल्फ़ाइट की दृढ़ सल्फोरिक अम्ल के साथ इलाज करके आसानी से उत्पन्न होता है।
औद्योगिक रूप से, यह सल्फाइड खानिजों के भूनने का उपउत्पाद होता है।
सूखने के बाद का गैस दाब में तरल रूप में परिवहन किया जाता है और स्टील सिलेंडर में संग्रहीत किया जाता है।
गुण सल्फ़र डाइऑक्साइड एक रंगहीन गैस है जिसमें संग्रह पदार्थ होता है और यह पानी में बहुत घुलनशील होता है। यह आत्मा पर घाशीय सुगंध वाली गैस है। यह एक वायुमंडल में कम से कम दबाव के तहत कमरे के तापमान पर ठंडा हो जाता है और
सल्फ़र डाइऑक्साइड, पानी से गुजारते हुए, सल्फ़रसस अम्ल का एक समाधान बनाता है।
यह आसानी से सोडियम हाइड्रॉक्साइड समाधान के साथ युक्त होता है, जिससे सोडियम सल्फाइट बनता है, जो फिर और सल्फर डाइऑक्साइड के साथ प्रतिक्रिया करके सोडियम हाइड्रोजन सल्फाइट बनाता है।
पानी और क्षार में इसकी प्रतिक्रिया में, सल्फ़र डाइऑक्साइड का व्यवहार कार्बन डाइऑक्साइड के व्यवहार के बहुत समान होता है।
सल्फ़र डाइऑक्साइड, कोयले की उपस्थिति में क्लोरीन के साथ प्रतिक्रिया करता है (जो कैटलिस्ट की भूमिका निभाता है) और सल्फ्यूरल क्लोराइड,
जब नमीवाला होता है, तो सल्फर डाइऑक्साइड को एक घटावादी एजेंट के रूप में व्यवहार करता है। उदाहरण के लिए, यह लोहा (III) आयन को लोहा (II) आयन में परिवर्तित करता है और अम्बरीकृत पोटेशियम परमैंगनेट (VII) विलयन को अरंगीकृत करता है; अन्यत्रण गैस के लिए यह एक सुविधाजनक परीक्षण है।
एसओ2 का मोलिक्यूल कोणीय होता है। यह दो मान्यांकनिक रूपों का संयोजनीय मिश्रण है:
उपयोग: सल्फर डाइऑक्साइड का उपयोग (i) पेट्रोलियम और चीनी की शोधन में (ii) ऊन और रेशम की सफेदी करने में और (iii) एंटी-क्लोर, संक्रामक और संरक्षक के रूप में किया जाता है। सल्फरिक तत्त्वक अम्ल, सोडियम ह्यड्रोजन सल्फाइट और कैल्शियम हाइड्रोजन सल्फाइट (औद्योगिक रासायनिक पदार्थ) सल्फर डाइऑक्साइड से निर्मित होते हैं। तरल एसओ2 का उपयोग कई अंग्रेजी और अणुरागी रासायनिकों को विलय करने के लिए किया जाता है।
7.16 सल्फर के ऑक्सोएसिड
सल्फर कई ऑक्सोएसिड (जैसे
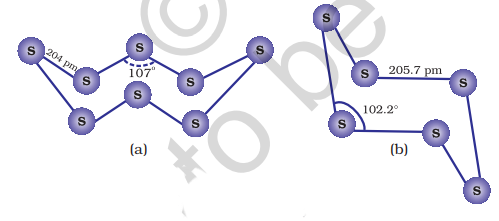
7.17 सल्फ्यूरिक अम्ल
निर्माण सल्फ्यूरिक अम्ल विश्वभर में सबसे महत्वपूर्ण औद्योगिक रासायनिक पदार्थों में से एक है। सल्फ्यूरिक अम्ल को कांटेक्ट प्रक्रिया द्वारा निर्मित किया जाता है जिसमें तीन चरण शामिल होते हैं:
(i) हवा में सल्फर या सल्फाइड खानों को जलाने से
(ii) ऑक्सीजन से प्रतिक्रिया के साथ
(iii)
सल्फ्यूरिक अम्ल के निर्माण में महत्वपूर्ण चरण क्रियाशील अधिणायकता है,
प्रतिक्रिया उत्सर्जक, परावर्तनीय और सर्वोच्च उत्सर्जन के लिए प्रगति में होती है। इसलिए, अधिकतम उत्पाद यापी के लिए निम्न तापमान और उच्च दाब परिस्थितियाँ अनुकूल हैं। लेकिन, तापमान बहुत कम होना चाहिए ताकि प्रतिक्रिया की दर मंद नहीं हो जाए।
अभ्यास में, प्लांट को 2 बार दाब और
संपर्क प्रक्रिया द्वारा प्राप्त की जाने वाली सल्फ्यूरिक अम्ल 96-98% शुद्ध होती है।
गुण
सल्फ्यूरिक अम्ल एक रंगहीन, मोटी, तेलीय तरल होता है जिसका विशिष्ट भारतगत संकेतांक
सल्फ्यूरिक अम्ल के केमिकल प्रतिक्रियाएँ निम्नलिखित विशेषताओं के परिणामस्वरूप होती हैं: (a) कम वायदंतता (b) मजबूत अम्लीय गुण (c) पानी के प्रति मजबूत आकर्षण (d) उक्तियान्वित एजेंट के रूप में कार्य करने की क्षमता। जलीय संकृमण में, सल्फ्यूरिक अम्ल दो चरणों में आयोनिस होती है।
यह अम्ल दो प्रकार के नम सल्फेट (जैसे सोडियम सल्फेट और ताम्र सल्फेट) और ग्रुह सल्फेट (जैसे सोडियम हाइड्रोजन सल्फेट) के पदावली बनाता है।
सल्फ्यूरिक अम्ल के कारण, जिसकी वायदंतता कम होती है, इसका उपयोग उनके संबंधित लवणों से अधिक वायदंतता वाले अम्ल बनाने के लिए किया जा सकता है।
कन्सेंट्रेटेड सल्फ्यूरिक एसिड एक मजबूत निःश्वसनीय क्रियाकलापक है।बहुत सारे ठंडे गैस प्राप्त हो सकते हैं जो कि एप्शेंस में उत्पन्न होते हैं, इन्हें कन्सेंट्रेटेड सल्फ्यूरिक एसिड के मध्य से गुज़ारा कराकर सुखाया जा सकता है, ये गैस एसिड के साथ प्रतिक्रिया न करें।सल्फ्यूरिक एसिड ने ऑर्गेनिक संयोजनों से पानी की हटाना होता है; इसकी शर्ल हरित इंगित होती है।
गर्म कन्सेंट्रेटेड सल्फ्यूरिक एसिड एक माध्यमिक मजबूत आपचक क्रियाकारी एजेंट होती है। इस संबंध में, यह फॉस्फोरिक और नाइट्रिक एसिड के बीच आंतरगत होती है। धातु और गैर-धातुएं दोनों को कन्सेंट्रेटेड सल्फ्यूरिक एसिड द्वारा जलाया जा सकता है, जो
उपयोग: सल्फ्यूरिक एसिड एक बहुत महत्वपूर्ण औद्योगिक रासायनिक पदार्थ है। एक राष्ट्र की औद्योगिक शक्ति सल्फ्यूरिक एसिड की मात्रा द्वारा आंकाया जा सकता है। इसकी आवश्यकता सैकड़ों अन्य मिश्रणों के निर्माण में और भी बहुत सारी औद्योगिक प्रक्रियाओं में होती है। बृहत संख्या में सल्फ्यूरिक एसिड का निर्माण उर्वरकों (जैसे एमोनियम सल्फेट, सुपरफॉस्फेट) के उत्पादन में होता है। अन्य उपयोग जैसे : (a) पेट्रोलियम कोढ़ता है (b) रंगों और रंगाइयों के पिगमेंट, पेंट और रंगाइयों के मध्यवर्ती उत्पादन के निर्माण (c) डिटर्जेंट उद्योग (d) धातु उद्योगों, जैसे इनामेलिंग, इलेक्ट्रोप्लेटिंग और गैल्वनाइजिंग, से पेशाब करना (e) स्टोरेज बैटरी (f) नाइट्रोसेलुलोज प्रोडक्ट निर्माण में (g) एक प्रयोगशाला आक्रिया के रूप में।
पाठ सवाल
7.23 H2SO4 की तीन क्षेत्रों का उल्लेख करें जहाँ पर इसकी महत्त्वपूर्ण भूमिका निभाती है।
7.24 कांटैक्ट प्रक्रिया द्वारा H2SO4 यील्ड में बाढ़ लाने के लिए शर्ते लिखें।
7.25 H2SO4 के लिए Ka2 « Ka1 हैं पानी में, ऐसा क्यों?
फ्लोरीन और क्लोरीन काफी प्रचुर होते हैं जबकि ब्रोमीन और आयोडीन कम होते हैं। फ्लोरीन मुख्य रूप से अनद्रव्यीक फ्लोराइड्स (फ्लोरस्पार
समूह 17 तत्वों की महत्वपूर्ण परमाणुओं और भौतिक गुणों के साथ उनकी इलेक्ट्रॉनिक संरचनाओं को टेबल 7.8 में दिया गया है।
तालिका 7.8: हैलोजनों के परमाणुओं के परमाणुगत और भौतिक गुण
| गुण | Cl | Br | I | ||
|---|---|---|---|---|---|
| परमाणु संख्या | 9 | 17 | 35 | 53 | 85 |
| परमाणु द्रव्यमान |
19.00 | 35.45 | 79.90 | 126.90 | 210 |
| इलेक्ट्रॉनिक संरचना | |||||
| सहसंयोगी त्रिज्या/पिकोमीटर | 64 | 99 | 114 | 133 | - |
| आयनिक त्रिज्या |
133 | 184 | 196 | 220 | - |
| आयनीकरण उत्सर्जन उष्मा |
1680 | 1256 | 1142 | 1008 | - |
| इलेक्ट्रॉन प्राप्ति उत्सर्जन उष्मा |
-333 | -349 | -325 | -296 | - |
| इलेक्ट्रोनेगेटिविटी |
4 | 3.2 | 3.0 | 2.7 | 2.2 |
| 515 | 381 | 347 | 305 | - | |
| - | |||||
| पिघलने का बिंदु/केल्विन | 54.4 | 172.0 | 265.8 | 386.6 | - |
| उबलने का बिंदु/केल्विन | 84.9 | 239.0 | 332.5 | 458.2 | - |
| घनत्व |
- | ||||
| अंतर |
143 | 199 | 228 | 266 | - |
| बांध उल्लेख उत्सर्जन उष्मा |
158.8 | 242.6 | 192.8 | 151.1 | - |
| 2.87 | 1.36 | 1.09 | 0.54 | - |
कुछ परमाणुगत, भौतिक और रासायनिक गुणों की प्रवृत्तियों का वर्णन नीचे दियागया है।
यहां टेनेसिन के अलावा 17 ग्रुप के तत्वों की महत्वपूर्ण परमाणु और भौतिक गुणों को उनके इलेक्ट्रॉनिक कॉन्फिगरेशन के साथ दिए गए हैं [टेबल 7.8, पृष्ठ 198]. टेनेसिन एक संश्लेषणमय यातात्मक तत्व है। इसका प्रतीक टीएस है, परमाणु क्रमांक 117, परमाणु भार 294 और इलेक्ट्रॉनिक कॉन्फिगरेशन [आरएन] 5f 146d107s27p5। तत्व की बहुत कम मात्रा का ही तत्व तैयार किया जा सका। इसका आधा जीवन केवल मिलीसेकंड में है। इसीलिए इसका रसायनशास्त्र स्थापित नहीं किया जा सका।
7.18.2 इलेक्ट्रॉनिक कॉन्फिगरेशन
इन सभी तत्वों में उनकी बाहरीतम कक्षा में सात इलेक्ट्रॉन (न्स2न्प5) होते हैं, जो अगले प्रथम गैस से एक इलेक्ट्रॉन कम हैं।
7.18.3 परमाणु और आयनिक त्रिज्या
हालोजनों की अपेक्षित अवधारणा के कारण उनके संबंधित कालीन अवधार का अवधारणा अतिसूक्ष्म तत्विक अवधि होती है। फ्लोरीन का परमाणु अवयव दूसरी क्रमीय संरेखा के अन्य तत्वों की तरह अत्यंत छोटा होता है। परमाणु और आयनिक त्रिज्या फ्लोरीन से आयोडिन तक बढ़ते हैं क्योंकि क्वांटम खोलों की बढ़ती संख्या होती है।
7.18.4 आयनीकरण अवन्तर
इनके पास इलेक्ट्रॉन को खोने की कम इच्छा होती है। इसलिए उनके पास बहुत ही उच्च आयनीकरण अवन्तर होता है। परमाणु का आकार बढ़ने के कारण, आयनीकरण अवन्तर समूह के नीचे कम हो जाता है।
7.18.5 इलेक्ट्रॉन अर्जन अवन्तर
हालोजनों के संबंधित कालीन अवधारों में अधिकतम नकारात्मक इलेक्ट्रॉन अवन्तर होता है। इसका कारण यह है कि इन तत्वों के परमाणु केवल स्थिर नोबल गैस संरचना से एक इलेक्ट्रॉन कम होता है। समूह के तत्वों का नकारात्मक इलेक्ट्रॉन अवन्तर समूह के नीचे कम नकारात्मक होता है। हालांकि, फ्लोरीन का नकारात्मक इलेक्ट्रॉन अवन्तर क्लोरीन के नकारात्मक इलेक्ट्रॉन अवन्तर से कम होता है। यह फ्लोरीन अणु के छोटे आकार के कारण होता है। परिणामस्वरूप, फ्लोरीन के निरंतर छोटे 2पी योगनियों में मजबूत संघटन-इलेक्ट्रॉन द्वारा दक्षिणपुर्वक प्रतिआकर्षण अनुभव नहीं करता है।
7.18.6 इलेक्ट्रॉनेगेटिविटी
इनकी इतनी उच्चेचेतापन होती है। इलेक्ट्रॉनेगेटिविटी समूह के नीचे घटती है। फ्लोरीन मात्रात्मक सामग्रीक सारणी में सबसे उच्चेचेतापन तत्व है।
7.18.7 भौतिक गुण
हालोजन अपने भौतिक गुणों में धीरे-धीरे बदलते हैं। फ्लोरीन और क्लोरीन गैस होते हैं, ब्रोमीन तरल होता है और आयोडीन कठोर होता है। उनका पिघलने और उबलने का बिंदु परमाणु क्रमांक के साथ स्थिर रूप से बढ़ता है। सभी हालोजनों का रंगबिरंगा होता है। यह दृश्यमान क्षेत्र में विकिरण को अवशोषण करने के कारण होता है जो परमाणु के बाहरी इलेक्ट्रॉनों को उच्चतम ऊर्जा स्तर पर उत्तेजित करता है। विभिन्न क्वांटा के विकिरण को अवशोषित करके, वे विभिन्न रंग दिखाते हैं। उदाहरण के लिए,
गणित 7.8 से हम एक जिज्ञासु विलक्षणता का बोध करते हैं,
उदाहरण 7.11
यद्यपि गुरुत्वाकर्षण की उद्दीपन अंगधी क्लोरीन की तुलना में फ्लोरिन के बनावटी गेंधी अवलम्बन कम नकारात्मक है, लेकिन फ्लोरिन क्लोरीन की तुलना में एक मजबूत आध्यात्मिक एजेंट है। क्यों?
हल कभार यह इसलिए है क्योंकि
(i) आध्यात्मिक 7.8 के टेबल में F-F की बंध की कम उद्दीपन अंगधी है।
(ii) 7.8 के टेबल के उद्दीपन अंगधी में उच्च जलियान उद्दीपन।
7.18.8 रासायनिक गुण
सभी हैलोजन मौलिक जीव की -1 ऑक्सीकरण स्थिति प्रदर्शित करते हैं। हालांकि, क्लोरीन, ब्रोमीन और आयोडीन
क्लोरीन, ब्रोमीन और आयोडीन के उच्च ऑक्सीकेट मुख्य रूप से जब हैलोजन लघु और बहुत विद्युतदार तत्व और ऑक्सीजन अणु के संयोजन में होते हैं। उदाहरण के लिए, इंटरहालोजन, ऑक्सिड्स और ऑक्सोएसीडों में। क्लोरीन और ब्रोमीन के ऑक्साइड और ऑक्सोएसीडों में +4 और +6 के आक्सीक अवस्थाएं होती हैं। फ्लोरिन धातुतात्विक समुच्चार में अपनी गर्मनशीलता में कोई डी orbital नहीं है और इसलिए अपना ऑक्टेट नहीं बढ़ा सकता। सर्वाधिक विद्युतदारी के कारण, यह केवल -1 ऑक्सीकरण स्थिति प्रदर्शित करता है।
सभी हैलोजन बहुत प्रतिक्रियाशील होते हैं। वे धातुओं और अधातुओं के साथ हैलाइड बनाने के लिए प्रतिक्रियाशील होते हैं। हैलोजन की प्रतिष्ठिता शक्ति का मुख्य कारण एक इलेक्ट्रॉन की तत्परता की स्वीकृति होती है।
समूचे गण के तापक्रम प्राधिकारों (तालिका 7.8) में उपयोगित मापक संकेत के द्वारा एके में हैलोजें की कम होने वाली ऑक्सिडेट योग्यता प्रकट होती है।
वायुमंडलीय सार्थकों की अपेक्षानुसार हैलोजनों की प्रतिष्ठा करने की शक्ति को जल के साथ उनके प्रतिक्रियाओं से और आगे बढ़ाया जा सकता है। फ्लोरिन पानी को ऑक्सीजन में तब्दील करता है जबकि क्लोरीन और ब्रोमिन पानी के साथ प्रतिसंबंधी हाईड्रोहाली और हाइपोहालस एसिड बनाते हैं। पानी के साथ आयोडीन का प्रतिक्रिया गैर-स्वतः है। वास्तव में, आईओडीन एकद्रवीय माध्यम में ऑक्सीजन द्वारा ऑक्सीकरण हो सकता है; इसके विपरीत वैधानिकता होती है जो फ्लोरिन के साथ देखी गई प्रतिक्रिया के उल्ट होती है।
फ्लोरिन का विस्मरणीय व्यवहार
आयाम परमाणु मानक के दूसरे अवधि में मौजूद पी-व्लॉक के अन्य तत्वों की तरह, फ्लोरिन कई गुणों में असाधारण है। उदाहरण के लिए, आयनोजन उष्णता, इलेक्ट्रोध्रव्यता, और इलेक्ट्रॉनी ग्रहण उष्मा अन्य हैलोजनों द्वारा स्थापित चरों द्वारा उपेक्षा की उम्मीद से अधिक है। वर्णनीय और सहकारिय तत्वीय तत्व, एम०पी० और बी०पी०, संबंध विघटन और इलेक्ट्रॉन आपूर्ति उष्मा उम्मीद से काफी कम हैं। फ्लोरिन का अद्वितीय व्यवहार उसके छोटे आकार, उच्च अलकगर्वता, कम एफ-एफ बन्ध विटलन उष्मा, और परमाणुमंडलीय बट्टाईयों की प्रतिष्ठा छूट होने के कारण होता है।
फ्लोरिन की अधिकांश प्रतिक्रियाएँ उत्सर्जनात्मक होती हैं (इसके द्वारा अन्य तत्वों के साथ उत्तम बन्ध बनाया जाता है)। यह केवल एक ऑक्सोएसिड बनाता है जबकि अन्य हैलोजन समूह एक संख्या ऑक्सोएसिड बनाते हैं। हाइड्रोजन फ्लोराइड एक तरल होता है (उच्च पानी वाष्पानुक्रम 293 K) क्योंकि मजबूत हाइड्रोजन बंधन होती है। हाइड्रोजन बंधन फ्लोराइड में छोटे आकार और उच्च अलकगर्वता के कारण बनता है। अन्य हाइड्रोजन हैलाइड जिनका बड़ा आकार होता है और कम अलकगर्वता होता है, वे गैसी होते हैं।
(i) हाइड्रोजन के प्रति प्रतिक्रिया: वे सभी हाइड्रोजन के साथ प्रतिक्रिया करते हैं जो हाइड्रोजन के प्रति आकर्षण फ्लोराइड से गिरता है लेकिन फ्लोराइड से आयोनिक गैस के रूप में सोखा जाता है। हाइड्रोहालिक एसिड बनाने के लिए हाइड्रोजन हालाइड पानी में विलय होते हैं। हाइड्रोजन हालाइड के कुछ गुणों को तालिका 7.9 में दिया गया है। इन एसिडों की अम्लीयता क्रम है:
अध्याय 7.9: हाइड्रोजन हैलाइड की गुणधर्म
| । गुणधर्म । एचएफ । एचसीएल । एचबीआर । एचआई | ||||
|---|---|---|---|---|
| मेल्टिंग बिंदु / केल्विन | १९० | १५९ | १८५ | २२२ |
| उबालने बिंदु / केल्विन | २९३ | १८९ | २०६ | २३८ |
| बांड लंबाई |
९१.७ | १२७.४ | १४१.४ | १६०.९ |
| ५७४ | ४३२ | ३६३ | २९५ | |
| ३.२ | -७.० | -९.५ | -१०.० |
(ii) ऑक्सीजन के प्रति प्रतिक्रिया: हलोजन ऑक्सीजन के साथ कई आक्साइड बनाते हैं, लेकिन इनमें से अधिकांश अस्थायी होते हैं। फ्लोरीन दो ऑक्साइड,
क्लोरीन, ब्रोमीन और आयोडीन ऑक्सीडेज, जिनमें इन हालोजनों की ऑक्सीकरणीय स्थिति +1 से +7 तक की होती है, बनाते हैं। हालोजनों द्वारा बनाए गए ऑक्साइड्स की स्थिरता के लहजे का समावेश किनेटिक और थर्मोडायनामिक कारकों के कारण,
क्लोरीन ऑक्साइड्स,
ब्रोमीन ऑक्साइड्स,
आयोडीन ऑक्साइड्स,
(iii) धातुओं के प्रति प्रतिक्रिया: हालोजन धातु हैलाइड बनाने के लिए धातुओं के साथ प्रतिक्रिया करते हैं। उदाहरण के लिए, ब्रोमीन मैगनीशियम के साथ प्रतिक्रिया करके मैगनीशियम ब्रोमाइड देता है।
हैलाइड में आईयोनिक विशेषता तकनीकी रूप से
धातुओं और गैर-धातुओं के साथ क्लोरीन कोराइड बनाने के लिए कई प्रकार के विकिरणशीलता की रिएक्टिविटी: क्लोरीन ही संक्षार -1 ऑक्सीकरण अवस्था प्रदर्शित करता है जबकि अन्य हैलोजन
उदाहरण 7.12
अवरोधन ह्रास की उष्णता, इलेक्ट्रॉन प्राप्ति उष्णता और पानीकरण उष्णता जैसे पैरामीटर्स को ध्यान में रखते हुए, F2 और Cl2 की ऑक्सीकारक शक्ति की तुलना करें।
7.27 फ्लोरीन के विषम व्यवहार को दिखाने के लिए दो उदाहरण दें।
7.28 समुद्र हेलोनों का सबसे बड़ा स्रोत है। टिप्पणी करें।
छ्लोरीन
छ्लोरीन को 1774 में स्कीले ने एमसीटी के क्रिया द्वारा खोजा गया था। 1810 में डेवी ने इसकी तत्त्विक स्वभाव प्रस्तावित की और इसके रंग (यूनानी, क्लोरोस = हरी पीली) के कारण छ्लोरीन नाम सराहा।
तैयारी
यह निम्नलिखित विधियों में से किसी एक विधि द्वारा तैयार किया जा सकता है:
(i) साथ-साेधक हाइपोक्लोराइट के साथ जलीय हाइड्रोक्लोरीक अम्ल से मैंगनीज़ डाइऑक्साइड को गर्म करके।
हालांकि, आम नमक और केन्द्रित हीड्रोजन सल्फेट का मिश्रण
पत्रक
(ii) पोटेशियम परमैंगनेट पर
छ्लोरीन के उत्पादन
(i) डीकन की प्रक्रिया: वायुमंज्य ओक्सीजन के साथ पर्यावरणीय हाइड्रोजन क्लोराइड गैस को ऑक्सीकरण द्वारा उत्पादित करते हैं।
(ii) विद्युत्चुंबकीय प्रक्रिया: विद्युतानुक्रमण के द्वारा छ्लोरीन ब्राइन (केन्द्रित
गुण यह एक हरी पीली गैस है जिसमें तेजोंदर और समायोगी गंध होता है। यह हवा की तुलना मेंलगभग 2-5 गुना भारी होता है। यह हरी पीली तरल पदार्थ में द्रवीभूत हो सकता है जो
छ्लोरीन धातुओं और अधातुओं के साथ कई क्लोराइड बनाने के लिए प्रतिक्रिया करता है।
ही संस्करण:
यह जल से हाइड्रोजन के संयोजन के लिए महानता रखता है। यह हाइड्रोजन युक्त यौगिकों के साथ प्रतिक्रिया करके
अतिरिक्त अस्थायीता के साथ, जल्दी-से-पतली आयोडीनिक अम्ल उत्पन्न करने के लिए, क्लोरीन पानी अपना पीला रंग खो देता है। Chlorine water on standing loses its yellow colour due to the formation of HCl and HOCl. हाइपोक्लोरस अम्ल
(i) यह फेरस को फेरिक और सल्फाइट को सल्फेट में ऑक्सीडेशन करता है। क्लोरीन सल्फर डाइऑक्साइड को सल्फर ट्राइऑक्साइड और आयोडीन को आयोडेट में ऑक्सीडेशन करता है। पानी की मौजूदगी में वे यहां बने सल्फ्यूरिक अम्ल और इडिक अम्ल बनाते हैं।
(ii) यह एक मजबूत विद्युत्क्षारक है; विद्युद्दीपन क्रिया क्षारीकरण के कारण होती है।
रंगीन पदार्थ
प्रयोग: यह उपयोग किया जाता है
(i) कागज और रेयॉन के निर्माण के लिए लकड़ी को क्षारीभूत (आवश्यक है), सूती और वस्त्रों को क्षारीभूत बनाने के लिए,
(ii) सोने और प्लैटिनम की निकासी में,
(iii) रंगों, दवाओं और
उदाहरण 7.13
गर्म और संकुचित
समाधान
हाँ, क्लोरीन को शून्य ऑक्सीकरण स्थिति से -1 और +5 ऑक्सीकरण स्थितियों में बदल दिया जाता है।
इन्टेक्स्ट प्रश्न
7.29
7.30 क्लोरीन गैस से तैयार किए जा सकने वाले दो जहरीले गैसों का नाम बताएं।
7.20 हाइड्रोजन क्लोराइड
ग्लॉबर ने 1648 में इस एम्ल को संकुचित सल्फ्यूरिक एम्ल के साथ साधने से तैयार किया। डेवी ने 1810 में दिखाया कि यह हाइड्रोजन और क्लोरीन का यौगिक है।
प्रस्तुतिकरण प्रयोगशालाओं में, यह सूजने वाले सोडियम क्लोराइड को साथ संकुचित सल्फ्यूरिक एम्ल के साथ तापाने से तैयार किया जाता है।
तैयार किए जाव सकने वाले एचसीएल गैस को संकुचित सल्फ्यूरिक एम्ल के माध्यम से पास कराकर सुखाया जा सकता है।
गुण यह एक अस्पष्टतमक और कटु द्वारा ध्वनित गैस है। यह आसानी से वर्णहीन द्रव्य बनाने के लिए तरली गैस में परिवर्तित होता है (बेपी
इसका आक्वस समाधान हाइड्रोक्लोरिक एम्ल कहलाता है। विलयन स्थिति के उच्च मान
सामंजस्य पुर्वकेंद्री एचसीएल और एकाग्र
$$ \begin{aligned}
आईये हम शुरू करते हैं।
& \mathrm{Au}+4 \mathrm{H}^{+}+\mathrm{NO_3}^{-}+4 \mathrm{Cl}^{-} \rightarrow \mathrm{AuCl_4}^{-}+\mathrm{NO}+2 \mathrm{H_2} \mathrm{O} \ & 3 \mathrm{Pt}+16 \mathrm{H}^{+}+4 \mathrm{NO_3}^{-}+18 \mathrm{Cl}^{-} \rightarrow 3 \mathrm{PtCl_6}^{2-}+4 \mathrm{NO}+8 \mathrm{H_2} \mathrm{O} $$
हाइड्रोक्लोरिक एसिड, कमजोर एसिडों के लवज़मता, उदाहरण के लिए कार्बोनेट्स, हाइड्रोजनकार्बनेट्स, सल्फाइट्स, इत्यादि की खड़ेदी को विभाजित करता है।
प्रयोग: इसका उपयोग (आई) जलकरन बनाने,
7.21 हलोजन्स के ऑक्सओएसीड
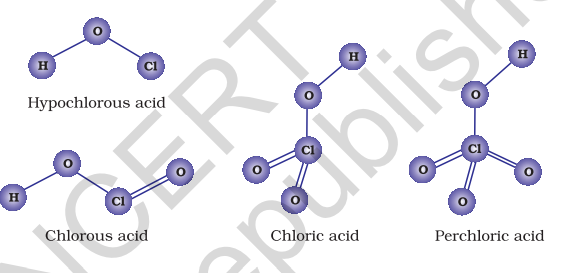
उच्च द्वद्वत्व और छोटे आकार के कारण, फ्लोरीन केवल एक ऑक्सोएसिड बनाता है, जिसे फ्यूरिक (I) एसिड या हाइपोफ्लोरस एसिड के रूप में जाना जाता है। दूसरे हैलोजन्स अपने कई ऑक्सोएसिड बनाते हैं। ज्यादातर उन्हें शुद्ध अवस्था में अलग नहीं किया जा सकता है। वे केवल जलीय समाधानों में या अपने लवणों के रूप में स्थिर होते हैं। हालोजन्स के ऑक्सोएसिड्स को टेबल 7.10 में दिया गया है और उनकी संरचनाएँ चित्र 7.8 में दी गई हैं।
टेबल 7.10: हलोजन्स के ऑक्सओएसिड्स
| हालिक (I) एसिड (हाइपोहैलक एसिड) |
HOF (हाइपोफ्लोरस एसिड) |
HOCl (हाइपोक्लोरस एसिड) |
HOBr (हाइपोब्रोमस एसिड) |
HOI (हाइपोआयोडस एसिड) |
|---|---|---|---|---|
| हालिक (III) एसिड (हेलोस एसिड) |
- | HOCIO (क्लोरस एसिड) |
- | - |
| हालिक (V) एसिड (हेलिक एसिड) |
- | (क्लोरिक एसिड) |
(ब्रोमिक एसिड) |
(आयोडिक एसिड) |
| हालिक (VII) एसिड (परहालिक एसिड) |
- | (परक्लोरिक एसिड) |
(परब्रमिक एसिड) |
(पेरआयोडिक एसिड) |
7.22 इंटरहालोजन संयोजन
जब दो अलग-अलग हालोजन आपस में प्रतिक्रिया करते हैं, तो उनका इंटरहालोजन संयोजन बनता है। उन्हें
तैयारी इंटरहैलोजेन संयोजन या निम्न इंटरहैलोजेन यौगिकों पर हैलोजेन के कार्रवाई द्वारा तैयार किए जा सकते हैं। उत्पाद बनता है कुछ विशेष स्थितियों पर निर्भर करता है, उदाहरण के लिए,
गुण पारतांत्रिक यौगिकों के कुछ गुण टेबल 7.11 में दिए गए हैं
ये सभी सह-संपोषी अणु हैं और पारमैग्नेटिक प्रकृति हैं। वे
उनके रासायनिक प्रतिक्रिया संवर्धित हलोजेन के साथ तुलना की जा सकती है। सामान्यतः, इंटरहैलोजेन यौगिक हलोजेनों ( फ्लोरीन को छोड़कर ) की तुलना में अधिक प्रतिक्रियाशील होते हैं। यह इसलिए है क्योंकि इंटरहैलोजेन में
उनके आण्विक संरचनाएँ बहुत रोचक होती हैं जिन्हें वीएसईपीआर सिद्धांत (उदाहरण 7.14) के आधार पर समझाया जा सकता है।
उदाहरण 7.14 वीएसईपीआर सिद्धांत के आधार पर
समाधान केंद्रीय परमाणु
उपयोग: इन यौगिकों को गैर जलीय विलयकों के रूप में उपयोग किया जा सकता हैं। इंटरहैलोजेन यौगिकों को बहुत उपयोगी फ्लोरीनोजनन कारकों के रूप में इस्तेमाल किया जाता है।
भीतरी प्रश्न
7.31 क्यों ICl से I2 अधिक प्रतिक्रियाशील होता है?
7.23 समूह 18 तत्व
समूह 18 में हीलियम, नीओन, आर्गन, क्रिप्टॉन, जेनॉन, रेडन और ओगनेसन तत्वों के होते हैं। ये सभी गैस होते हैं और रासायनिक रूप से दुर्बल होते हैं। इनके कुछ ही यौगिक बनते हैं, इसलिए इन्हें आदर्श गैस समझा जाता है।
7.23.1 घटना
इन सभी गैसों को रेडोन और ओगनेसन को छोड़कर परमाणुमंडल में पाया जाता है। सूखे हवा में उनकी वायुमंडलिय प्रमाणिता यापन ~ 1% है जिसमें अर्गन मुख्य घटक है। हीलियम और कभी-कभी नियोन तत्विक प्रकृति के खनिजों में पाये जाते हैं जैसे कि पिचब्लेंड, मोनाजाइट, क्लेवाइट। हीलियम का मुख्य वाणिज्यिक स्रोत प्राकृतिक गैस होता है। जेनॉन और रेडोन समूह के सबसे दुर्लभ तत्व हैं। रेडोन को
उदाहरण 7.15 समूह 18 के तत्वों को महान गैस क्यों कहा जाता है ?
हल समूह 18 में मौजूद तत्वों को उनके market shell ओर्बिटलों में पूर्णतः बटोरकर उनको सिर्फ कुछ तत्वों के साथ कुछ शर्तों के तहत भाग लेते हैं। इसलिए, उन्हें अब महान गैस के नाम से जाना जाता है।
समूह 18 तत्वों की महत्वपूर्ण पारमाणिक और भौतिक गुणों के साथ उनके इलेक्ट्रॉनिक कॉन्फिगरेशंस को टेबल 7.12 में दिया गया है। समूह के कुछ पारमाणिक, भौतिक और रासायनिक गुणों की प्रवृत्तियां यहां चर्चा की गई है।
टेबल 7.12 : समूह 18 तत्वों की परमाणु और भौतिक गुण
| गुण | ||||||
|---|---|---|---|---|---|---|
| परमाणु संख्या | 2 | 10 | 18 | 36 | 54 | 86 |
| परमाणु मास |
4.00 | 20.18 | 39.95 | 83.80 | 131.30 | 222.00 |
| इलेक्ट्रॉनिक कॉन्फिगरेशन | ||||||
| परमाणु त्रिज्या /पीएम | 120 | 160 | 190 | 200 | 220 | - |
| आयननीकरण उत्सर्जन ऊष्मा |
2372 | 2080 | 1520 | 1351 | 1170 | 1037 |
| इलेक्ट्रॉन प्राप्ति उत्सर्जन ऊष्मा |
48 | 116 | 96 | 96 | 77 | 68 |
| घनत्व (STP पर) |
||||||
| पिघलने का बिंदु /के | - | 24.6 | 83.8 | 115.9 | 161.3 | 202 |
| उबलने की बिंदु /के | 4.2 | 27.1 | 87.2 | 119.7 | 165.0 | 211 |
| वायुमंडलीय सामग्री (प्रतिशत मात्रा में) |
- | 0.934 |
7.23.2 इलेक्ट्रॉनिक कॉन्फिगरेशन
सभी महान गैसों की सामान्य इलेक्ट्रॉनिक कॉन्फिगरेशन
7.23.3 आयननीकरण उत्सर्जन ऊष्मा
स्थिर इलेक्ट्रॉनिक कॉन्फिगरेशन के कारण इन गैसों की आयननीकरण उत्सर्जन ऊष्मा बहुत ऊच्च होती है। हालांकि, परमाणु के आकार में वृद्धि के साथ ये नीचे की और घटती है।
7.23.4 परमाणु त्रिज्या
परमाणु त्रिज्या परमाणु क्रमांक में वृद्धि के साथ बढ़ती है।
7.23.5 इलेक्ट्रॉन प्राप्ति उत्सर्जन ऊष्मा
ज्योंकि महान गैसों में स्थिर इलेक्ट्रॉनिक संरचना होती है, इसलिए उन्हें इलेक्ट्रॉन स्वीकार करने की कोई प्रवृत्ति नहीं होती है और इसलिए, उनके पास इलेक्ट्रॉन लाभ उष्मा के महान सकारात्मक मान होते हैं।
भौतिक गुण
सभी महान गैस एकाण गैस होते हैं। वे रंगहीन, गंधहीन और स्वादहीन होते हैं। वे पानी में धीमी प्रवाह्यता रखते हैं। ये बहुत कम पिघलने और उबलने के बिंदु होते हैं क्योंकि इन तत्वों में केवल एक ही प्रकार का इंटरऐटॉमिक परसंचरण होता है जो कि कमजोर छिड़कने वाली बालस्त्रोत होती है। हिलियम (
रासायनिक गुण आमतौर पर, नोबल गैसस असब्जुक अधिकतम प्रतिक्रिया के साथ; उनकी रासायनिक प्रतिक्रिया की असंकरणता के निमित्तों के लिए लिया जाता है:
(i) हीलीयम को छोड़कर सभी नोबल गैसों में वे पूरी तरह से भरी हुई
(ii) उनके पास उच्च आयनन उष्मा और अधिक सकारात्मक इलेक्ट्रॉन मिलान उष्मा है।
नोबल गैसों की प्रतिक्रिया को सन 1962 में नील बार्टलेट ने अध्ययन किया गया था, जब उन्हें देखा गया कि मौलिक ऑक्सीजन (
क्रिप्टन के कम्पाउंड कुछ ही हैं। केवल द्व्या संकरण को अभ्यासित किया गया है (
(ए) जीर्णसारणी - फ्लोरीन के कम्पाउंड
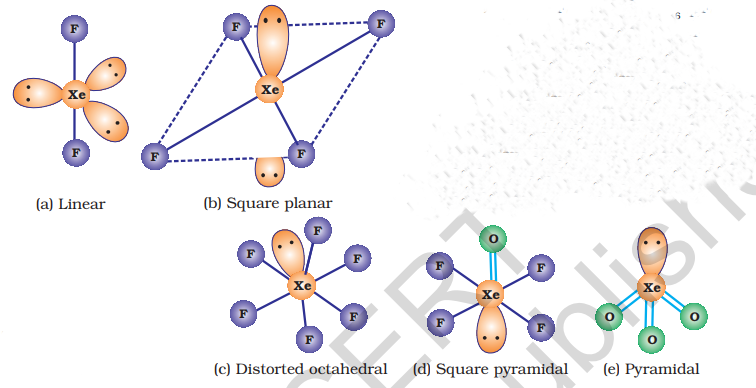
जीर्णसारणी ऐकाई अधिकतम सत्यापित प्रयोगात्मक स्थितियों के तहत तत्वों के प्रत्यक्ष प्रतिक्रिया के द्वारा तीन बाईनरी फ्लोराइड,
तीन जेनॉन फ्लोराइड के संरचनाएँ VSEPR से निर्धारित की जा सकती हैं और ये चित्र 7.9 में दिखाई जाती हैं।
जीनॉन फ्लोराइड्स फ्लोराइड आयन स्वीकारकों के साथ केतनायुक्तीय प्रदाता जथा फ्लोराइड आयन दाता के साथ फ्लोरोआनियों का निर्माण करते हैं।
(b) जेनॉन-ऑक्सीजन यौगिक
उपयोग: हेलियम एक नॉन-इन्फ्लेमेबल और हल्का गैस है। इसलिए, यह आब्रवाणीय अनुसंधानों के लिए गुब्बारों को भरने में प्रयोग किया जाता है। यह गैस-सभ्यत पर आधारित परमाणु रिएक्टरों में भी प्रयोग किया जाता है। प्रयोगतम हीलियम (
Neon विज्ञापन प्रदर्शन उद्देश्यों के लिए डिस्चार्ज ट्यूब्स और फ्लोरेसेंट बल्ब्स में उपयोग होता है। निसर्ग उद्यानों और हरियाली घरों में न्यून बल्ब्स का उपयोग होता है।
आर्गन मुख्य रूप से ऊष्मीय कार्यों (धातुओं या धातुमिश्रणों की विद्युत विधुत के लिए) में नीष्पादनात्मक वातावरण प्रदान करने के लिए उपयोग होता है और बिजली बल्ब्स को भरने के लिए भी उपयोग होता है। यह प्रयोगशाला में वायु संवेदनशील पदार्थों का हार्डलिंग करने के लिए भी उपयोग होता है। क्षेत्रीय और अर्धशीतल ग्रहणों के लिए विशेष उद्देश्यों के लिए जहां भी क्षुद्र प्रयोगों के कोई महत्वपूर्ण उपयोग नहीं होते हैं, क्सेनॉन और क्रिप्टॉन का उपयोग होता हैं।
इंटेक्स्ट प्रश्न
7.32 डाइविंग उपकरण में हिलियम का उपयोग क्यों होता है?
7.33 निम्नलिखित समीकरण को संतुलित करें: XeF6 + H2O ® XeO2F2 + HF
7.34 रेडॉन के रासायनिकता का अध्ययन करने में कठिनाई क्यों आई है?
संक्षेपण
आवर्त सारणी के समूह 13 से 18 में -ब्लॉक पदार्थ शामिल होते हैं जिनका मूलभूत इलेक्ट्रानीय कंफ़िगरेशन होता है
समूह 15 में पांच तत्व होते हैं, निम्नलिखित हैं: N, P, As, Sb और Bi जिनका सामान्य इलेक्ट्रानीय कंफ़िगरेशन होता है
डाईनाइट्रोजेन को प्रयोगशाला और औद्योगिक स्तर पर तैयार किया जा सकता है। इसके सभी ऑक्साइड विभिन्न ऑक्सीकरण स्थितियों में उत्पन्न होते हैं जैसे
फॉस्फोरस प्राणीय रूप में
समूह 16 के तत्वों की सामान्य इलेक्ट्रॉनिक कॉन्फ़िगरेशन
तत्व समूह 17 आवर्ती सारणी का निम्नलिखित होते हैं: F, Cl, Br, I और At। ये तत्व बहुत प्रतिक्रियाशील होते हैं और इसलिए वे केवल मिश्रित रूप में पाए जाते हैं। इन तत्वों की सामान्य ऑक्सीडेशन स्थिति -1 होती है। हालांकि, उच्चतम ऑक्सीडेशन स्थिति +7 हो सकती है। इनमें भौतिक और रासायनिक गुणों में नियमित ग्रेडेशन देखी जाती है। ऑक्साइड, हाइड्रोजन हैलाइड, इंटरहैलोजन यौगिक और ऑक्सोएसिड बनाते हैं। क्लोरीन को
तत्व समूह 18 आवर्ती सारणी में नोबल गैसों से मिलता है। उनकी संपूर्णता घेरावाली परत के कारण, उनका कम कंपाउंड बनाने का प्रवृत्ति कम होता है। सर्वश्रेष्ठ विशेषित कंपाउंड चार समयी और ऑक्सीजन के साथ केवल यथाशक्ति स्थितियों में होता है। इन गैसों के कई उपयोग हैं। अर्गन निष्क्रिय माहौल प्रदान करने के लिए प्रयोग किया जाता है, हिलियम मौसमी अवलोकन के लिए गुब्बारों में भराई जाती है, नियन विधुत ट्यूब्स और फ्लोरेसेंट बल्ब्स में प्रयोग किया जाता है।
Abhyaas
7.1 इलेक्ट्रॉनिक कॉन्फ़िगरेशन, ऑक्सीडेशन स्थिति, परमाणु आकार, आयननीय ऊष्मा और इलैक्ट्रोनेगेटिविटी के संदर्भ में समूह 15 के तत्वों की सामान्य विशेषताओं पर चर्चा करें।
7.2 ज्ञान की प्रतिक्रिया फॉस्फोरस से नाइट्रोजन से अलग क्यों होती है?
7.3 ग्रुप 15 तत्वों की रासायनिक प्रतिक्रिया के बारे में चर्चा करें।
7.4
7.5 नाइट्रोजन को प्रयोगशाला में कैसे तैयार किया जाता है? संघटनों में शामिल होने वाले रासायनिक समीकरणों की विचार श्रेणियों को लिखें।
7.6 अमोनिया औद्योगिक रूप से कैसे निर्मित होता है?
7.7 ऊपरी कोपर धातु
7.8
7.9 एचएनएच कोण मान HPH, HAsH और HSbH कोणों से अधिक है। क्यों? [संकेत: एनएच 3 में
7.10 क्यों
7.11
7.12 नाइट्रोजन द्विपदात्मक अणु के रूप में मौजूद होता है और फास्फोरस
7.13 सफेद फॉस्फोरस और लाल फॉस्फोरस की गुणों के मुख्य अंतरों को लिखें।
7.14 नाइट्रोजन फॉस्फोरस से केटेनेशन गुणों की तुलना में कम दिखाता है, क्यों?
7.15
7.16 क्या
7.17 पेरियोडिक सारणी में
7.18 डाईऑक्सीजन एक गैस क्यों है, हालांकि सल्फर एक ठोस है?
7.19
(संकेत: यौगिकों के गठन में जाली ऊर्जा का पक्ष ध्यान में रखें।)
7.20 ओजोन ग्रस्तिकरण किस विषक द्वारा कराए जाते हैं?
7.21 संपर्क प्रक्रिया द्वारा
7.22 क्यों
7.23 हैलोजन शक्तिशाली ऑक्सीकरण एजेंट क्यों होते हैं?
7.24 स्पष्ट करें कि केवल फ्लोरीन एक ऑक्सोएसिड, HOF बनाता है।
7.25 आपसी में लगभग समान इलेक्ट्रोनदांशता के बावजूद, नाइट्रोजन हाइड्रोजन बॉन्ड बनाते हैं जबकि क्लोरीन नहीं।
7.26
7.27 हैलोजन क्यों रंगीन होते हैं?
7.28
7.29
7.30 एन. बार्टलेट को क्या प्रेरित किया है जी-और
7.31 निम्नलिखित में फास्फोरस की ऑक्सीकरण अवस्थाएं क्या हैं:
(i)
(ii) एक पासली में नाइट्रोजन के साथ योदीन जीस को गर्म किया जाता है. (iii) जल में नाइट्रोजन के समाधान में क्लोरीन गैस दिया गया है. (iv) जल में सिल्वर नाइट्रेट के समाधान में सोडियम की रजत पत्थर दिया गया है. (v) दिमागी हंगामा.






