इकाई 6: तत्वों के मोटाई निकायों की सामान्य सिद्धांत और प्रक्रियाएँ
कुछ तत्व जैसे कार्बन, सल्फर, सोना और नोबल गैस, पृथ्वी की धरातल में मुक्त अवस्था में पाए जाते हैं, जबकि दूसरे संयुक्त रूप में पाए जाते हैं। किसी तत्व को इसके संयुक्त रूप से अलग करने और अलग करने की प्रक्रिया में रासायनिक नियमों के विभिन्न सिद्धांतों की आवश्यकता होती है। एक विशेष तत्व विभिन्न यौगिकों में पाया जा सकता है। धातुविज्ञान और अलगाव की प्रक्रिया ऐसी होनी चाहिए कि यह रासायनिक रूप से संभव और वाणिज्यिक रूप से उचित हो। फिर भी, कुछ सामान्य सिद्धांत सभी धातुओं की अलगाव प्रक्रियाओं में सामान्य होते हैं। एक विशेष धातु प्राप्त करने के लिए, सबसे पहले हम खानन द्वारा प्राप्त पृथ्वी की धरातल में प्राकृतिक रूप से पाये जाने वाले खनिजों की तलाश करते हैं। जिनमें से बहुत से खनिजों में एक धातु पाई जा सकती है, केवल कुछ ही उस धातु के स्रोत के रूप में उपयोगी हो सकते हैं। ऐसे खनिजों को उदाहरणस्वरूप दिया जाता है।
धातुओं के एकमात्र खनिज में अक्सर केवल एक चाहिए। आमतौर पर इसमें काष्ठीय या अवांछित पदार्थों के साथ मिश्रित होता है जिसे गैंग कहते हैं। खनिजों से धातुओं को अलग करने और अलग करने की प्रक्रिया में निम्नलिखित प्रमुख चरण शामिल होते हैं।
- खनिज का सम्मिलित सबसे बड़ा तत्व,
- सममिश्रित खनिज से धातु का अलगाव, और
- धातु की शुद्धि।
खनिजों से धातुओं के अलगाव के लिए उपयोग किए जाने वाले पूरा वैज्ञानिक और प्रौद्योगिकीय प्रक्रिया को धातुरसायन के नाम से जाना जाता है।
6.1 धातुओं का पाया जाना
इस वर्तमान यूनिट में, पहले हम कुछ महत्वपूर्ण खनिजों के प्रभावी सांग्रहीकरण के लिए विभिन्न चरणों का वर्णन करेंगे। उसके बाद हम कुछ सामान्य धातुविद्युतीय प्रक्रियाओं में शामिल गुणधर्मिक और वैद्युतिकी आयामों की नीतियों पर चर्चा करेंगे, जो कि सबसे प्रभावी ढलाई धातु से लौह है।
तत्वों की प्रमुखता भिन्न होती है। बाध्य पदार्थों में से, एल्युमिनियम सबसे अधिक मिलता है। यह धरातल के तृतीय सबसे अधिक मिलने वाला तत्व है (
विशेष रूप से, एक खनिज में केवल एक चाहिए। यह आमतौर पर धातुरस के साथ प्रदूषित होता है। खनिजों से धातुओं के अलगाव में निम्नलिखित प्रमुख चरण शामिल होते हैं।
- खनिज की सांग्रही,
- सम्मिश्रित खनिज से धातु का अलगाव, और
- धातु की शुद्धि।
खनिजों के स्रोत वाले धातुओं के अलगाव के लिए इस्तेमाल किया जाने वाली पूरी वैज्ञानिक और प्रौद्योगिकीय प्रक्रिया को धातुरसायन के नाम से जाना जाता है।
चर्चा 6.1 में कुछ महत्वपूर्ण धातुओं के मुख्य खनिजों की जानकारी दी गई है।
तालिका 6.1: कुछ महत्वपूर्ण धातुओं के मुख्य खनिज
| धातु | संयोजन | |
|---|---|---|
| एल्युमिनियम | बोक्साइट | |
| लोहा | ||
| काॅलिनाइट (मिट्टी का एक रूप) | ||
| हेमेटाइट | ||
| मैगनेटाइट | ||
| लोहा पाइराइट | ||
| कॉपर पाइराइट | ||
| मैलाकाइट | ||
| कुप्राइट |
| | कॉपर ग्लांस |
एल्यूमीनियम के लिए, बॉक्साइट का चयन किया जाता है। लोहे के लिए, सामान्यतः जो अधिक मात्रा में मौजूद होते हैं और प्रदूषक गैस (जैसे
खनिज से अनावश्यक सामग्री (जैसे, रेत, मिट्टी आदि) को हटाना संकेंट्रेशन, ड्रेसिंग या बेनिफशन के रूप में जाना जाता है। इसमें कई कदम शामिल होते हैं और इन कदमों का चयनण कम्पाउंड के चिकित्सा में मौजूद धातु और गैंग की शारीरिक गुणों के अंतर पर निर्भर करता है। धातु का प्रकार, उपलब्ध सुविधाओं और पर्यावरणीय कारकों का भी ध्यान रखा जाता है। कई महत्वपूर्ण प्रक्रियाएं नीचे वर्णित हैं।
6.2 खानिजों का संकेंट्रेशन
खनिज से अनावश्यक सामग्री (जैसे, रेत, मिट्टी आदि) को हटाना को संकेंट्रेशन, ड्रेसिंग या बेनिफशन के रूप में जाना जाता है। केंद्रीयकरण के लिए आगे बढ़ने से पहले, खानिजों को ग्रेड किया जाता है और सामयिक आकार में पीसा जाता है। खनिजों की संकेंट्रेशन में कई कदम होते हैं और इन कदमों का चयनण कम्पाउंड के चिकित्सा में मौजूद धातु और गैंग की शारीरिक गुणों के अंतर पर निर्भर करता है। धातु का प्रकार, उपलब्ध सुविधाओं और पर्यावरणीय कारकों का भी ध्यान रखा जाता है। कई महत्वपूर्ण प्रक्रियाएं खनिजों की संकेंट्रेशन के लिए नीचे वर्णित हैं।
6.2.1 जलधुलाई
यह खनिज पदार्थ और गैंग अणुओं के अपने विशेष तार भेद एवं पथरीख srcin gने बात के आधार पर है। इसलिए यह गुरुत्वाकर्षण का एक प्रकार है। इस प्रक्रिया में, पीसा हुआ खनिज पदार्थ को उठते हुए पानी की धार में धोने के लिए इस्तेमाल किया जाता है। हल्के गैंग अणु धोए जाते हैं और भारी खनिज अणु पीछे छोड़ दिए जाते हैं।
6.2.2 चुंबकीय अलगाव

यह खनिज संबंधी विभिन्न चुंबकीय गुणों के अंतर पर आधारित है। यदि या तो खनिज या गैंग चुंबकीय क्षेत्र की ओर आकर्षित हो रहे हों, तो अलगाव इसी विधि से किया जाता है। उदाहरण के लिए लोहे के खनिज चुंबकीय आकर्षित होते हैं, इसलिए, गैर–चुंबकीय अवशेष चुंबकीय अलगाव का उपयोग करके उनसे अलग हो सकते हैं। पीसा हुआ खनिज पदार्थ एक यातायाती पट्टी पर गिराया जाता है जो एक चुंबकीय रोलर पर चलती है (चित्र.6.1) चुंबकीय पदार्थ पट्टी की ओर आकर्षित होता है और उसके पास गिर जाता है।
6.2.3 फ्रॉथ फ्लोटेशन विधि

इस तकनीक का उपयोग सल्फाइड खनिजों से गंगा को हटाने के लिए किया जाता है। इस प्रक्रिया में, पाउडर वाले खनिज के सस्पेंशन को पानी के साथ तैयार किया जाता है। उसे कलेक्टर्स और फ्रॉथ स्टेबलाइजर्स के साथ मिलाया जाता है। कलेक्टर्स (जैसे, पाइन तेल, चर्बी वाले अम्ल, क्सांथेट्स, आदि) मिनरल के कणों की गैर-भिगोनेयता को बढ़ाते हैं और फ्रॉथ स्टेबलाइजर्स (जैसे, क्रेसोल्स, ऐनिलाइन) फ्रॉथ को स्थिर करते हैं।
मिनरल कण तेल द्वारा गीले हो जाते हैं जबकि गंगा कण पानी द्वारा गीले होते हैं। एक घुमावदार पैडल मिश्रण को हिला देता है और उसमे हवा खींचता है। इसके परिणामस्वरूप, फ्रॉथ बनता है जो मिनरल कणों को ले जाता है। फ्रॉथ हल्का होता है और उसे ऊपर से हटा लिया जाता है। उसके बाद, खनिज कणों की पुनर्प्राप्ति के लिए इसे सुखाया जाता है।
कभी-कभी, तेल के प्रतिशत को पानी के साथ समानुपातित करके या ‘नीचे दबानेवालों’ का उपयोग करके दो सल्फाइड खनिजों को अलग करना संभव होता है। उदाहरण के रूप में, ZnS और PbS की सामग्री युक्त एक खनिज में, नीचे दबानेवाला उपयोग किया जाता है NaCN होता है। इससे यह करीब ZnS को फ्रॉथ में न आने देता है लेकिन PbS को फ्रॉथ के साथ आने देता है।
अभिनव धोबिन
यदि किसी का वैज्ञानिक दृष्टिकोण हो और वह अवलोकनों में अत्यंत सतर्क हो, तो वह अद्भुत काम कर सकता है। एक धोबिन को ऐसी ही अद्वितीय दिमाग होती थी। एक माइनर के ओवरोल को धोते समय, उसने देखा कि रेत और इसी तरह के मिटटी वाले कीच बाल्टी के नीचे गिर जाते हैं। इसमें अजीब बात थी कि, खनिज संयंत्र से आये कॉपर संयंत्र यौगिक सबुनेड्स में फंस जाते थे और फिर वे ऊपर आ जाते थे। उसके एक ग्राहक, मिसिज कैरी इवर्सन एक रासायनिकविद् थीं। धोबिन ने अपने अनुभव को मिसेज इवर्सन को बताया। इसके बाद, उसने सोचा कि इस विचार का उपयोग बड़े पैमाने पर पत्थरी और मिटटी सामग्री से कॉपर यौगिकों को अलग करने के लिए किया जा सकता है। इसी तरह एक आविष्कार उद्भव हुआ। उस समय केवल उन ही खनिजों का उपयोग किया जाता था जिनमें अधिक मात्रा में धातु होती थी। वाष्पण पदार्थ विधि की आविष्कार ने कॉपर खनन को कारगर बना दिया था ताकि किमी स्तरीय खनिजों से भी यह संभव हो सके। कॉपर के जगतव्यापी उत्पादन ने चरण बढ़ा दिया और धातु सस्ती हो गई।
6.2.4 लीचिंग
अगर खनिज को किसी उपयुक्त विलयक में विलय्य होता है तो अक्सर लीचिंग का उपयोग किया जाता है। निम्नलिखित उदाहरणों में प्रक्रिया का वर्णन किया गया है:
(a) बॉक्साइट से एल्यूमिना की लीचिंग
एल्यूमिनियम का प्रमुख खनिज, बॉक्साइट, सामान्यतया
जड़त्व में अल्यूमिनेट को
सोडियम सिलिकेट समाधान में रहता है और जले हुए एलमिना को छाना, सुखाना और गर्म करके पूर्ण
(b) अन्य उदाहरण
चांदी और सोने के धातु के लोहमियता में, संबंधित धातु को हल्के समाधान से उत्तेजित
इंटेक्स्ट प्रश्न
6.1 कौन से खनिजों को ताल से पृथक्करण में संकेंद्रण विधि द्वारा सारगर्भित किया जा सकता है?
6.2 अल्यूमीनियम की निष्कर्षण में ल्युचन का महत्व क्या है?
6.3 पृथ्वीकृत खनिज से क्रूड धातु की निर्माण
सारगर्भित खनिज से धातु को निकालने के लिए, यह एक रूप में परिवर्तित किया जाना चाहिए जो धातु निर्धारित करने के लिए उपयुक्त हो। आमतौर पर सल्फाइड खनिजों को संकुचित करने से पहले ऑक्साइड में परिवर्तित किया जाता है क्योंकि ऑक्साइड कम परिवर्तन के होते हैं। इस प्रकार, सारगर्भित खनिज से धातु निकालने में दो मुख्य चरण शामिल होते हैं, अर्थात,
(a) ऑक्साइड में परिवर्तन, और (b) धातु में घटाना।
( a ) ऑक्साइड में परिवर्तन
(i) कैल्सिनेशन: कैल्सिनेशन में गर्म होता है। इसमें परिवर्तित होने वाला वायुमुक्त पदार्थ हटा देता है, जिससे धातु ऑक्साइड छोड़ जाता है:
(ii) भूराशि: भूराशि में, धातु को धातु के पिघलने के समय से नीचे तापमान पर भट्ठी में एक नियमित आवंटन के साथ हवा के आगमन में गर्म किया जाता है। कुछ सल्फाइड खनिजों को शामिल करने वाले प्रतिक्रियाओं में होते हैं:
तांबे के सल्फाइड खनिजों को पुनरविर्बरेशनी भट्ठी में गर्म किया जाता है [चित्र 6.3]। यदि खनिज में लोहा होता है, तो इसे गर्म करने से पहले सिलिका के साथ मिश्रित किया जाता है। लोहा ऑक्साइड ‘slags of’ (*) के रूप में जोड़ा जाता है और तांबा मेट्र्स के रूप में उत्पन्न होता है जो Cu2S और FeS की रूप में होता है।
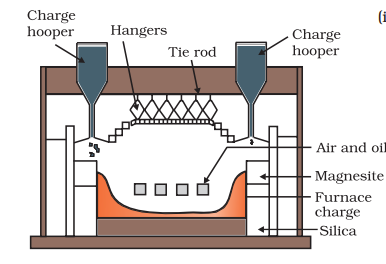
उत्पन्न एसओ2 का उपयोग H2SO4 निर्माण के लिए किया जाता है।
(बी) धातु के ऑक्साइड को धातु में कम करना
धातु के ऑक्साइड को सामान्यतया इसे धातुसंकुचक एजेंट (सी या सीओ या यहां तक कि कोई दूसरा धातु भी) के साथ इसे गर्म करके कम किया जाता है। धातुसंकुचक एजेंट (उदाहरण के लिए, कार्बन) धातु के ऑक्साइड के ऑक्सीजन के साथ मिल जाता है।
कुछ धातु ऑक्साइड आसानी से कम हो जाते हैं जबकि कुछ बहुत कठिन होते हैं (कमी का मतलब है धातु आयन द्वारा इलेक्ट्रॉन, आदिक कार्यकर्ता की). किसी भी स्थिति में, गर्मी की आवश्यकता होती है।
6.4 धातुरशि विज्ञान के थर्मोडायनामिक सिद्धांत
थर्मोडायनामिक के कुछ मूल सिद्धांत हमें धातुरशि परिवर्तन की सिद्धांत को समझने में मदद करते हैं। गिब्स ऊर्जा यहां सबसे महत्वपूर्ण शब्द है। किसी निर्दिष्ट तापमान पर किसी भी प्रक्रिया के लिए गिब्स ऊर्जा का बदलाव,
यहां,
यहां,
1. जबकि समीकरण 6.14 में
2. यदि दो प्रतिक्रियाओं के अभिक्रिया और उत्पादों को एक प्रणाली में मिलाया जाता है और दो संभावित प्रतिक्रियाओं का नेट
एलिंगहम आरेख
गिब्स ऊर्जा का ग्राफिक प्रतिनिधित्व पहली बार एच.जे.टी. एलिंगहम द्वारा किया गया था। इससे ऑक्साइड्स के घटन कराने में कम करने वाले एजेंट की चुनाव को मनोयोजित करने के लिए एक ध्वनित आधार प्रदान होता है। इसे एलिंगहम आरेख के रूप में जाना जाता है। ऐसे आरेख हमें किसी खनिज के तापावर्द्धन की व्यवहार्यता की पूर्वानुमान करने में मदद करते हैं। व्यवहार्यता की मापदंड है कि एक दिए गए तापमान पर, प्रतिक्रिया की गिब्स ऊर्जा नकारात्मक होनी चाहिए।
(a) एलिंगहम आरेख में सामान्यतः तत्वों के ऑक्साइड्स के निर्माण के लिए
इस प्रतिक्रिया में, गैसीय मात्रिका (इसलिए आणविक यात्रा) दाईं तरफ की गैस की दबावदायकता के सेवन के कारण कम हो रही है, जिससे समीकरण (6.14) में दूसरे पद की बदल जाती है। इसके पश्चात्
(b) प्रति प्लॉट एक सीधी रेखा होती है केवल जब कोई अवस्था में परिवर्तन (
(c) एक आरेख में ऐसा बिंदु होता है जिसके नीचे
(d) एक एलिंघम आरेखा में, सामान्य धातुओं और कुछ कम करने वाले यौगिकों के ऊर्जा स्तम्भों के लिए
(e) सल्फाइडों और हैलाइड्स के लिए भी वैसे ही आरेखाएं बनाई जाती हैं और यह स्पष्ट हो जाता है कि
एलिंघम आरेखा की सीमाएँ
1. यह ग्राफिक केवल यह दिखाता है कि एक प्रतिक्रिया संभव है या नहीं, अर्थात एक घटकनश्रेणी के साथ एक घटकनीय यौगिक की आवेदनाशीलता की प्रवृत्ति दिखाई जाती है। यह इसलिए होता है क्योंकि इसका आधार केवल थर्मोडायनामिक सिद्धांतों पर होता है। यह विघटन प्रक्रिया की नितांतता के किन क्षेत्रों में स्थिति को समझाने की क्षमता नहीं देता है। यह बता नहीं सकता कि घटना की गति कितनी हो सकती है? हालांकि, यह समझाता है कि प्रतिक्रिया क्यों धीमी होती है जब हर सामग्री सॉलिड अवस्था में होती है और स्मूथ होती है जब खानि पिघल जाता है। यह यहां रुचिकर है कि किसी भी रासायनिक प्रतिक्रिया के लिए डीएच (उष्मागति परिवर्तन) और डीएस (एंट्रोपी परिवर्तन) के मान तापमान पर भी अप्रत्याशित रूप से लगभग स्थिर रहते हैं। इसलिए, मस्तिष्कमें केवल वार्तांत्रिक समीकरण(6.14) में अधिक प्रभावशील परिवर्तनकारी द्विपारमांक होता है T। हालांकि, DS सौंदर्यिक स्थिति परंपरा पर काफी लगता है। क्योंकि अव्यवस्था या व्यवस्थित रात्रि में प्रभावित होता है, यह तब अधिक होगा जब एक यौगिक पिघलता है (s® l) या वाष्पीय होता है (l® g) क्योंकि फेज स्थिति स्थिर से प्रवर्तन पर अरण्यता या अनुक्रम की घटाव होती है।
2.
इसका सद्य नहीं होता क्योंकि प्रतिक्रिया उत्पन्न/उत्सर्जित मद सॉलिड हो सकती है। वाणिज्यिक प्रक्रियाओं में प्रतिक्रियाएं छोटे समय के लिए संपर्क में होती हैं।
उदाहरण 6.1 सफेद चूने को छड़ी करने के लिए मैग्नेशियम इस्तेमाल करने की एक स्थिति सुझाओ।
समाधान दो समीकरण होते हैं:
(a)
उस से नीचे मैग्नेशियम चूने को छड़ा सकता है।
उदाहरण 6.2
यद्यपि थर्मोडायनामिक रूप से संभव है, लेकिन व्यवहारिक रूप से, एल्युमीनियम के धातु संगठन में चूने को छड़ाने के लिए मैग्नेशियम मेटल प्रयोग नहीं किया जाता है। क्यों?
समाधान अंतरण बिंदु से कम तापमान पर, म्याग्नीशियम आलूमिना को कम कर सकता है। लेकिन प्रक्रिया अर्थशास्त्रिक रूप से अयोग्य होगी।
उदाहरण 6.3
लोहा ऑक्साइड के कम करने में सुविधाजनक क्यों होता है यदि उत्पन्न हुआ धातु तापमान पर तरल स्थिति में हो?
समाधान अगर धातु तरल स्थिति में हो, तो वेग में बढ़ोतरी होती है जब यह ठोस स्थिति में होती है। धातु के गुणों का मान
6.4.1 अनुप्रयोग
(अ) अपने ऑक्साइड से लौह का उत्पादन
लोहे के ऑक्साइड खनिज, अग्निनिर्माण/पचाना के माध्यम से (पानी को हटाने, कार्बोनेटों को विघटित करने और सल्फाइडों को ऑक्सिड करने के लिए) लाइमस्टोन और कोक के साथ मिश्रित किए जाते हैं और इसे एक ब्लास्ट भट्टी में ऊपर से भरा जाता है। यहां, ऑक्साइड धातु में कमी हो जाती है। न्यूमाइड्रेक सहायता करता है कि कोक ऑक्साइड को कम करता है और क्यों इस भट्टी को चुना जाता है। इस प्रक्रिया में एक मुख्य कटाक्ष स्टेप है:
इसे दो सरल विक्रिया के भूतल के रूप में देखा जा सकता है। एक में,
जब दोनों विक्रियाएँ घटित होती हैं तो समीकरण (6.24) के लिए निवेशी गिब्स-ऊर्जा परिवर्तन हो जाता है:
स्वाभाविक रूप से, इस परिवर्तन का होना संभव होगा जब समीकरण 6.25 को दिखाने वाले
(C,CO) नीचे जाता है। 1073K (लगभग) से ऊपर के तापमान पर,
धमाका भट्ठी में, विभिन्न तापमान सीमाओं में लोहा ऑक्साइडों का कमीकरण होता है। फर्नेस के नीचे से गर्म हवा उड़ाई जाती है और कोक
पुनः, कोक और
ब्लास्ट भट्टी से प्राप्त हुए लोहा लगभग 4% कार्बन और छोटी मात्रा में अन्य अशुद्धियों (जैसे एस, पी, एसआई, एमएन) को युक्त होता है। इसे पिग लौह के रूप में जाना जाता है और विभिन्न आकारों में ढलाई जाती है। पिघ लौह पिघ लौह से अलग होता है और गर्म हवा तेज करते हुए पिग लौह को टुकड़ा लौह और कोक के साथ पिघाया जाता है। इसमें थोड़ा कार्बन (लगभग 3%) होता है और यह अत्यंत कठोर और भंगुर होता है।
और घटाना
रजत या मृदु लोहा वाणिज्यिक लोहे का पवित्रतम रूप है और हेमाटाइट से आवरणित एक पुनरावृत्ति भट्टी में पिघ लोह से तत्वों का ऑक्सीकरण करके तैयार किया जाता है। हेमाटाइट कार्बन को कार्बन मोनोऑक्साइड में ऑक्सीकरण करती है:
फ्लक्स के रूप में लाइमस्टोन जोड़ा जाता है और गंधक, सिलिकॉन और फास्फोरस ऑक्सीकरण करके कच्चे से गुजरा जाता है। धातु हटाई जाती है और रोलर के माध्यम से द्वारा धातु से मुक्त होती है।
(बी) कपौरस ऑक्साइड [कॉपर (आई) ऑक्साइड] से तांत्रिक निष्कर्षण
कपौरस ऑक्साइड (कॉपर (II) ऑक्साइड) के लिए
ऑक्साइड फिर कोक का उपयोग करके आसानी से धात्विक कॉपर में कम हो जाता है:
वास्तविक प्रक्रिया में, उद्योतक भट्ठी में हेटिंग होता है जबकि विलीन के साथ मिश्रित करने के बाद क्षारीक पत्थर। भट्ठी में, आयरन आयरनी ‘लौहीय’ के रूप में निकलता है और कॉपर मेट के रूप में उत्पन्न होता है। इसमें
कॉपर मेट को सिलिका से लाइन बनाए गए कनवर्सर में चार्ज किया जाता है। कुछ सिलिका भी जोड़ी जाती है और शेष
FeS,
$$ \begin{align*} & 2 \mathrm{FeS}+3 \mathrm{O_2} \rightarrow 2 \mathrm{FeO}+2 \mathrm{SO_2} \tag{6.37}\ & \mathrm{FeO}+\mathrm{SiO_2} \rightarrow \mathrm{FeSiO_3} \tag{6.38}\ & 2 \mathrm{Cu_2} \mathrm{~S}+3 \mathrm{O_2} \rightarrow 2 \mathrm{Cu_2} \mathrm{O}+2 \mathrm{SO_2} \tag{6.39}\ & 2 \mathrm{Cu_2} \mathrm{O}+\mathrm{Cu_2} \mathrm{~S} \rightarrow 6 \mathrm{Cu}+\mathrm{SO_2} \tag{6.40}
\end{align*} $$
स्थिर किया गया तांबा जो प्राप्त होता है, उसमें SO2 के विकास के कारण धुंधलेपन का आभास होता है, इसलिए इसे ब्लिस्टर कॉपर कहा जाता है।
(क) जस्ता के अश्वेतन जस्ता के अश्वेतन को कोक का उपयोग करके किया जाता है। इस मामले में तापमान, कॉपर के मामले से अधिक होता है। गर्म करने के उद्देश्य से, ऑक्साइड को कोक और मृत्तिका के साथ ब्रिकेट में बनाया जाता है।
धातु तेजी से बनाए जाने के लिए उबलते माध्यम के द्वारा निकाली जाती है और इकट्ठा की जाती है।
इनटेक्स्ट
6.3 प्रतिक्रिया,
गिब्स ऊर्जा मान की दृष्टि से इसे स्थरीय रूप से होने योग्य होने का पाया जाता है। फिर भी, यह कमरे के तापमान पर क्यों नहीं होता है?
6.4 क्या यह सच है कि निश्चित स्थितियों में,
6.5 धातुरुहि विज्ञान में विद्युतोलै फलने के सिद्धांत
हमने देखा है कि थर्मोडायनेमिक्स के सिद्धांतों को पायरोमेटलर्जी में लागू किया जाता है। इसी तरह के सिद्धांतों का प्रभाव वियोँलों को हल्के करते हैं जो समाधान या मृत्ता स्थिति में मेटाल आयनों को घटाते हैं। यहाँ उनकी विधानेमिक्स को मूल से समझा जा सकता है,
यहाँ
सरल विधुतरुद्धरण में,
अल्युमिनियम
अल्युमिनियम के धातुरुहि में, शोधित
हालांकि हम चित्र 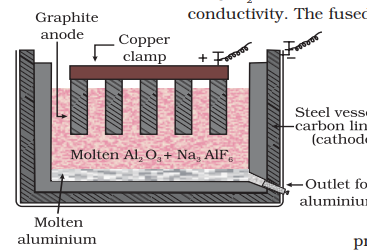 की बात करेंगे।
की बात करेंगे।
इस प्रक्रिया को मूल्यांकन प्रक्रिया के रूप में व्यापकतः जाना जाता है।
इस प्रक्रिया में पिघली हुई ढाल के विद्युतयांत्र में, कार्बन के इलेक्ट्रोड का उपयोग होता है। विलयित फ्री सन्निवेश की आवेशक से एनोड पर मुक्त होने वाला ऑक्सीजन कार्बन के साथ प्रतिक्रिया करता है
एनोड:
6.6 विधुतीयीकरण-अवपर्तन
छिड़ाईयों के लिए अवपर्तन के अतिरिक्त, कुछ निर्मेल से आधारित निकासी की महत्वपूर्ण उदाहरण हेतु उत्पन्न कोशिका से क्लोरीन की निष्कर्षण है (समुद्री जल में भारतीय मूल से भरपूर होता है)।
इस प्रतिक्रिया के लिए
पहले से अध्ययन करने के लिए, सोने और चांदी की निष्कर्षण को सम्पर्क विधि द्वारा अवशोषण करना होता है। यह भी एक विधुतीयीकरण अवस्था है
$$ \begin{gather*}
हालाँकि किसी भी विधि द्वारा निकाले गए धातु कार्या से आमतौर पर कुछ अशुद्धि से प्रदूषित होते हैं। ऊच्च शुद्धता के धातु प्राप्त करने के लिए, धातु और अशुद्धि के गुणवत्ता में अंतर के आधार पर कई तकनीकें उपयोग की जाती हैं। उनमें से कुछ का वर्णन नीचे दिया गया है।
(ए) अस्तान (बी) लिकेशन (सी) विद्युतीकरण (डी) क्षेत्र सूखाना (ई) ध्वांप चरण शोधन (एफ) खणिजीय विधियाँ
इनका विवरण यहाँ दिया गया है।
(ए) अस्तान
यह मिट्टी से कम उबलने वाले धातुओं जैसे जिंक और पारा के लिए बहुत उपयोगी है। अशुद्ध धातु को वाष्पीकरण के माध्यम से प्राप्त किया जाता है।
(ब) लिकेशन
इस विधि में, टिन जैसे कम गलन धातु को ढलती सतह पर बहा जा सकता है। इस तरीके से उसे उच्च गलनबिंदु वाली अशुद्धियों से अलग किया जाता है।
(सी) विद्युतीकरण
इस विधि में, अशुद्ध धातु को अर्धचालक के रूप में कार्य करने के लिए बनाया जाता है। एक प्राकृतिक रूप से शुद्ध धातु की तह अर्धचालक के रूप में उपयोग की जाती है। यह विधि पिछले अनुभागों में आपने देखी हैं, जहाँ प्राणोल्य क्षमता, गतिमान क्षमता और गिब्ब्स ऊर्जा के अवधारणा का उपयोग करके भी स्पष्ट किया गया हैं। प्रतिक्रियाएँ हैं:
अग्नि स्तंभ: M →
अर्धचालक:
तांबे को विद्युतीकरण के माध्यम से शुद्ध किया जाता है। अप्रशिष्ट को अशुद्धतान्त्र में से एकांग और तांबे की तहें प्राकृतिक रूप से उच्च गुणवत्ता वाले जैसे-इसमे संसंकर मेज़ तत्व, सेलेनियम, तेलुरियम, चांदी, सोना, और प्लैटिनम शामिल होते हैं; इन तत्वों की पुनर्प्राप्ति के माध्यम से शुद्धता की लागत हो सकती हैं। जिंक भी इसी तरीके से शुद्ध किया जा सकता हैं।
(d) ज़ोन रिफाइनिंग: यह विधि उस सिद्धांत पर आधारित है कि निम्न परिमाण के अशुद्धताएँ पदार्थ की ठंडी स्थिति से पेगे में ठंडे पदार्थ में सुलभता से विलय हो जाती हैं। एक गतिशील हीटर पदार्थ की रॉड के चारों ओर घुमावदार होता है और इसका एक सिरा उसके एक सिरे में निर्धारित किया जाता है (चित्र 6.7)। पिघला हुआ क्षेत्र हीटर के साथ चलता है जो आगे बढ़ाया जाता है। हीटर आगे बढ़ने पर, पागल चोखा में पवित्र पदार्थ जम जाता है और अशुद्धताएँ हीटर के चलने से उत्पन्न नए पिघले हुए क्षेत्र में चली जाती हैं। प्रक्रिया कई बार दोहराई जाती है और हीटर बार बार उसी दिशा में ही ले जाता है। अशुद्धताएँ एक ही ओर एकत्र हो जाती हैं। इस ओर से यह अंश काट दिया जाता है। यह तकनीक सेमीकंडक्टर और अन्य बहुत ऊँची शुद्धता वाले धातुओं के उत्पादन के लिए बहुत उपयोगी है, जैसे कि जर्मेनियम, सिलिकॉन, बोरॉन, गैलियम और इंडियम।
(e) पारिस्थितिकीय अवस्था रिफाइनिंग: इस विधि में, धातु को इसके वाष्पीय यौगिक में परिवर्तित किया जाता है जो पवित्र धातु को प्राप्त करने के लिए संग्रहीत और विघटित किया जाता है। इसलिए, दो आवश्यकताएँ होती हैं:
(i) धातु को उपलब्ध रीऐजेंट के साथ एक वाष्पीय यौगिक बनाना चाहिए,
(ii) वाष्पीय यौगिक को ढेर हो जाने के लिए आसानी से विभाजित किया जा सके, जिससे पुनर्प्राप्ति आसान हो।
निम्न उदाहरण इस तकनीक को स्पष्ट करेंगे।
निकेल के लिए मॉन्ड प्रक्रिया: इस प्रक्रिया में, निकेल को कार्बन मोनोक्साइड की धारा में गर्म किया जाता है, जिससे एक वाष्पीय समयान पर्याप्त निकेल टेट्राकार्बोनिल का नाम दिया जाता है। इस यौगिक को अधिक तापमान पर विभाजित किया जाता है, ताकि शुद्ध धातु प्राप्त की जा सके।
कार्बोनिल को अधिक तापमान पर विभाजित किया जाता है ताकि शुद्ध धातु जम जाए:
जर्कोनियम या टाइटेनियम के लिए वैन आर्केल प्रक्रिया: इस विधि का उपयोग खपरा में मौजूद ऑक्सीजन और नाइट्रोजन को प्रदूषण के रूप में हटाने के लिए नितम्बों आदि ऐसी धातुओं से करने के लिए बहुत उपयोगी है। खसरा धातु को एक खाली पेटल में आईयोडीन के साथ गर्म किया जाता है। धातु आयोडाइड के कारण यह इधर उड़ता है:
नाइटाइड धातु एक टंस्टन धातु तार पर विभाजित किया जाता है,
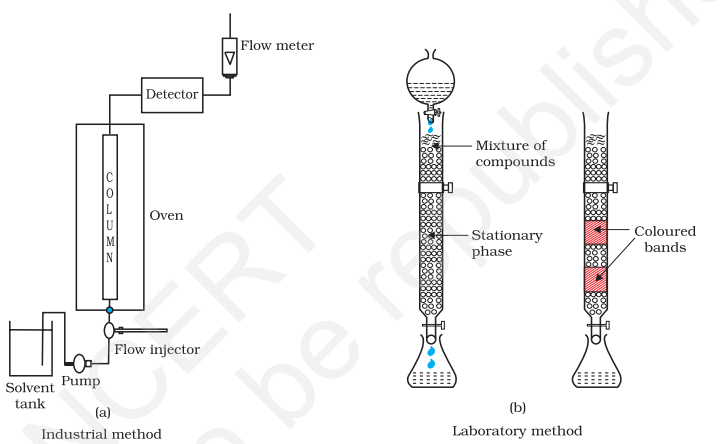
(f) क्रोमाटोग्राफिक विधियाँ: आपने कक्षा ग्यारह में एकत्रीकरण की पवित्रता के क्रोमाटोग्राफिक तकनीक के बारे में सीखा है (इकाई-12)।
कॉलम क्रोमेटोग्राफी उन तत्वों को शुद्ध करने के लिए बहुत उपयोगी होती है जो मामूली मात्राओं में उपलब्ध हैं और अशुद्धताएँ रासायनिक गुणों के हिसाब से बहुत अलग नहीं होती हैं।
6.8 अल्यूमिनियम, तांबे, जस्ता और लोहे का उपयोग
अल्यूमिनियम फॉइल खाद्य पदार्थों के लिए रैपर्स के रूप में उपयोग की जाती है। धातु की खारी को चित्रों और लैकर्स में उपयोग किया जाता है। उच्च प्रतिक्रियाशील अल्यूमिनियम को chromium और manganese के ऑक्साइड से अलग करने में भी उपयोग किया जाता है। इलेक्ट्रिसिटी कंडक्टर के रूप में अल्यूमिनियम के तार उपयोग किए जाते हैं। अभिमिश्रण युक्त अल्यूमिनियम बहुत ही उपयोगी होते हैं क्योंकि वे हल्के होते हैं।
तांबा विद्युत उद्योग में उपयोग होने वाले तार बनाने के लिए उपयोग किया जाता है और इसे जल और भापी पाइपों में भी उपयोग किया जाता है। यहां तक कि यह कई ऐसे अल्लॉय के रूप में भी उपयोग किया जाता है जो वास्तव में धातु से कठोर होते हैं। जैसे कि, पीतल (जस्ता के साथ), कांस्य (टिन के साथ) और सिक्का यौणिकीय अल्लाय (निकल के साथ)।
जस्ता लोहे को ताले में चढ़ाने के लिए उपयोग किया जाता है। इसका बहुत सारे मात्रा में बैटरी, बहुत सारे अल्लॉय (जैसे कि पीतल (Cu 60%, Zn 40%)) और गर्मन सिल्वर (Cu 25-30 %, Zn 25-30 %, Ni 40-50 %) के घटक के रूप में भी उपयोग किया जाता है। जस्ता धूल रंग के संशोधन, रंग, आदि के निर्माण में एक घटक तत्व के रूप में उपयोग किया जाता है।
कास्ट आयरन, जो कि लोहे का सबसे महत्वपूर्ण रूप है, स्टोव, रेलवे स्लीपर्स, गटर पाइप्स, खिलौने आदि के लिए चमकदार है। इसे व्रॉट लोहे और स्टील के निर्माण में भी उपयोग किया जाता है। व्रॉट लोहे का उपयोग बेड़ा, तार, बोल्ट, चेन और कृषि उपकरण बनाने में किया जाता है। स्टील कई उपयोगों का सामना करता है। जब इसे अन्य धातुओं को मिलाया जाता है तब अलॉय स्टील प्राप्त होता है। निकल स्टील को प्रायोजित करने के लिए केबल, ऑटोमोबाइल और विमान भाग, पेंडुलम, मापन टेप्स, और क्रोम स्टील को काटने वाले औजार और पिसाई मशीनों के लिए उपयोग किया जाता है, और स्टेनलेस स्टील को साइकिल, ऑटोमोबाइल, बर्तन, कलम, आदि के लिए उपयोग किया जाता है।
सारांश
हालांकि औद्योगिक क्रांति के बाद आधुनिक धातुरज्जूति में एक्सपोनेंशियल विकास हुआ है, धातुरज्जूति के अन्य आधुनिक सिद्धांतों की उत्पत्ति पूर्व औद्योगिक क्रांति से पहले की प्राचीन अभ्यासों में होती है। 7000 से अधिक वर्षों से, भारत में उच्च परंपरागत धातुविज्ञानियों ने महत्वपूर्ण योगदान किए हैं जो विश्व धातुरज्जूति इतिहास में अपनी जगह प्राप्त करते हैं। जस्ता और उच्च-कार्बन स्टील के मामले में, प्राचीन भारत ने आधुनिक धातुरज्जूति प्रगति के लिए मूल विकास में महत्वपूर्ण योगदान किया है जो औद्योगिक क्रांति के प्रेरक हुए धातुरज्जूति अध्ययन को प्रेरित किया।
धातुओं की कई उद्देश्यों के लिए आवश्यक होते हैं। इसके लिए, हमें उन्हें उन खनिजों से निष्कर्षण करने की आवश्यकता होती है जिनमें वे मौजूद होते हैं और जिनसे उनका वाणिज्यिक निष्कर्षण संभव होता है। इन खनिजों को खाद्यांकन कदमों में कुछ हटाना संभव होता है। उच्चीकृत खनिज को फिर रसायनिक रूप से भोजन करने के लिए उपचारित किया जाता है। आम तौर पर धातु यौगिकों (जैसे कि ऑक्साइड, सल्फाइड) को धातु में घटाया जाता है। घटाक एजेंट के रूप में कार्बन, CO या कुछ धातुओं का उपयोग किया जाता है।
इन कमीकल प्रक्रियाओं में, उष्मीयांत्रिकीय और विद्युतरासायनिक सिद्धांतों को उचित महत्व दिया जाता है। धातु ऑक्साइड कम कर ने वाले पदार्थ के साथ पदार्थ संक्षारक प्रतिक्रिया करता है; ऑक्साइड में धातु को कम किया जाता है और कम कर ने वाले पदार्थ को ऑक्सीकरण किया जाता है। इन दो प्रतिक्रियाओं में, नेट गिब्स ऊर्जा परिवर्तन नकारात्मक होता है, जो तापमान को बढ़ाने पर और भी नकारात्मक होता है। ठंडी से पार घनत्व के भौतिक अवस्थाओं के परिवर्तन और गैसी अवस्था के गठन ने पूरे प्रणाली के लिए गिब्स ऊर्जा में कमी को प्राथमिकता प्रदान की है। यह सिद्धांत ग्राफिक रूप में प्रदर्शित होता है जहां टी पर डीजी0 बनाम टी (एलिंगहम चित्र) की तुलना में ऐसी ऑक्सीकरण/घटाव प्रतिक्रियाओं की अलग-अलग तापमानों पर। इलेक्ट्रोडस धातुओं (जैसे, एल, एग, एयू) की अलगावश्यकता (जिसमें ये दो रेडक्स कपल समयोजन होते हैं) में उपयोगी होता है, जहां की ये कपल की गिब्स ऊर्जा परिवर्तन नकारात्मक होता है। आमतौर पर, साधारण तरीकों से प्राप्त धातुओं में छोटे प्रवाहक युक्त होते हैं। शुद्ध धातुओं को घिसाई से प्राप्त किया जाता है। घिसाई प्रक्रिया धातु और अशुद्धताओं की गुणों में अंतर पर आधारित होती है। एल्यूमिनियम का निष्कर्षण आमतौर पर उसके बॉक्साइट अयस्क के साथ सोडियम हाइड्रोक्साइड द्वारा लीचिंग के माध्यम से किया जाता है। इस प्रक्रिया में उत्पन्न सोडियम अल्यूमिनेट को अलग किया जाता है और उसके बाद संतृप्त करके जलीय ऑक्साइड को दिया जाता है, जो फिर तत्कालीनतम के रूप में प्रशस्त कर रहा है, जिसे तत्कालच से क्रायोलाइट के रूप में विद्युतरासायनिक प्रक्रिया के द्वारा विद्युतविभाजन किया जाता है। फेरलाइट में उसके ऑक्साइड अयस्क के कमीकल उत्पाद के द्वारा कम किया जाता है। तांबे का निष्कर्षण में त्वचा में घोलन और उसे एक वृत्ताकार भट्ठी में गर्म करने द्वारा होता है। जिंक अयस्कों से जिंक का निष्कर्षण कोक का प्रयोग करके किया जाता है। धातु की शुद्धि में कई तरीके का प्रयोग किया जाता है। धातुओं का आमतौर पर बहुत व्यापक उपयोग होता है और इसने विभिन्न उद्योगों के विकास में प्रमुखता से योगदान दिया है।
अभ्यास
6.1 कॉपर का हाइड्रोमेटलर्जी द्वारा निष्कर्षण किया जा सकता है, लेकिन जिंक नहीं। कारण बताएं।
6.2 फ्रॉथ फ्लोटेशन प्रक्रिया में डिप्रेसेंट की क्या भूमिका होती है?
6.3 पेराइट्स से कॉपर का निष्कर्षण इसके ऑक्साइड अयस्क के मुकाबले कठिन क्यों होता है?
6.4 समजाएं: (i) क्षेत्र शोधन (ii) स्तंभक्रम
6.5
6.6 इलेक्ट्रोलाइटिक कॉपर शोधन में यात्रागामी डिमेंशन में मौजूद साधारण तत्व नामित कीजिए। वे वहाँ इसलिए मौजूद होते हैं?
6.7 लोहे के निष्कर्षण के दौरान ब्लास्ट फर्नेस में विभिन्न क्षेत्रों में होने वाली प्रतिक्रियाओं को लिखें।
6.8 जिंक ब्लेंड से जिंक के निष्कर्षण में होने वाले रासायनिक प्रतिक्रियाओं को लिखें।
6.9 तांबे के मेटलर्जी में सिलिका की क्या भूमिका होती है?
6.10 “कोलमटोग्राफी” शब्द का क्या अर्थ है?
6.11 क्रोमेटोग्राफी में आधारी अवस्थान का चयन करने के लिए कौन सी मापदंड अनुसरण किया जाता है?
6.12 निकेल की शुद्धि के लिए एक विधि वर्णित करें।
6.13 आब्रकसाडैट के साथ जुड़े बॉक्साइट अयस्क में सिलिका को कैसे अलग किया जाए? अगर हो सके तो समीकाएँ दीजिए।
6.14 उदाहरण देकर ‘रोस्टिंग’ और ‘कैल्सीनेशन’ में अंतर बताएं।
6.15 ‘कास्ट आयरन’ ‘पिग आयरन’ से कैसे अलग होता है?
6.16 अवस्था: 6.16 “रत्न” और “गणधार” के बीच अंतरण करें।
6.17 अवस्था: 6.17 कॉपर मैट को सिलिका लाइन युक्त कन्वर्टर में क्यों रखा जाता है?
6.18 अवस्था: 6.18 एल्युमिनियम के धातुशास्त्र में क्रायोलाइट का क्या रोल है?
6.19 अवस्था: 6.19 कम गुणवत्ता वाले कॉपर खनिजों के मामले में लीचिंग कैसे की जाती है?
6.20 अवस्था: 6.20 क्यों
6.21 अवस्था: 6.21
6.22 अवस्था: 6.22
6.23 अवस्था: 6.23 आवंटित स्थिति में घटावादी एक विशेष मामले में एक कम्पीयां आधार पर रोचक निर्णय पर निर्भर करती है। आप इस कथन के साथ कितनां सहमत हैं? दो उदाहरणों के साथ अपनी राय का समर्थन करें।
6.24 अवस्था: 6.24 नाम उन प्रक्रियाओं का बताएं जिनसे विस्फोट के दौरान क्लोरीन प्राप्त होता है। यदि जलीय
6.25 अवस्था: 6.25 एल्युमिनियम की विद्युतधातुशास्त्र में ग्रेफाइट रॉड का क्या काम होता है?
6.26 अवस्था: 6.26 निम्नलिखित विधियों द्वारा धातुओं के शोधरता के सिद्धांतों का संक्षेप:
(i) क्षेत्र पवित्रण
(ii) वैद्युत पवित्रण
(iii) वाष्प चरण शोधन
6.27 अवस्था: 6.27 सूचीबद्ध प्रश्न 6.4 देखें: Al द्वारा MgO के घटाव की संभावना के अवसरों की पूर्वानुमान बताएँ। (संकेत: See Intext question 6.4)






