शीर्षक: इकाई 5 सतह रसायनशास्त्र
सतह रसायनिकी सतहों या अन्तर्मुखों पर होने वाले घटनाओं के साथ संबंधित होती है। सतह या तल बल्क चर माध्यमों को एक हाइफन या स्लैश द्वारा विभाजित करके प्रतिष्ठित किया जाता है। उदाहरण के लिए, एक ठोस और एक गैस के बीच की सतह को ठोस-गैस या ठोस/गैस से प्रतिष्ठित किया जा सकता है। पूर्ण मिश्रणता के कारण, गैसेज़ के बीच कोई सतह नहीं होती है। सतह रसायनिकी में हमें आमतौर पर शुद्ध या यह संकेत करने वाले तत्वों की अनुमुख संपर्क विभिन्न पदार्थों की कुछ मोलेक्यूलों की मोटाई होती है, लेकिन इसका क्षेत्र बल्क चर के कणों के आकार पर निर्भर करता है। कई महत्वपूर्ण घटनाएं, जिनमें सबसे प्रमुख तत्त्वों में जंग होती है, पट्टीकरण, इलेक्ट्रोड प्रक्रियाएँ, असमान पट्टीकरण, पिघलाव और उद्गारण, सतहों पर होती हैं। सतह रसायनिकी के विषय में उद्योग, विश्लेषणात्मक कार्य और दैनिक जीवन की स्थितियों में कई अनुप्रयोग मिलते हैं।
सतह अध्ययन को संपूर्णता से करने के लिए, एक वास्तव में साफ सतह होना आवश्यक होता है।
इस इकाई में, आप सतह रसायनिकी की कुछ महत्वपूर्ण विशेषताओं जैसे संघटन, कैटलिसिस और कोलॉइड, इमलशन और जेल का अध्ययन करेंगे।
5.1 संघटन
एक ठोस की सतह का एक खास विशेषता है कि वह उस चर के मोलेक्यूलों को आकर्षित और रखने की प्रवृत्ति रखती है, जिसके साथ यह संपर्क में आती है। ये मोलेक्यूल सतह पर ही रहते हैं और बल्क में गहराई में नहीं जाते। एक ठोस या तरल पदार्थ की सतह पर अणु विजाति जितना उच्चालन होता है, वह अवशोषण कहलाता है। अवशोषित कर्मी अथवा पदार्थ, जो सतह पर संचयित या उमड़ता है, उसे अवशोषक कहते हैं और जिस सतह पर अवशोषण होता है, उसे अवशोषक कहते हैं।
अवशोषण मूल रूप से एक सतह घटना है। ठोस, विशेष रूप से अणुवीय रूप में, बड़े सतह क्षेत्र रखते हैं और इसलिए, चारकोल, सिलिका जेल, अल्यूमिना जेल, मिट्टी, कोलाइड, अल्पतिर (फाइनली डिवाइडेड) धातु आदि अच्छे अवशोषक के रूप में कार्य करते हैं।
प्रयोग में अवशोषण
(i) यदि एक गैस जैसे
(ii) एक अर्द्ध शोथांक सोल्यूशन में, केवललाइन उदाहरण के लिए मेथिलीन नीले के समाधान में, जब जानवरी कारक कोयले का उपयोग करके जोर से हिलाया जाता है, तो ध्यान देने जाता है कि फ़िल्टरेट रंगहीन हो जाता है। यानी, रंगरहित हो जाता है। नीले के मोलेक्यूल अर्द्धशोथांक के सतह पर बाएं जाते हैं, अर्थात अवशोषित हो जाते हैं।
(iii) जब पशु चारकोल के बिस्तरों पर चक्रवाती कीचड़ द्वारा जलैकी निर्मित विषैली विलिेपजा जाती है, तो वह रंगभाजन पदार्थ चारकोल द्वारा सिादक़्रत होने से विकिरणशून्य हो जाती है।
(iv) सिलिका जेल की उपस्थिति में हवा शुष्क हो जाती है क्योंकि पानी के कणों को जेल की सतह पर अादगदित किया जाता है।
उपरोक्त उदाहरणों से स्पष्ट होता है कि ठोस सतह संघटन द्वारा गैस या तरल कणों को धारित कर सकती है। जिस सतह पर धारण किया जाता है, उसी पर यह मेंढ़ता है। जिस सतह पर एक धारित पदार्थ धारित किया जाता है, उसको सतही कहा जाता है, और इस पर धारण किए गए सतहय को नष्ट करने का प्रक्रम डीतसोर्प़्शन कहा जाता है।
5.1.1 धारित और भिजीयन की अंतर
धारण में, पदार्थ केवल सतह पर ही संकुचित होता है और सतह से उभर के अादरे तक नहीं प्रवेश करता है, जबकि भिजीयन में पदार्थ ठोस की मशाल के पूरे आंतरिक हिस्ê पर संगठितरूप से छितर्ता होता है। उदाहरण के रूप में, जब इंक में डुबाई चाक को चुदवाया जाता है, तो सतह इंक के रंग को पकड़ती है, स्वरणक़्ककरपोषीकरण के कारण, जबकि विलिेप के शुषात्रु दीिल में गहराई में चला जाता है। चाक को तोड़ने पर, यह अािई जाता है कि सारा माध्य भीतर से सफेद है। जल बाष्प एक धारित (केमिकल-युग्म - calcium chloride द्वारा धारित करता है पर जिल सारा जेल द्वारा अादगदित किया जाता है। अन्य शब्दों में, धारि’ में धारणकबृधि केवल धारणकर्ता के सतह पर होती है, जबकि भिजीयन में धारण सतही यूनिफाम धावी में छितर्ता होता है।
धारण और भिजीयन दोनों साथ ही हो सकते हैं। दोनों प्रक्रियाओं को वर्णन करने के लिए शब्द “शोरशन” का उपयोग किया जाता है।
5.1.2 धारण की यांत्रिकी
धारण इस कारण होती है क्योंकि धारणकर्ता के सतह के कण पृपथ में स्थित कणों की तुलना में एक ही वातावरण में नहीं होते हैं। धारणकर्ता में सभी कणों के बीच कार्यरत छष तोें विपरीत जबकि सतह पर कण अपने प्रकार के प्रचार या अणुओं या अरबों द्वारा घिरित नहीं होते हैं, और इसलिए उनके पास अविलंबित या गुणभूतआकर्षक-छष होते हैं। इन धारणकर्ता की छष धारित पदार्थ को अपने पृपथ पर आकर्षित करने के ज़िम्मेदार हैं। धारण की रत मात्रा एक दिए गए तापमान और दवाब पर इकाइ भार में धारणकर्ता का सतह क्षेत्र की वृद्धि के साथ वृद्धि करती है।
एक और महत्वपूर्ण कारक जो विज्ञास्संचरण में शामिल होने वाला है, वह हैट ऑफ़ ऐडसोर्प्शन। ऐडसोर्प्शन के दौरान, सतह की अवशेष बलों में हमेशा एक कमी होती है, अर्थात सतह की ऊर्जा में एक कमी होती है जो गर्मी के रूप में प्रकट होती है। ऐडसोर्प्शन इसलिए एक एक्सोथर्मिक प्रक्रिया होती है। दूसरे शब्दों में, ऐडसोर्प्शन का दिल्लीटा एच हमेशा नकारात्मक होता है। जब एक गैस ऐडसोर्ब होता है, तो उसके अणुओं की गतिशीलता की स्वतंत्रता में कटौती होती है। इसका मतलब है कि ऐडसोर्प्शन के बाद, गैस की इंस्ट्रॉपी में कटौती होती है, अर्थात ΔS नकारात्मक होता है। ऐडसोर्प्शन संक्रमित के रूप में जोड़ने के बाद, प्रणाली की उष्णता में और साथ ही प्रणाली की इंथैल्पी में कटौती होती है। किसी प्रक्रिया को स्वतंत्र होने के लिए , उष्णताएंग्रंथिय आवश्यकता होती है कि , निरंतर तापमान और दबाव में Δगमानक नकारात्मक हो , अर्थात गिब्स ऊर्जा में कमी हो। हमके मूल्यांकन , ΔG=Δएच-तग Δएस आधार पर है , Δगाया प्रतिष्ठ्तिप्रयास हो सकता है यदि गेमानक नकारात्मक मान जैसे कि -टीगदइसनसकर्य हो थो। इसप्रकार, एक ऐडसोर्प्शन प्रक्रिया में, जो स्वतंत्र होती है, इन दो कारकों का संयोजन Δगाया मान नकारात्मक बनाता है। जब ऐडसोर्प्शन बढ़ता है, Δएच होता है और कमी होने लगता है अंततः Δएच बराबर करने लगता है स्वतंत्रता को धारण किया जाता है।
5.1.3 ऐडसोर्प्शन के प्रकार
थोस पर गैस के ऐडसोर्प्शन के मुख्य दो प्रकार हैं। यदि एक ठोस पर गैस का संचयन कमजोर वान देर वाल्स की शक्तियों के कारण होता है, तो ऐडसोर्प्शन को भौतिक ऐडसोर्प्शन या फिजेंसोर्प्शन कहा जाता है। जब गैस के अणु या परमाणु सामरिक बंधों द्वारा ठोस पर बाँधे जाते हैं, तो ऐडसोर्प्शन को केमिकल ऐडसोर्प्शन या केमिसोर्प्शन कहा जाता है। केमिकल बोंड संबंध या आयनिकता की हो सकती है। केमिसोर्प्शन ऊष्णता की एक प्रबलता शामिल होती है और इसलिए इसे अक्टिवेटेड ऐडसोर्प्शन के नाम से भी जाना जाता है। कभी-कभी ये दो प्रक्रियाएं समवर्ती होती हैं और इसका प्रकार निश्चित करना आसान नहीं होता है। निम्न तापमान पर भौतिक ऐडसोर्प्शन किसी केमिसोर्प्शन में परिवर्तित हो सकता है। उदाहरण के लिए, डाइहाइड्रोजन पहले वान देर वाल्स की शक्तियों के कारण निकेल पर ऐडसोर्ब होता है। हाइड्रोजन के अणु फिर भिन्न होते हैं जो केमिसोर्प्शन द्वारा पटे हुए होते हैं।
दोनों प्रकार के ऐडसोर्प्शन की कुछ महत्वपूर्ण विशेषताएं नीचे वर्णित की गई हैं:
फिजेंसोर्प्शन की विशेषताएं
(i) विशेषता की कमी: एक दिए गए ऐडसोर्बिंदु की सतह कोई विशेष गैस के लिए पसंद नहीं करती है क्योंकि वान देर वाल्स की शक्तियां सार्वत्रिक होती हैं।
(ii) पदार्थ के प्रकार: एक ठोस द्वारा विज्ञात गैस की संख्या पदार्थ के प्रकार पर निर्भर करती है। सामान्यतया, आसानी से स्रावित या लिकीयकरण योग्य गैसें (अर्थात अधिक आवश्यक तापमान के साथ) अपरिवर्तनीय वाल्स की बलाएं प्राकृतिक तापमानों के पास मजबूत होती हैं। इस प्रकार,
(iii) प्रतिवर्ती स्वभाव: एक ठोस द्वारा गैस का भौगोलिक विज्ञान सामान्यतया प्रतिवर्तनीय होता है। इस प्रकार,
गैस की अधिक मात्रा विज्ञातलों द्वारा जलाई जाती है जबकि दबाव बढ़ाने पर गैस का आयाम कम होता है (ले-चैटेलीयर्स का सिद्धांत) और गैस को दबाव कम करके हटा सकते हैं। क्योंकि जलाने की प्रक्रिया ऊष्मा बचाने वाली होती है, भौतिक जलन किसी भी तापमान पर आसानी से होती है और ऊष्मा में बढ़ती तापमान के साथ कम होती है (ले-चैटेलीयर्स का सिद्धांत)।
(iv) विज्ञप्ति की सतह: विज्ञाता की सतह की विस्तार से विज्ञाप्ति की मात्रा बढ़ती है। इस प्रकार, विभक्त धातुओं और बड़ी सतह वाले सामग्रियाँ अच्छे विज्ञाप्ति के होते हैं।
(v) जलन की उष्णता: बेशक, भौतिक विज्ञाधन एक ऊष्णीक्रिय प्रक्रिया होती है लेकिन इसकी जलन की उष्णता काफी कम होती है (20–40 के विजे मोल-1)। इसका कारण गैस अणुओं और ठोस पृष्ठ के बीच की क्षीण वाल वान दे हावाओं के कारण है।
रसायनिक-विज्ञाप्ति की विशेषताएँ
(i) उच्च विशेषता: रसायन विज्ञयन अत्यंत विशेषतापूर्ण होता है और वह केवल तभी हो तब यदि विज्ञाप्त कर्ता और विज्ञाप्तक के बीच रासायनिक बंधन की कुछ संभावना हो। उदाहरण के लिए, धातुओं पर अधिष्ठान उच्च समर्पण के कारण ऑक्साइड गठन के द्वारा ऑक्सीजन विज्ञाप्त होता है और अणुतत्वी धातुओं पर अणु गठन के कारण हाइड्राइड विज्ञाप्त होता है।
(ii) अप्रतिवर्तनीयता: क्योंकि रसायनिक विज्ञाप्त में संयोजन गठन शामिल होता है, इसलिए यह सामान्यतया अप्रतिवर्तनीय होता है। रसायनिक विज्ञाप्त भी एक ऊष्मीक्रिय प्रक्रिया होती है लेकिन उच्च तापमान पर ऊष्मा की उच्च शक्ति के कारण प्रक्रिया बहुत धीमी होती है। जैसा कि अधिकांश रासायनिक प्रक्रियाओं में होता है, विज्ञाप्तन कई संकर्षण के साथ बढ़ता है। बेशक तापमान में जलाने वाली एक न्यून तापमान पर विज्ञाप्त गैस की भौगोलिक विज्ञप्ति रासायनिक-विज्ञाप्त रूप में बदल सकती है। आमतौर पर उच्च दबाव भी रसायनिक-विज्ञाप्त के लिए अनुकूल होता है।
(iii) सतह क्षेत्र: भौतिक विज्ञाप्त की तरह, रसायनिक-विज्ञाप्त भी विज्ञाप्तक की सतह क्षेत्र बढ़ाने से बढ़ता है।
(iv) जलन की उष्णता: जलन की उष्णता रसायनिक-विज्ञयन में उच्च होती है (80-240 के विज्ये मोल-1) क्योंकि इसमें रासायनिक बंधन के कारण होती है।
5.1.4 विज्ञाप्ति आईसोथर्म
स्थिर तापमान पर दबाव के साथ विज्ञातक द्वारा विज्ञप्तिष्ठ मात्रा में बदलाव विज्ञाप्ति आईसोथेरम के द्वारा व्यक्त किया जा सकता है।
फ्रेंडलिच संबद्धन तापीय क्रमवारी: 1909 में, फ्रेंडलिच ने एक आंशिक शक्तिवीय सम्बन्ध प्रदान किया सतत ठंडे समय में ठंडा जैव श्लेषक द्वारा ठंडे ठंडा वाष्प अवभाषण के संमुख इकाई केषाधार विपण्ड की मात्रा और दबाव के बीच एक अनुभागीय सम्बन्ध। यह संबन्ध निम्नलिखित समीकरण द्वारा व्यक्त किया जा सकता है:
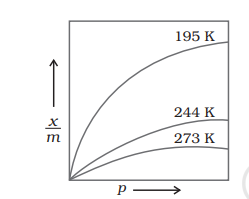
यहां x दबाव P पर विज्ञापित विपण्ड के मात्रा जिसे मात्रा m में विज्ञापित विपण्ड की भार है, k और n ऐसे स्थिरांक हैं जो विज्ञापितग्रही और मात्रा के प्रकृति पर निर्भर करते हैं और ठंडे ठंडे विपण्ड पर। संबंधान आमतौर पर एक वक्र के रूप में प्रस्तुत किया जाता है जहां गैस की मात्रा विपण्ड के एक ग्राम प्रति विपण्ड के प्रेशर के साथ आकर्षित होती है (चित्र 5.1)। ये कर्वों निर्दिष्ट दबाव पर पट्टियों के साथ अभौतिक आकर्षण में कमी में वृद्धि के साथ आक्लनी दिखाते हैं। इन संकेतों से यह स्पष्ट होता है कि एक निर्दिष्ट दबाव पर तापीय विज्ञापन में लघु कम होती है। ये कर्वेज उच्च दबाव पर संपूर्णता को अनुमानित होते हैं। समीकरण (5.1) का लघुलेख लेते हैं
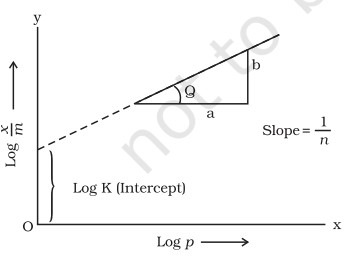
फ्रेंडलिच तापीय क्रमवारी का प्रमाणीकरण
फ्रेंडलिच तापीय क्रमवारी लगभग एक अनुमानित तरीके से विज्ञापन के व्यवहार की समझ करती है।
जब
जब
दोनों शर्तें प्रमाणित प्रायोगिक परिणामों द्वारा समर्थित हैं। प्रायोगिक तापीय क्रमवारी हमेशा उच्च दबाव पर संतृप्ति दिखाती है। यह फ्रेंडलिच तापीय क्रमवारी द्वारा समझाया नहीं जा सकता है। इसलिए, यह उच्च दबाव पर असफल हो जाता है।
5.1.5 सॉल्यूशन चरण से विज्ञापन
(iii) अवज्ञापनण का व्यापकता पर शुष्काधार में गुलाबी का आपसारण पर निर्भर करता है।
(iv) अवज्ञापनण की व्यापकता आपसारक और निषेधरक की प्रकृति पर निर्भर करती है।
शुष्काधार से विलय का सटीक मेक्षिम नहीं ज्ञात है। फ्रुंदलिच का समीकरण प्राय वैहवेक विलय के व्यवहार का वर्णन करता है एक अंतर परिस्थिति की वीर्यत्मक प्रव्रुति के बजाय, यानि,
लॉगार्थम का उपोग्रहण करते हुए उपरोक्त समीकरण का मूल्यांकन हमें मिलता है।
मॉन्योर और $ऊँचाऍत _- -ेतान्वस _-ह_पत_सग्य _-ज्यसग्यी यथावत् सीधी रेखा मिलती है जो फ़्र्यून्डलिच मूल्यांकन के योग्यता को दर्शाती है। इसे अवज्ञापन विधि की वैज्ञानिकता की जांच द्वारा परीक्षण किया जा सकता है।
5.1.6 अवज्ञापनण के अनुप्रयोग
अवज्ञापनण का प्रसंग और अनेक प्रयोग होते हैं। महत्वपूर्ण मामले यहाँ सूचीबद्ध हैं:
(i) उच्च शूषा का उत्पादन: शायदि के द्वारा शेष तनाव को एकाधिक ऊँचा नीलामी यांत्रिक द्वारा खाली के दबाया हुआ एक बेहद ऊँचा शूषा मिल सकता है।
(ii) वायु मास्क: वायु-रक्षा मास्क (एक उज्रो जो जिनका एकाधिकार विषील दुष्ट वायु से लब्ध प्रकीरन करता है) आमतौर पर कोल माइनों में सांस लेने के लिए उपयोग होता है।
(iii) आपत्ति के नियंत्रण: शलमी और एल्युमीनियम जैल्स आपत्तियों को हटाने और आपत्ति को नियंत्रित करने के लिए आपसारक के रूप में उपयोग होते हैं।
(iv) समाधानसे रंगीस हानिकारक पदार्थ का निष्कासन: पशु हैंडी orगुलाबी रंग को निवलय करके रंगन निवर्तन करता है।
(v) विषमिजनक क्रिया: कैटलेस्ट के ठोस सतह पर अभिक्रियाण्यो की आपसारण रेट को वृद्धि करता है। यहाँ, ईन्द्रीय महत्व की गैसी उभये कृयाऐं से विषाणिय ठोस सतहों की ऊँचाइथ् महत्वपूर्ण क्रियाओं में शामिल होते हैं। फेरी से नाम बढाकर पेय में छीनने का निर्माण, संपर्क प्रक्रिति के द्वारा
(vi) अधरोरविषाणिय गैसो का अलगाव: चारकोल पर गैसों के आपसारण के दर में अंतर के कारण, केन्द्र हुआ चारकोल पर अधरोरनज्ञाइ गैसों का संयमय हो सकता है।
(vii) बिमारीयों का संकटा चिकित्सा में: अनेक दवाओं को बिमारियों का विनाश करने के लिए नियंत्रण किया जाता है।
(viii) फ्राेथ फ्लटेसियन प्रक्रिया: यह विधि का प्रयोग करके सौम्य गुहां खनिज उपचये से सिलिका और अन्य धर्म वाले पदार्थ अलगाये जाते हैं पाइन आयल और फ्रस्टन एजेंट का प्रयोग करके (वाणिज्यिक महत्व की वाया देखें)।
(ix) अवशोषण संकेतक: चांदी के हैलाइड्स जैसे कि सिल्वर हैलाइड पूर्विकज्ञारण, फ्लोरोसीन, इत्यादि जैसे कुछ रंगों को अवशोषित करने की गुणवत्ता होती है और इस प्रकार से अंतिम बिंदु पर एक चरित्रिक रंग उत्पन्न करती है।
(x) वातावरणीय विश्लेषण: अवशोषण के अवधारणा पर आधारित वातावरणीय विश्लेषण संख्या के अनुप्रयोगों में पाए जाते हैं।
इनटेक्स्ट प्रश्नोत्तर
5.1 रासायनिक अवशोषण की किसी भी दो विशेषताओं को लिखें।
5.2 बाहरी विषमता के साथ फाइज़िकोशोषण तापमान के बढ़ने से क्यों कम हो जाता है?
5.3 ताजेदार पदार्थ अपनी क्रिस्टलीय रूपों के मुक़ाबले अधिक प्रभावी अवशोषक होते हैं, यह क्यों है?
5.2 कैटलिसिस
पोटैशियम क्लोरेट, जब मजबूती से गर्म किया जाता है, धीरे-धीरे विघटित होता है और बायोजन देता है। विघटन
हालांकि, जब थोड़ा-सा मैंगनीज़ डाइऑक्साइड जोड़ा जाता है, तो विघटन का महत्वपूर्ण भूमिका बहुत कम तापमान विवार में, अर्थात 473-633K में होता है और इसके साथ ही तेजी से होता है। थोड़ा मैंगनीज़ डाइऑक्साइड बरकरार रहता है और यह भी समान मात्रा और संयोजन के प्रति। इसी तरह, एक बहुत सारे रासायनिक प्रतिक्रियाओं की दरों को एक एकल विदेशी पदार्थ की मौजूदगी से बदला जा सकता है।
विभिन्न विदेशी पदार्थों के प्रति रासायनिक प्रतिक्रियाओं की दरों का प्रभाव सिस्टमातिक अध्ययन पहली बार 1835 में बेरजिलियस द्वारा किया गया था। उन्होंने ऐसे पदार्थों के लिए कैटलिस्ट शब्द की सुझाव दी।
रासायनिक प्रतिक्रियाओं की दर को त्वरित करने वाले वस्तुओं को कैटलिस्ट कहा जाता है और ऐसी प्रक्रिया को कैटलिसिस कहा जाता है। आपने पहले ही अध्याय 4.5 में पदार्थ के बारे में और उसके कार्य की अध्ययन किया है।
प्रोमोटर्स और पॉयजन्स
प्रोमोटर वे पदार्थ होते हैं जो कैटलिस्ट की गतिविधि को बढ़ाते हैं जबकि पॉयजन्स कैटलिस्ट की गतिविधि को कम करते हैं। उदाहरण के लिए, अमोनिया के उत्पादन के लिए हैबर की प्रक्रिया में, मोलिब्डेनम फेर के लिए प्रोमोटर के रूप में कार्य करता है।
5.2.1 समलविषय और अपरलविषय कैटलिसिस
कैटलिसिस को दो समूहों में विभाजित किया जा सकता है:
(a) समलविषय कैटलिसिस
जब प्रतिक्रियाकारी, उत्पाद और कैटलिस्ट एक ही अवस्था (यानी, द्रव्यमान या गैस) में हों, तो प्रक्रिया को समलविषय कैटलिसिस कहा जाता है। निम्नलिखित एक समलविषय कैटलिसिस के कुछ उदाहरण हैं:
(i) नाइट्रिक ऑक्साइड के ऑक्साइड के रूप में सल्फर डाइऑक्साइड को सल्फर त्राइऑक्साइड में जलाने का उदाहरण है, पीबेंग चैम्बर प्रक्रिया में नाइट्रिक ऑक्साइड के साथ।
प्रतिक्रियाकारी, सल्फर डाइऑक्साइड और ऑक्सीजन, और कैटलिस्ट, नाइट्रिक ऑक्साइड, सभी एक ही अवस्था में हैं।
(ii) मिथाइल ऐसिटेट की हाइड्रोलिसिस हाइड्रोक्लोरिक एसिड द्वारा प्रभावित होती है
$$
विषय: \mathrm{CH_3} \mathrm{COOCH_3}(\mathrm{l})+\mathrm{H_2} \mathrm{O}(\mathrm{l}) \xrightarrow{\mathrm{HCI}(\mathrm{l})} \mathrm{CH_3} \mathrm{COOH}(\mathrm{aq})+\mathrm{CH_3} \mathrm{OH}(\mathrm{aq}) $$
प्रतिक्रियाओं और कैटलिस्ट एक ही चरण में हैं।
(iii) शराब के Hydrolysis में H+ आण्विक द्वारा हाइड्रोलिसिस किया जाता है।
प्रतिक्रियाओं और कैटलिस्ट एक ही चरण में हैं।
(b)सरलतश्री उर्वरक
प्रतिक्रिया और कैटलिस्ट जो विभिन्न चरण में होती है, उसे सरलतश्री उर्वरक (heterogeneous catalysis) कहा जाता है। सरलतश्री उर्वरक के कुछ उदाहरण नीचे दिए गए हैं:
(i) प्लेटिनम की उपस्थिति में जलदी से अल्कटीकर्बन से अल्क्टोन के सल्फर सल्फाइड में ऑक्सीकर्बन की ऑक्सीकरण।
प्रतिक्रिया गैसीय स्थिति में होती है जबकि कैटलिस्ट ठोस स्थिति में होती है।
(ii) हेबर की प्रक्रिया में बाईयोरेक्ट के बीच डाईनाइट्रोजन और डाईड्रोजन मिश्रित धातु के रूप में नित्राम के सिरे में रूपांतरण।
प्रतिक्रिया गैसीय स्थिति में होती है जबकि कैटलिस्ट ठोस स्थिति में होती है।
(iii) ओस्टवाल्ड की प्रक्रिया में प्लेटिनम गौज में अमोनिया से नाइट्रिक ऑक्साइड में नाइट्रोजन की ऑक्सीकरण।
प्रतिक्रिया गैसीय स्थिति में होती है जबकि कैटलिस्ट ठोस स्थिति में होती है।
(iv) बाजार स्थिति के कम जीवाणु समुच्चय के निवेश के लिए बाजार स्थिति के शरीरन्ध में ताजे इंडिन के वसोंस्पति तेल के आपसीकरण।
इन में से अपेक्षित इंजन तत्व स्थिर स्थिति में होते हैं जबकि कैटलिस्ट ठोस स्थिति में होते हैं।
5.2.2 सरलतश्री उर्वरक का विज्ञापन तत्व प्रक्रिया
यह सिद्धांत heterogeneous catalysis की विधि को समझाता है। पुरानी सिद्धांत, जिसे कैटलिसिस के विज्ञापन तत्व की कहा जाता है, यह है कि उध्वस्तिन वायु या विढ़िया में उपस्थित प्रतिक्रियाओं को ठोस कैटलिस्ट के सतह पर सोचा जाता है। प्रतिक्रियाओं के घाटे में बढ़ोत्तरी तथा प्रतिक्रिया की दर को ऊर्जा के प्रयोग से उन्नत किया जाता है।
कैटलिस्ट क्रियान्वयन में मध्य समाधान निर्माण की दृष्टि से व्याख्या की जा सकती है, जिसका सिद्धांत आपने पहले से ही अध्ययन किया है विभाग 4.5.1 में।
समकालीन आवश्यकताओं के संयोजन का सिद्धांत और पुराने आवश्यकता के सिद्धांत का एकीकरण ही समकालीन क्षिप्रक्रिया सिद्धांत है। कैटलिस्ट की सत्र होने के लिए क्षेत्रीय है। यह तंत्र पांच कदमों में संलग्न होता है:
(i) प्रतिक्रियाएं कैटलिस्ट की सत्र के सततकबुद्धित घूसना।
(ii) प्रतिक्रियाएं कैटलिस्ट की सत्र की सततकबुद्धित पदार्थों के सत्र होना।
(iii) कैटलिस्ट की सत्र के साधन के माध्यम से रासायनिक प्रतिक्रिया का होना (चित्र 5.3 के माध्यम से)।
(iv) प्रतिक्रिया उत्पादों की सत्र, और इस प्रकार, कैटलिस्ट की सत्र के लिए फिर से उपलब्ध कराना।
(v) प्रतिक्रिया उत्पादों की सत्र कैटलिस्ट की सत्र से दूर जाना। कैटलिस्ट की सत्र की सत्र आँतरिक हिस्से के विपरीत, मुक्त पूरा हिस्सा, यहां रासायनिक आकर्षण के कारण सीट प्रदान करते हैं। जब एक गैस इस प्रकार की सत्र के संपर्क में आता है, तो इसके अणु धीमे रासायनिक कम्बिनेशन के कारण वहां रोका जाता है। यदि साथ-साथ भिन्न अणुएं सत्रित होती हैं, तो वे एक दूसरे के साथ युद्ध कर सकती हैं, जिससे नई अणुओं के गठन का निर्माण होता है। इस प्रकार, गठित अणु वाष्पीभूत हो सकते हैं, नये प्रतिक्रियाकारी पदार्थों के लिए सत्र छोड़ते हैं।
यह सिद्धांत प्रतिक्रिया के अंत में कैटलिस्ट को मास और रासायनिक संरचना में बदलाव नहीं करता है, और साथ ही, यह छोटे मात्राओं में भी प्रभावी होता है। हालांकि, यह कैटलिस्ट प्रोमोटर्स और कैटलिस्ट जहरों के कार्य की क्रिया की व्याख्या नहीं करता है
ठोस कैटलिस्टों की महत्वपूर्ण विशेषताएं
(a) क्रियाशीलता: कैटलिस्ट की क्रियाशीलता बहुतायता मात्राओं की ताकत पर निर्भर करती है। प्रतिक्रियाकर्ता उत्पन्न किए जाने के लिए प्रतिक्रियाकारी के रूप में कैटलिस्ट पर सतह पर आदी गिरना चाहिए। हालांकि, यह धीमे रासायनिक कम्बिनेशन के कारण इतनी मजबूती से सत्रित न हो जाते हैं, कि वे बेहशा एकत्र हो जाएँ और अन्य प्रतिक्रियाकारी को प्रतिक्रियाकरी की सतह के लिए कोई स्थान न छोड़ जाए। पाया गया है कि हाइड्रोजनेशन प्रतिक्रिया के लिए, समूह 5 से समूह 11 धातुओं की क्रियाशीलता बढ़ती है और आवांछनिक तालिका के समूह 7-9 उत्पादों द्वारा दिखाया जाता है (वर्ग XI, यूनिट 3)।
(b) चयननीति: एक कैटलिस्ट की चयननीति ऐसा यह क्षमता होता है, जो विशेष उत्पाद के लिए एक प्रतिक्रिया को मार्गनirdलता करने की क्षमता होती है, जब एक ही प्रतिक्रिया स्थितियों के तहत कई उत्पाद संभव होते हैं। समान प्रतिक्रियाओं के लिए विभिन्न कैटलिस्टों के लिए चयननीति अलग होती है। उदाहरण के लिए,
(i)
(ii)
(iii)
इस प्रकार, यह साबित हो सकता है कि कैटलिस्ट का कार्य अत्यंत चयनात्मक होता है। इस परिणामस्वरूप, एक ऐसी पदार्थ का यदि एक प्रतिक्रिया में कैटलिस्ट के रूप में काम करता है, तो वह दूसरी प्रतिक्रिया में कैटलिस्ट के रूप में काम नहीं कर सकता।
5.2.3 जियोलाइट्स द्वारा आकार-चुनकारी कैटलिसिस
पोर का संरचनात्मक तथा जैविक पदार्थ और उत्पादक पदार्थों के आकार पर आधारित कैटलिसिस को आकार-चुनकारी कैटलिसिस कहा जाता है। जियोलाइट्स अपनी मधुमक्खी जैसी संरचनाओं के कारण अच्छे आकार-चुनकारी कैटलिस्ट्स हैं। वे माइक्रोपोरस सिलिकेट्स हैं जिनमें सिलिकॉन एटमों की कुछ जगह पर एल्यूमिनियम एटमों द्वारा प्रतिस्थापन होता है, जो
जियोलाइट्स को पेट्रोकेमिकल उद्योगों में हाइड्रोकार्बनों के क्रैकिंग और आइसोमेरिज़ेशन के लिए कैटलिस्ट के रूप में काफी व्यापक रूप से उपयोग किया जा रहा है। पेट्रोलियम उद्योग में एक महत्वपूर्ण जियोलाइट्स कैटलिस्ट, ZSM-5 है। यह उन्हें एक संयोजन के माध्यम से पेट्रोल के रूप में लैटिन में कन्वर्ट करता है, जो कि उन्हें हाइड्रोकार्बनों के मिश्रण देता है।
5.2.4 एंजाइम कैटलिसिस
एंजाइम जीवित पौधों और जानवरों द्वारा उत्पन्न जटिल नाइट्रोजेनरक जैविक यौगिक होते हैं। वास्तव में वे ऊची मूलाकृति के प्रोटीन मोलेक्यूल होते हैं और पानी में एक कापड़ाबन्दी समाधान बनाते हैं। वे बहुत प्रभावी कैटलिस्ट होते हैं; अनेक प्रतिक्रियाओं को कैटलाईज़ करते हैं, खासकर प्राकृतिक प्रक्रियाओं से संबंधित प्रक्रियाओं को। जीव जंतुओं और पौधों के शरीरों में होने वाले कई प्रतिक्रियाओं को एंजाइमों द्वारा कैटलाईज़ किया जाता है। एंजाइम, इस प्रकार, जैवोरसायनिक कैटलाईज़ कहलाते हैं और इस घटना को जैवोरसायनिक कैटलाईसिस के रूप में जाना जाता है।
अब तक, जीवित कोशिकाओं से भिन्न सफेद तत्वों की शुद्ध क्रिस्टलीय स्थिति में कई एंजाइम प्राप्त किए जा चुके हैं। हालांकि, पहला एंजाइम 1969 में प्रयोगशाला में उत्पन्न किया गया था। निम्नलिखित कुछ उदाहरण एंजाइम-कैटलाईज़्ड प्रतिक्रियाओं के हैं:
(i) गन्ने के खाद्यनिकासी: अंधकारिण एंजाइम गन्ने को ग्लूकोज और फ्रूक्टोज़ में बदल देता है।
(ii) ग्लूकोज़ को इथिल एल्कोहॉल में बदलना: जिमेस एंजाइम ग्लूकोज़ को इथिल एल्कोहॉल और कार्बन डाइऑक्साइड में बदलता है।
(iii) अर्थात् स्टार्च को मलटोज़ में परिवर्तित किया जाता है: डायस्टेज़ एंजाइम स्टार्च को मलटोज़ में परिवर्तित करता है।
(iv) अर्थात् मलटोज़ को ग्लूकोज़ में परिवर्तित किया जाता है: मालटेस एंजाइम मलटोज़ को ग्लूकोज़ में परिवर्तित करता है।
(v) अर्थात् यूरिया को अमोनिया और कार्बन डाइऑक्साइड में अपघटित किया जाता है: यूरीज़ एंजाइम इस अपघटन को कैटलाइज़ करता है।
(vi) Petal में, पेप्सिन एंजाइम प्रोटीन को पेपटाइडों में परिवर्तित करता है जबकि अंतिमा में पैंट्रेटिक ट्रिप्सिन एंजाइम प्रोटीन को हाइड्रोलिसिस के माध्यम से एमिनो एसिड में परिवर्तित करता है।
(vii) दूध को दही में परिवर्तित किया जाता है: यह दही में मौजूद लैक्टो बैकिलाई एंजाइम के द्वारा प्रायोगिक प्रतिक्रिया है।
तालिका 5.2: कुछ एंजाइमिक प्रतिक्रियाएँ
| एंजाइम | स्रोत | ||
|---|---|---|---|
| इन्वर्टेस | खमीर | सक्रोज़ |
|
| जैमैस | खमीर | ग्लूकोज़ |
|
| डायस्टेस | मल्ट | स्टार्च |
|
| मालटेस | खमीर | मलटोज़ |
|
| यूरेस | सोयाबीन | यूरिया |
|
| पेप्सिन | पेट | प्रोटीन |
एंजाइम कैटलाइस का विशेषता
एंजाइम कैटलाइस अपनी कार्यक्षमता और उच्च-विशेषता में अद्वितीय है। निम्नलिखित विशेषताएँ एंजाइम कैटलाइस द्वारा प्रदर्शित की जाती हैं:
(i) सबसे अधिक कार्यक्षम: एक एंजाइम के एक मोलेक्यूल से प्रतिक्रियावान को एक मिलियन मोलेक्यूल प्रति मिनट में परिवर्तित कर सकता है।
(ii) उच्च विशेषता का प्रकार: प्रत्येक एंजाइम एक निर्दिष्ट प्रतिक्रिया के लिए विशेष होता है, अर्थात् एक कैटलाइज़र एक से अधिक प्रतिक्रियाओं को कैटलाइज़ नहीं कर सकता है। उदाहरण के लिए, यूरीज़ एंजाइम केवल यूरिया का हाइड्रोलिसिस कैटलाइज़ करता है। यह किसी अन्य एमाइड की हाइड्रोलिसिस कैटलाइज़ नहीं करता है।
(iii) अधिकतम तापमान के तहत अधिकतम सक्रिय: एक एंजाइम प्रक्रिया की दर एक नियत तापमान, जिसे अधिकतम तापमान कहा जाता है, पर अधिकतम होती है। अधिकतम तापमान के दोनों पक्षों में, एंजाइम की गति कम होती है। एंजाइमिक गतिविधि के लिए अधिकतम तापमान सीमा
(iv) अधिकतम
विशेषकरतः प्रेरकों और सहमूल्यों के सामकन के साथ गतिविधि में वृद्धि (v): कुछ पदार्थों की मौजूदगी में एंजाइमिक गतिविधि बढ़ जाती है, जिन्हें सहमूल्य कहा जाता है। इस बात की जांच की गई है कि जब एक छोटी गैर-प्रोटीन (विटामिन) एक एंजाइम के साथ मौजूद होता है, तो कैटालिटिक गतिविधि बहुत ज्यादा बढ़ जाती है।
सक्रिय करनेवाला विक्रिया धातु के रूप में सामान्यतः धातु-आयोनों जैसे
(vi) विषयक दबाव और विषाक्ति का प्रभाव: साधारण कैटालिस्ट की तरह, एंजाइमों को भी कुछ सामग्री के साथ मौजूद होने से निरुद्ध या विषाक्तित किया जाता है। निरुद्धक या विषारक उपयोग कर्म में उसके सतत्विक समूहों के साथ प्रभावित होते हैं और अक्सर एंजाइमों की कैटालिटिक गतिविधि को कम करते हैं या पूरी तरह नष्ट करते हैं। बहुत सारे दवाओं का उपयोग उनके शरीर में एंजाइम निरोधक के रूप में किया जाता है।
एंजाइम कैटालिसिस की यांत्रिकी
एंजाइम के कोलेडियल कणों की सतह पर कई गुफाएँ मौजूद होती हैं। ये गुफाएँ विशेष आकार की होती हैं और
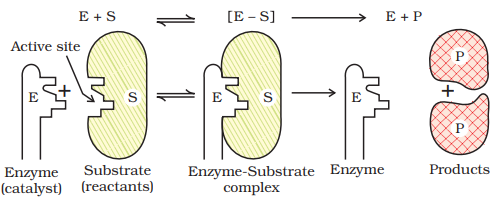
इस प्रकार, एंजाइम-संचालित प्रतिक्रियाएँ दो चरणों में प्रगतिशील होती हैं।
चरण 1: पदार्थ से एंजाइम के बाइंडिंग ताकि एक सक्रिय युक्ति बन सके।
चरण 2: सक्रिय युक्ति की विघटन से उत्पाद बनाने के लिए।
5.2.5 उद्योग में कैटलिस्ट
कुछ महत्वपूर्ण तकनीकी कैटलिस्ट प्रक्रियाएं सूची 5.3 में दी गई हैं ताकि कैटलिस्ट की उपयोगिता के बारे में एक विचार मिल सके।
| प्रक्रिया | कैटलिस्ट |
|---|---|
| 1. अमोनिया की निर्माण के लिए हैबेर प्रक्रिया |
बारीकी से विभाजित लोहे, प्रोमोटर के रूप में मॉलिब्डेनम; शर्तें: 200 बार दबाव और पोटेशियम ऑक्साइड और एल्यूमिना का उपयोग किया जाता है। |
| 2. नाइट्रिक एसिड के निर्माण के लिए ओस्टवाल्ड की प्रक्रिया।
पाठ के अंतर्गत प्रश्न
5.4 हैबर की प्रक्रियामें हाईड्रोजन को NiO उपचारक के मौजूद होने पर मिथेन से भाप रेफॉर्मिंग के द्वारा प्राप्त किया जाता है। अगर हाइबर की प्रक्रिया से अमोनिया प्राप्त की जाती है तो उस समय सीओ को हटाने क्यों आवश्यक होता है?
5.5 बेगिनिंग में एस्टर हाइड्रोलिसिस धीमी होती है और कुछ समय बाद तेज हो जाती है, इसका कारण क्या होता है?
5.6 कैटलिसिस की प्रक्रिया में डीसोर्प्शन का क्या भूमिका होता है?
5.3 कोरॉइड्स
हमने यूनिट 2 में सीखा है कि विलयन समाधान होमोजिन सिस्टम होते हैं। हम जानते हैं कि पानी में रेत को परतफंदी देने पर एक अविलयन होता है, जो धीरे-धीरे समय के साथ नीचे बैठ जाता है। विलयन और परतफंदी हस्तियों के बीच हमें कोलॉइडल छिड़काव या संक्षिप्त रूप से कोराइड्यल छिड़काव की एक बड़ी समूह से गुजरना पड़ता है।
एक कोरॉइड विभक्त प्रणाली होती है, जिसमें एक पदार्थ को विस्तृत खण्डों में बहुत छोटी कणों के रूप में बिखरा जाता है, दूसरे पदार्थ के रूप में छिड़कावी माध्यम कहलाता है।
एक समाधान और कोरॉइड के बीच महत्वपूर्ण अंतर कण के आकार का है। जबकि एक समाधान में, घटक कण आयोन या छोटे मोलेक्यूले होते हैं, एक कोरॉइड में, विस्तृत खण्ड कंबल के कण हो सकते हैं (जैसे कि प्रोटीन या सिंथेटिक पॉलिमर) या कई परमाणु, आयोन या मोलेक्यूलों की मिश्रण हो सकती है। कोराइड कण साधारण मोलेक्यूल से बड़े होते हैं, लेकिन इतने छोटे होते हैं कि वे सस्ती बनी रहती हैं। उनका व्यास प्रायः
समग्रणीय धातु और परसर तंत्र के बीच के प्रक्रियाओं के आधार पर समग्रणियों को वर्गीकृत किया जाता है। निम्नलिखित मापदंडों पर आधारित आठ प्रकार के समग्रणीय प्रणाली संभव हैं: (i) समग्रणीय अवस्था और प्रसारण माध्यम की भौतिक स्थिति (ii) समग्रणीय अवस्था और प्रसारण माध्यम के बीच के संवेषण के प्रकार (iii) समग्रणीय अवस्था के कणों के प्रकार।
एक्सवर्षण के बीच अंश और विस्थापित माध्यम के बीच अंतरक्रिया की प्रकृति के आधार पर, कोलॉइडल सॉल्स दो श्रेणियों में विभाजित होते हैं, जिन्हें लयोफिलिक (द्रव आकर्षण) और लयोफोबिक (द्रव प्रतिक्षेपण) कहा जाता है। यदि जल विस्थापक माध्यम है, तो उपयोग होने वाले शब्द हाइड्रोफिलिक और हाइड्रोफोबिक हैं।
(i) लयोफिलिक कॉलोइडस: शब्द ‘लयोफिलिक’ तात्कालिक-प्यार करने का मतलब होता है। गम, जेलटिन, स्टार्च, रबर आदि जैसे पदार्थों को उपयोगी तरल (विस्थापक माध्यम) के साथ सीधे मिश्रण करके बनाए गए कोलाइडल सॉल्स को लयोफिलिक सॉल्स कहा जाता है। इन सॉलस की एक महत्वपूर्ण विशेषता यह है कि यदि विस्थापक माध्यम विभाजित चरण (आपके द्वारा परमाणुकालान के द्वारा) के माध्यम से अलग हो जाता है, तो सीधे या विदार केवल उपयोगी तरल के साथ पुनः सम्मिश्रण करके सॉल बहुमुखीरूपी कर सकते हैं। इसलिए, इन सॉल्स को रिवर्सिबल सॉल्स भी कहा जाता है। इसके अलावा, ये सॉल्स काफी स्थिर होते हैं और आसानी से संपूर्ण कर नहीं सकते हैं जैसा बाद में चर्चा की गई है।
(ii) लयोफोबिक कॉलोइडस: शब्द ‘लयोफोबिक’ तात्कालिक-नफरेंक करने का मतलब होता है। धातु, उनके सल्फाइड आदि जैसे पदार्थों को अगर बस विस्थापक माध्यम के साथ मिश्रित किया जाए तो वे कोलाइडल सॉल नहीं बनाते हैं। उनके कोलाइडल सॉल्स को विशेष तरीकों से तैयार किया जा सकता है (जैसा कि बाद में चर्चा की गई है)। इन सॉल्स को छोटी मात्रा में विद्युत्क्रमितों, ताप या हिलाने के द्वारा बहुत आसानी से संपूर्ण कर दिया जाता है और इसलिए, यह स्थिर नहीं होते हैं। इसके अलावा, एक बार प्रदत्त होने के बाद, वे द्वारा सीधे प्रतिपुष्टि केवल विस्थापक माध्यम की साधारण योजना के माध्यम से नहीं देते हैं। इसलिए, इन सॉल्स को असंवर्तनीय सॉल्स भी कहा जाता है। लयोफोबिक सॉल्स को उनके संरक्षण के लिए स्थिरीकरण एजेंटों की आवश्यकता होती है।
5.4.3 विस्थापित चर के प्रकार के आधार पर वर्गीकृत, बहुआणु, मैक्रोमोलेक्युलर और संबंधित कॉलोइडस
विस्थापित चर के पदार्थों के प्रकार के आधार पर, कोलॉइडस मल्टीमॉलेक्युलर, मैक्रोमोलेक्युलर और संबंधित कॉलोइडस के रूप में वर्गीकृत होते हैं।
(i) मल्टीमॉलेक्युलर कॉलोइडस: विलय के समय, एक पदार्थ के बड़ी संख्या के परमाणु या छोटे मोलेक्युल कोलाइडल सीमा में आकर्षित हो जाते हैं और उन्हें मल्टीमॉलेक्युलर कॉलोइडस के रूप में कहा जाता है। उदाहरण के लिए, एक सोने का सॉल परमाणुओं की कई आकारों के टुकड़ों को शामिल कर सकता है। सल्फर सॉलमें हजारों या अधिक
(ii) मैक्रोमोलेक्युलर कॉलोइडस: सुयोजनों में मैक्रोमोलेक्युलर (यूनिट 15) उपयुक्त विस्थापित माध्यम में मोलेक्यूल के आकार को कोलाइडल सीमा में हो सकता है। ऐसे प्रणालियों को मैक्रोमोलेक्युलर कॉलोइडस कहा जाता है। ये कॉलोइड्स काफी स्थिर होते हैं और कई ही दंशों में सच्ची योजना से प्रत्यज्जन समानताएं रखते हैं। प्राकृतिक रूप से उपस्थित मैक्रोमोलेक्युलरों के उदाहरण हैं स्टार्च, सेलुलोज़, प्रोटीन्स और एंजाइमेंस; और मन-निर्मित मैक्रोमोलेक्युलरों के तो पॉलिथीन, नायलॉन, पॉलिस्टायरीन, संश्लेषित रबर आदि हैं।
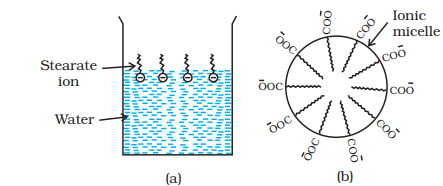
(iii) संबंधित जल्पयवयाः (मिसेल): कुछ पदार्थ हैं जो कम मात्रा में सामान्य मजबूत विद्युत तत्व की भांति व्यवहार करते हैं, लेकिन जब मात्रा बढ़ जाती है तो घनभाषीता का प्रदर्शन करते हैं क्योंकि इकट्ठाई की गठन होती है। ऐसा गठन हुआ अनुभवित अणु को मिसेल कहते हैं। इन्हें संबंधित जल्पयवया भी कहते हैं। मिसेल का गठन केवल उसी जल्पांबिय के ऊपर होता है, जिसे क्राफ्ट तापमान
मिसेल गठन का तंत्र
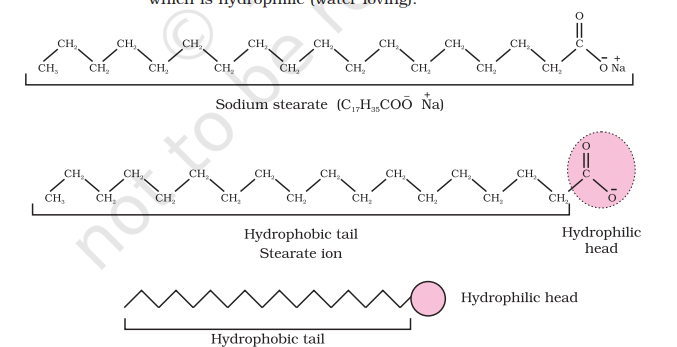
हम साबुन समाधान का उदाहरण लेते हैं। साबुन ऊंचा वस्त्रीय अम्ल के सोडियम या कालियम लवण है और इसे
अतः,
इसी तरह, संश्लेषणियों के मामले में भी, जैसे कि सोडियम लौरिलसल्फेट,
साबुनों की सफाई क्रिया
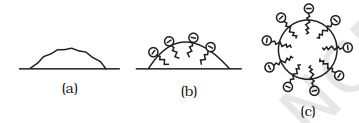
हालांकि,साबित होगया है कि एक मिसेल में हाइड्रोफोबिक हाइड्रोकार्बन-समान वर्तमान मध्यम मूल्यांकन गोलीक है। साबुन के सफ़ाई क्रिया का कारण यह है कि साबुन के मोलेक्यूल तेल प्रक्षेपण के चेहरे की गोली में एक मिसेल का समरूप बनाते हैं इस तरह की हाइड्रोफोबिक हिस्सा का स्टीयरेट आयन पेशी के माध्यम से तेल की गोली में होता है और हायड्रोफिलिक हिस्सा बाहर निकलता है जैसे ब्रिसल (चित्र 5.7)। क्योंकि धार्मिक समूह पानी के साथ प्रभावित हो सकते हैं, इसलिए स्टीयरेट आयन से घिरा तेल की गोली अब पानी में खिसकती है और गंदे सतह से हटा दी जाती है। इस प्रकार साबुन खाद्य तेल और चर्बी को वियोजन और धुलाई करने में मदद करता है। ग्लाइब mAन अण्डाकारण तेजीत सीरी एकता को रोकती हैं उन्हें हाथ करने और समूह से मिश्रण बनाना।
5.4.4 गोलियाँ की तैयारी
कुछ महत्वपूर्ण विधियाँ गोलियाँ तैयार करने के लिए निम्नानुसार हैं:
(a) रासायनिक विधि: केमिकल प्रतिक्रियाओं के द्वारा कोलॉयडल वितरण रेखा बनाई जा सकती है, जो एकत्रण के माध्यम से अणुओं के निर्माण की अवस्था में पहुंचते हैं, हटा, अवस्था या संहारीकरण। ये एकत्रण तारों की गठन करने में ले जा सकते हैं।
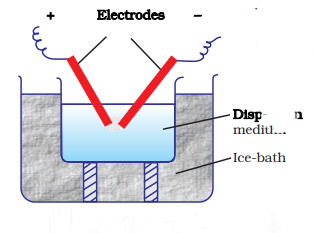
(b) विद्युती विछेदन या ब्रेडिग का विधि
इस प्रक्रिया में छिड़काव के साथ बिखराव और संघटिति दोनों होते हैं। सोने, सिल्वर, प्लैटिनम आदि जैसे धातुओं की कोलॉयडल स्नान प्रकार के खनिजों की तैयारी इस विधि द्वारा की जा सकती है। इस विधि में धातु के इलेक्ट्रोड में डूबे मेटल के इलेक्ट्रोड के बीच बिजली का चमकिला विद्युत स्पंदन देखा जा सकता है (चित्र 5.8)। उत्तेजित उष्णता में उत्पन्न मेटल तापहीन हो गया है, जो तत्काल उदःरण के रूप में पत्तियों के रूप में संपक्ष बनाता है। हो सकता है।
(c) पेप्टिज़ाशन
पेप्टिज़ाशन को छोटे मात्रा में विलयन माध्यम के आविर्भाव के साथ उपस्थित बिखराव में गुड़वाने की प्रक्रिया के रूप में परिभाषित किया जा सकता है। इसके लिए तत्काल एक सोद्र्व में बनाई गई रेशा को कोलॉयडल सोल में परिवर्तित करने के लिए विलिन्द्रोंसाधन के साथ गड़बड़ा दिया जाता है। इस विधि का उपयोग आमतौर पर ताजगी से परिभाषित किया गया बिक्वटी को कोलॉयडल सोल में परिवर्तित करने के लिए होता है।
दौरान पेप्टिज़ेशन, निपात इलेक्ट्रोलाइट के अणु में से एक को अपनी सतह पर ज़ोर लगाता है। इसके परिणामस्वरूप, निपात पर सकारात्मक या ऋणात्मक धारा के विकास का कारण बन जाता है, जो अंत में एक कॉलॉइड की आकार के छोटे अणुओं में टूट जाते हैं। आप इसे अंध्यारुपणिय अणुओं पर धारा का विकास के बारे में अध्याय 5.4.6 में सीखेंगे। “कॉलोइड पदार्थों पर आकर्षण” के तहत।
5.4.5 कोलोइडीय समाधानों की शोध
आमतौर पर तैयार किए जाने पर कोलोइडीय समाधानों में अधिकांश मात्रा में इलेक्ट्रोलाइट और कुछ अन्य द्रव्य मिलती है। यहां तक कि कोलोइडीय समाधान की स्थिरता के लिए अल्प मात्रा में इलेक्ट्रोलाइट की उपस्थिति ज़रूरी है, ज़्यादा मात्रा ही समाधान को जमाने में मदद करती है। इसलिए, इन द्रव्यों की मात्रा को एक आवश्यक न्यूनतम तक कम करने की आवश्यकता होती है। उपयोग की जाने वाली प्रक्रिया को कोलोइडीय समाधान की शोध के रूप में जाना जाता है। कोलोइडीय समाधान की शोध निम्नलिखित तरीकों द्वारा की जाती है:
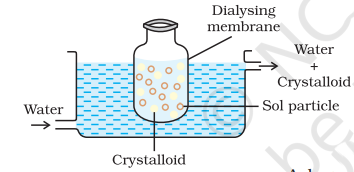
(i) डायलिसिस: यह एक उपयुक्त पर्दे के माध्यम से एकोलोइडीय समाधान से एक लिया गया पदार्थ को अलग करने की प्रक्रिया है। यहां तक कि एक सच्चे समाधान में अणुओं (आयन या छोटे अवयव) को जानवरों के परदे (बैड़बग़) या पार्चमेंट पेपर या चेलोफेन परत से द्वारा पास हो सकते हैं, लेकिन कॉलॉइडीय अणु पारद नहीं कर सकते हैं, इसलिए परद पेश के लिए उपयोग किया जा सकता है। इस उद्घाटन का उपयोग डायालाइज़र के लिए किया जाता है। आदर्श पर्दे के एक बैग में कोलोइडीय समाधान को सास पाया जाता है और जिसमें ताजगी पानी लगातार बहती है (चित्र 5.9)। अणुओं और आयन परद पारद से बाहरी पानी में विसर्जित होते हैं और शुद्ध कोलोइडीय समाधान पीछे रह जाता है।
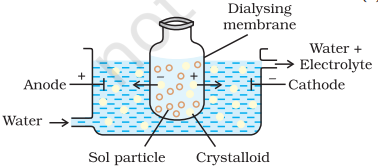
(ii) इलेक्ट्रो-डायालिसिस: साधारणतः, डायालिसिस की प्रक्रिया बहुत धीमी होती है। यदि अस्वच्छ कोलॉइडीय समाधान में विलयित सबसे केवल एलेक्ट्रोलाइट होता है, तो इलेक्ट्रिक्ट्रिक्ट्रिस्सकीस लागू करके इसे तेजी से बनाया जा सकता है। तब प्रक्रिया को इलेक्ट्रोडायालिसिस कहा जाता है। कोलोइडीय समाधान एक उपयुक्त परदे के बैग में रखा जाता है जबकि बाहरी पानी शुद्ध लिया जाता है। फिगर 5.10 में दिखाए गए प्रकार में पार्दों में के उमगत आयनों को कोलॉइडीय समाधान से बाहर की सक्रियता करता है।
(iii) अल्ट्राफ़िल्ट्रेशन: अल्ट्राफ़िल्ट्रेशन कोलॉयडल समाधान में मौजूद सोल्वेंट और द्रव्यमान्य बिलियों को विशेष तैयार किए गए फ़िल्टर्स द्वारा अलग करने की प्रक्रिया है, जो कॉलॉयडल बिलियों को छोड़कर सभी पदार्थों के प्रवाह को अनुमति देते हैं। कॉलॉयडल बिलियां सामान्य फ़िल्टर पेपर से गुजर सकती हैं क्योंकि रेखाओं का आकार बहुत बड़ा होता है। हालांकि, फ़िल्टर पेपर की रेखाएं कॉलॉयडल बिलियों के फ़्लो को रोकने के लिए कॉलोडियन समाधान के द्वारा आकार में कम की जा सकती हैं। सामान्य रूप से कॉलोडियन एक आपकीत्र धातुशली (नाइट्रो-सेलुलोज़ का 4% समाधान) अल्कोहल और ईथर के मिश्रण में होती है। एक अल्ट्रा-फ़िल्टर पेपर को फ़िल्टर पेपर को कॉलोडियन समाधान में भिगोने, फॉर्मालडेहाइड द्वारा कठोरीकरण करने और अंत में उसे सुखाने के द्वारा तैयार किया जा सकता है। इस तरह, अल्ट्रा-फ़िल्टर पेपर का उपयोग करके कॉलॉयडल बिलियों को अनुरेशा के बाकी सामग्री से अलग किया जा सकता है। अल्ट्राफ़िल्ट्रेशन एक धीमी प्रक्रिया है। प्रक्रिया को तेज़ करने के लिए दबाव या खिंचाई लागू की जाती है। अल्ट्रा-फ़िल्टर पेपर पर छोड़े गए कॉलॉयडल बिलियों को उबले हुए विस्तार माध्यम (सोल्वेंट) के साथ आलूचन में मिलाया जाता है ताकि पुरे कॉलॉयडल समाधान को प्राप्त करें।
5.4.6 कॉलॉयडल समाधानों की गुणधर्में
कॉलॉयडल समाधानों द्वारा प्रदर्शित विभिन्न गुणधर्मे नीचे वर्णित हैं:
(i) गठितीय गुणधर्म: कॉलॉयडल बिलियां बड़ी संघटित आपूर्ति होने के कारण, कॉलॉयडल समाधान में निर्णायकों की संख्या सो संगणक समाधान की तुलना में कम होती है। इसलिए, आपूर्ति पर प्रभावित गुणधर्मों (आर्धाक्त मान, वाष्प माध्यानिक तन्त्र में कमी, सतहीन बिंदु में ऊँचाइ और गलनांक बिंदु में तलोंजन) की महत्व होती है जो स्तरों में दिखाए गए समानताओं की तुलना में छोटी होती है।
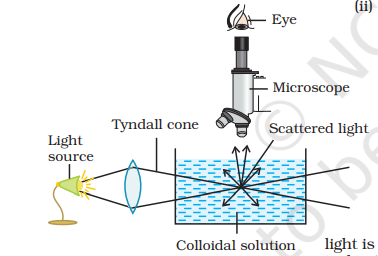
(ii) टिंडल प्रभास : यदि एक एकरसीय समाधान काले में रखी जाएगी और प्रकाश की दिशा में देखा जाएगा, तो यह स्पष्ट दिखाई देगी और यदि यह प्रकाश बीम की दिशा के लागू स्थान से देखा जाएगा, तो यह पूरी तरह से काला दिखाई देगी। वैज्ञानिक समाधान इसी तरह देखे जाने पर उचित रूप से ज्यामित या स्पष्ट दिखते हैं छोर से प्रवाह किए जाने पर, जो कि ठंडे दिखाई देते हैं, जब उज्ज्वल स्थान पर राशि की रोशनी से प्रकाशित की जाती है, इस प्रभास को पहली बार फ़ैराडे ने देखा था और इसका विवरण तिंडल द्वारा विभिन्न संगठनों में अध्ययन किया गया है, इसे टिंडल प्रभास कहा जाता है। उज्ज्वलता का चमकता हुआ वक्र त्रिकोण टिंडल ट्रिकोन (चित्र 5.11) कहा जाता है। टिंडल प्रभास उस समय देखा जा सकता है जब निम्नलिखित दो स्थितियाँ पूर्ण की जाती हैं।
(i) फैल गए बिंदुओं का व्यास प्रकाश की तरंगदैर्या से बहुत नीचा हो। और
(ii) छित्रणकर्ता और विस्तार माध्यम के पुनः प्रमाण का भिन्नांक बहुतायत से अलग होते हैं।
टाइंडल प्रभाव का उपयोग एक कोल्लोइडियल और सच्ची विधि के बीच भेद करने के लिए किया जाता है। 1903 में जिस्मोंडी ने टाइंडल प्रभाव का उपयोग करके एक यूल्ट्रामाइक्रोस्कोप के रूप में जाने वाले एक यंत्र स्थापित किया। एक प्रचंड प्रकाश की किरण को एक कांची बरतन में समायोजित कोल्लोइडियल समाधान में ध्यान केंद्रित किया जाता है। फिर, प्रकाश का बिंदु एक माइक्रोस्कोप के माध्यम से बायांबोध समाकोण में देखा जाता है। व्यक्तिगत कोल्लोइडियल कण सामान्य रूप से अंधेरे पृष्ठ में उज्ज्वल तारे के रूप में प्रकट होते हैं। यूल्ट्रामाइक्रोस्कोप वास्तविक कोल्लोइडियल कणों को दिखाने नहीं देता है लेकिन केवल उनके द्वारा छित्रित प्रकाश का अवलोकन करता है। इस प्रकार, यूल्ट्रामाइक्रोस्कोप कोल्लोइडियल कणों के आकार और आकार के बारे में कोई जानकारी नहीं प्रदान करता है।
(iii) रंग: कोल्लोइडियल समाधान का रंग विस्तारित कणों द्वारा तितरण की लम्बाई पर निर्भर करता है। प्रकाश की लम्बाई भी कणों के आकार और प्रकृति पर निर्भर करती है। कोल्लोइडियल समाधान का रंग भी प्रकाश के तरीके में परिवर्तित होता है जिसमें उत्कीर्ण प्रकाश द्वारा देखने पर दूध और पानी का मिश्रण नीला दिखाई देता है और पारावर्तित प्रकाश द्वारा देखने पर लाल दिखाई देता है। सबसे छोटी सोने की विषाणुता लाल रंग में होती है; कणों का आकार बढ़ता है, तो यह बादली, फिर नीली और अंततः सोने सा दिखाई देती है।
(iv) ब्राउनियन चाल: जब कोल्लोइडियल समाधानों को एक प्रबल यूल्ट्रामाइक्रोस्कोप के तहत देखा जाता है, तो कोल्लोइडियल कणों को एक निरंतर सी-जिगजिगी गति की स्थिति में प्रदर्शित किया जाता है। यह गतिविधि ब्रिटिश वनस्पति विज्ञानी रॉबर्ट ब्राउन ने पहली बार देखी और इसे ब्राउनियन चाल के रूप में जाना जाता है। यह गतिविधि द्वीपों की प्रकृति से असमान तरंगद्वीपी हमले की वजह से होती है। ब्राउनियन चाल को स्थिरता समाधानों के लिए जिम्मेदार माना जा रहा है क्योंकि सामान्य चार्ज वाले कणों के बीच प्रतिघाती बल बनाने वाले बीच समान और समान बाधाएं होती हैं जब वे एक-दूसरे के करीब आते हैं।
(v) संतृप्ति पर कोल्लोइडियल कणों का चार्ज: कोल्लोइडियल कण हमेशा एक विद्युत चार्ज रखते हैं। एक विद्युत चार्ज का स्वभाव एक दिए गए कोल्लोइडियल समाधान में सभी कणों पर समान होता है और इसका चार्ज प्रतीत या नकारात्मक हो सकता है। उनमें बराबर और समान चार्ज की उपस्थिति को बढ़ावा दिया जाता है जो इन्हें एक-दूसरे के पास आते समय संघटित नहीं होने देती है।
ठोस धातु की ‘सोल’ के ऊपर धारित विद्युतआवेश होती है, जो एक या अधिक कारणों के कारण होती हैं। जैसे, धातुओं के विद्युद्वितरण के दौरान सोल कणों द्वारा इलेक्ट्रॉन कैप्चर, समाधान से आयोन का प्राथमिक आवेश और / या विद्युत द्विगुण बनाने के कारण। आयोनों के प्राथमिक आवेश के द्वारा सोल कणों पर धारा विकसित की जानकारी नीचे दी गई है।
सोल कणें प्राथमिक आवेशीकरण के माध्यम से सकारात्मक या ऋणात्मक आवेश प्राप्त करती हैं, सकारात्मक या ऋणात्मक आयोनों के प्राथमिक आवेश के द्वारा। जब सक्रिय विस्तरण माध्यम में दो या अधिक आयोन मौजूद होते हैं, तो सामान्यतः कोलॉइडल कण की दृढ़ता से प्राथमिक आयोन का आवेश होता है। इसे निम्नलिखित उदाहरणों के द्वारा समझाया जा सकता है:
(अ) जब चांदी नाइट्रेट समाधान को पोटेशियम आयोडाइड समाधान में मिलाया जाता है, तो पसू चांदी आयडाईड माध्यम से आयोडाइड आयोनों को आकर्षित करता है और ऋणात्मक आवेश कोलॉइडल सोल पैदा होता है। हालांकि, जब
| ऋणात्मक आवेश | सकारात्मक आवेश |
(ब) जब
पहले उल्लिखित रूप में कोलाइडल कण की सतह पर चयनात्मक आवेश के द्वारा लये गए एक सकारात्मक या ऋणात्मक आवेश प्राप्त करने के बाद, यह परत माध्यम से धर्मिक आयों को आकर्षित करती है, और एक दूसरी परत बनाती है, जैसा कि नीचे दिखाया गया है।
कोलाइडल कण के चारों ओर विपरीत धारिते की दो परतों का संयोजन को Helmholtz विद्युत द्विपरत कहा जाता है। आधुनिक दृष्टिकोण के अनुसार, जो पहली परत आयों द्वारा कड़ी से पकड़ी जाती है और स्थिर परत कहलाती है, वहां दूसरी परत गतिशील होती है, जिसे विसारक परत कहा जाता है। चित्र 5.13 परिचिति क्षेत्र का गठन दर्शाता है। चारों ओर के फिक्स्ड परत और विसार्जित धारितों के बीच विद्युत प्रभेद तथा अलगाव का अंतर कैपेसिटर में विकसित की तरह होता है। फिक्स्ड परत और विसार्जित परत के विपरीत धारितों के बीच इस विद्युत प्रजाति को विद्युतकिनेटिक प्रभेद या ज़ीटा विद्युतक कहा जाता है।
यदि निर्मित सामग्री के दो कण (संकुचित) के पास द्विपरित्याग नहीं होता है तो वैं दरिकते सक्षम होते हैं और आपस में आकर्षक वैन देर वाल्स बल उन्हें मिला लेते हैं। जब कण में द्विपरित्याग होती है, जैसा कि चित्र 5.13 में दिखाया गया है, तो समग्र प्रभाव यह है कि जब कण एक दूसरे के पास नहीं जा सकते वे एक दूसरे को पहुंच सकते हैं। यह दुरुस्ती संभव नहीं होती है। वे वितरित हो जाते हैं और अर्ध-कोलॉइडल हो जाते हैं।
अधिक इलेक्ट्रोलाइट्स को सोल में मिलाने से छिड़काव डबल परती और ज़ीता पोटेंशियल को कम करता है। यह कणों के बीच विद्युतीय विकर्षण को बहुत बड़े हद तक कम करता है और कोलिड धातुयों को बरसाता है। इसलिए कोलॉइड विशेष रूप से विपरीत चार्जधारी आयनों के प्रति संवेदनशील होता है।
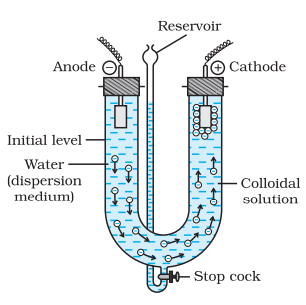
(vi) इलेक्ट्रोफोरेसिस: कोलोइडीय कणों पर चार्ज होने की उपस्थिति इलेक्ट्रोफोरेसिस प्रयोग द्वारा पुष्टि की जाती है। जब कोलोइडीय वाली एक संकरी विधि में डुबकियों में लगाई गई एक विद्युत पोटेंशियल होता है, तो कोलोइडीय कण एक या दूसरे इलेक्ट्रोड की ओर ले जाते हैं। एक लगाये गए विद्युत पोटेशियल के तहत कोलोइडीय कणों की चलना इलेक्ट्रोफोरेसिस कहलाती है। सकारात्मक चार्जधारी वाले कण ध्रुवान्त की ओर चलते हैं जबकि नकारात्मक चार्जधारी वाले कण अनोड की ओर चलते हैं। इसे निम्नलिखित प्रयोगात्मक स्थापना (चित्र 5.14) द्वारा दृश्यमान किया जा सकता है।
जब इलेक्ट्रोफोरेसिस, अर्थात्, कणों के चलने को किसी उपयुक्त तरीके से रोका जाता है, तो द्विस्थानीय माध्यिका बिजली क्षेत्र में चलना शुरू करती है। यह घटना इलेक्ट्रोओस्मोसिस कहलाई जाती है।
(vii) सांकटीकरण या अवाक: ल्योफोबिक सॉलों की स्थिरता को कोळाइडीय कणों पर चार्ज की मौजूदगी के कारण होती है। यदि, किसी तरह से, चार्ज हटा दिया जाए, तो कण आपस में और करीब आकर एकत्रित होंगे (या संकटित होंगे) और गुरुत्वाकर्षण की ताकत के नीचे बैठेंगे।
कोळाइडीय कणों के समायोजन की प्रक्रिया को सांकटीकरण या सॉल की बरसात कहा जाता है। ल्योफोबिक सॉलों का सांकटीकरण निम्नलिखित तरीकों से किया जा सकता है:
(i) इलेक्ट्रोफोरेसिस द्वारा: कोलॉइडीय कण विपरीत चार्जधारी इलेक्ट्रोड पर चलते हैं, डिस्चार्ज हो जाते हैं और संकटित होते हैं।
(ii) दो विपरीत चार्जधारी सॉल मिलाने से: विपरीत चार्जधारी सॉलों को लगभग बराबर अनुपात में मिलाने पर उनकी चार्जधारी का न्यूट्रीकरण होता है और वे आंशिक या पूर्णतः संकटित हो जाते हैं। हाइड्रेटेड फेरिक ऑक्साइड (+ve सॉल) और आर्सेनिकल सल्फाइड (–ve सॉल) का मिश्रण उन्हें संकटित रूपों में लाता है। इस प्रकार का संकटीकरण सहसंक्रिय संकटीकरण कहलाता है।
(iii) उबालकर: जब कोई सॉल उबलता है, तो विस्तार माध्यम के कणों के साथ विलीन हुई परत बढ़ जाती है। इससे कणों पर चार्ज कम हो जाती है और अन्ततः उबाल से नीचे बैठने की बाद में नित्य संकटित होती है।
(iv) दीर्घकालिक प्रवाहक: लंबे समय तक का इलाज करने पर, सॉल में मौजूद इलेक्ट्रोलाइट के सांशोधीकरण से छूट जाते हैं और कोलॉइड अस्थिर होते हैं और अंततः संकटित होते हैं।
(iv) इलेक्ट्रोलाइट का योगदान करके: जब एक इलेक्ट्रोलाइट का अधिकांश योगदान किया जाता है, तो कोलॉइडीय कणों को संकटित किया जाता है। कारण यह है कि कोलॉइड्स उन प्रतिभागियों के साथ संविद्युत रखते हैं जो खुद पर मौजूद चार्ज के उल्टे धारित होते हैं। इससे संविद्युतीकरण होता है, जो उनके संकटन का कारण होता है। कण पर उत्क्षेपण प्रतिभागी ईयन उत्क्षेपण की जि़म्मेदारी होता है। एक नकारात्मक आयन पॉजिटिव के साथ संकटित सॉल के संकटन का कारण होता है और इसके विपरीत भी।
यह देखा गया है कि, सामान्य रूप से, जो फ्लॉक्यूलेटिंग आयन जोड़ा जाता है, उसके वैलेंस के साथ अधिकांशतः संघटन कराने की शक्ति भी बढ़ती है। इसे हार्डी-शुल्ज़े नियम के रूप में जाना जाता है। एक नकारात्मक सॉल कोग्युलेशन में, फ्लॉक्यूलेटिंग शक्ति का आदेश है:
इसी तरह, एक सकारात्मक सॉल कोग्युलेशन में, फ्लॉक्यूलेटिंग शक्ति का आदेश है:
दो घंटों में एक सॉल को संघटित करने के लिए मिलीमोल प्रति लीटर वाले एलेक्ट्रोलाइट की न्यूनतम राशि को कोग्युलेशन मान कहा जाता है। जितनी कम मात्रा चाहिए उतनी ऊँची आयन की कोग्युलेशन शक्ति होगी।
रुपांतरण की अवरोधन
लायोफिलिक सॉल्स की स्थिरता के लिए दो कारक जिम्मेदार होते हैं। इन कारकों में से एक होता है घात और कोलाइडल कणों की सोल्वेशन। जब इन दो कारकों को हटा दिया जाता है, तो एक लायोफिलिक सॉल कोग्युलेशन किया जा सकता है। इसे (i) एक इलेक्ट्रोलाइट जोड़कर और (ii) इकाई उपयुक्त सोल्वेंट जोड़कर किया जाता है। जब एल्कोहल और ऐसीटोन जैसे सोल्वेंट को हाइड्रोफिलिक सॉल्स में जोड़ा जाता है, तो वितरित चरण का निर्जलीकरण होता है। इस स्थिति के तहत, थोड़ी सी मात्रा का एलेक्ट्रोलाइट कोग्युलेशन लाने में सक्षम हो सकती है।
कॉलॉइडों की सुरक्षा
लायोफिलिक सॉल्स लायोफोबिक सॉल्स से अधिक स्थिर होते हैं। इस कारण लायोफिलिक कोलॉइडल कोलाइडों को विशेष रूप से सोल्वेशन द्वारा आवरणित किया जाता है, अर्थात् कोलाइड कणों को जहां वे विवरण होते हैं, प्रतिक्षेत्र द्वारा ढका जाता है। लायोफिलिक कोलॉइडल कोलाइड जो इस उद्देश्य के लिए प्रयोग किए जाते हैं, को सुरक्षा संरक्षक कोलाइड कहा जाता है।
5.5 इमलशन
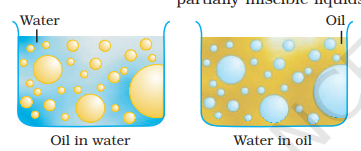
ये तरल-तरल कोलॉइड ढाल हैं, अर्थात् एक अन्य तरल में छोटी हुई टुकड़ेदार छिड़कने की छिड़काव। यदि दो अमिश्रित या आंशिक अमिश्रित तरलों का मिश्रण हिलाया जाता है, तो एक अन्य तरल में प्राप्त होनेवाली दस्तरपूर्ण छाटा को मिश्रण कहा जाता है। सामान्यतया, इन दोनों तरलों में से एक पानी होता है। इन्हें दो प्रकार के इमलशन कहा जाता है। (i) तेल पानी में छिटाने वाले तरल (ओ / डब्ल्यू प्रकार) और (ii) तेल में छिटाने वाले पानी (डब्लू / ओ प्रकार)।
पहले सिस्टम में पानी व्याप्ति माध्यम के रूप में कार्य करता है। इस प्रकार की इमलशन के उदाहरण दूध और गायब होने वाली क्रीम होती है। दूध में, तरल चरबी पानी में विस्तारित हो जाती है। दूसरे सिस्टम में, तेल व्याप्ति माध्यम के रूप में कार्य करता है। इस प्रकार के उदाहरण घी और क्रीम हैं।
Emulsions का तेल में पानी में एक अस्थिर होता है और कभी-कभी खड़े होने पर दो तहियों में अलग हो जाता है। एक इमल्शन को स्थिर करने के लिए, एक तीसरा तत्व जिसे इमल्सिफाइंग एजेंट कहा जाता है, आमतौर पर जोड़ा जाता है। इमल्सिफाइंग एजेंट निलंबित कणों और माध्यम के बीच एक संवाहक फिल्म बनाता है। O/W इमल्शन के लिए प्रमुख इमल्सिफाइंग एजेंट प्रोटीन, गोंद, प्राकृतिक और संश्लेषित साबुन इत्यादि होते हैं, और W/O के लिए, धातुओं के लघुमूल ऍसिड, लंबी श्रृंग आल्कोहल, लैम्पब्लैक इत्यादि।
इमल्सन्स को बिखराए बिना अलग-अलग मात्राओं में पतला किया जा सकता है। वहीं, छोटे लिज्जत होते हैं जो कक्षित होने और द्विधातु माध्यम में विभाजित होने वाले मिश्रण में होते हैं। इमल्सन्स में सतह छळने और टिंडैल प्रभाव दिखाने की समर्थन की ज्यादातर बूंदबाट सतही अवेशानिक ध्रुवियों में नकारात्मक धारिता होती है। इमल्सन्स को गर्म करने, ठंडा करने, केन्द्रित करने आदि के द्वारा संस्करण तत्वों में विभाजित किया जा सकता है।
5.6 हमारे आसपास के झीलों
हमारे दैनिक जीवन में हमें सबसे अधिक दिखाई देने वाली पदार्थ में से अधिकांश कोलॉइड होते हैं। हम जो भोजन खाते हैं, जो कपड़े पहनते हैं, जो लकड़ी के फर्नीचर का उपयोग करते हैं, जिन घरों में हम रहते हैं, जिन अखबारों को हम पढ़ते हैं, सभी कोलॉइडों से बने होते हैं।
निम्नलिखित कुछ रोचक और उल्लेखनीय कोलोइडों के उदाहरण हैं:
(i) आसमान का नीला रंग: धूल के कणों के साथ जल न द्वारा हवा में निम्नलिखित समेत नीला प्रकाश छिड़कता है, जो हमारी आंखों तक पहुंचकर आसमान को नीला दिखाई देता है।
(ii) कोहरा, मिस्ट और बारिश: जब हवा में धूल कणों के साथ युक्त बड़े मात्रा में वायु ठंडे अपने जोहरपत के नीचे ठंडा किया जाता है, तो इन कणों की सतहों पर नमी भोंकती है और सूक्ष्म बूँदों का निर्माण होता है। इन बूँदों को वायु में कोलोइडल प्रकृति के रूप में तैरते रहते हैं। बादल वायु में फैली हुई छोटी बूँदों को होते हैं, जब ऊपरी वायुमंडल में संकुचन के कारण, कोलॉइडल बूँदों का आकार बड़ा होता है, जब तक कि वह वर्षा के रूप में निचले स्तर पर नहीं आते। कभी-कभी, विपरीत चार्ज वाले बादलों की मुलाकात होने पर वर्षा होती है।
वायुयान से इलेक्ट्राइफाइड रेत को फेंककर या बादलों पर निर्द्देशित विपरीत चार्ज वाले एक सोल को स्प्रे करके, कृत्रिम वर्षा उत्पन्न की जा सकती है।
(iii) खाद्य वस्त्र: दूध, मक्खन, हलवा, आइसक्रीम, फली का रस आदि, सभी रूप में कोलॉइड होते हैं।
(iv) रक्त: यह एक अलब्युमिनॉइड पदार्थ का कोलॉइडल समाधान होता है। फिटकरी और फेरिक क्लोराइड समाधान की ठंडी होने की कारण, यह ज्वर की नमपन बंद करने वाला रक्त का सत्यापन कार्य करता है।
(v) मिट्टी: उर्वरक मिट्टी की प्रकृति होती है, जिसमें ह्यूमस का एक संरक्षक कोलॉइड कार्य करता है। कोलॉइडल प्रकृति के कारण, मिट्टी नमी और पोषण सामग्री को अवशोषित करती है।
(vi) डेल्टा का निर्माण: नदी का पानी चिकनी मिट्टी की एक कोलॉइड समाधान होता है। समुद्री पानी में कई विद्युत्कटौती कणों होते हैं। जब नदी का पानी समुद्री पानी से मिलता है, तो समुद्री पानी में मौजूद विद्युत्कटौती कोलॉइड समाधान को संकुचित कर देते हैं, जिससे डेल्टा के साथ उनके ठहराव के साथ उत्पन्न होता है।
कोलॉइडों के अनुप्रयोग
कोलॉइड्स को उद्योग में व्यापक रूप से उपयोग किया जाता है। निम्नलिखित कुछ उदाहरण हैं:
what is the hi version of content: 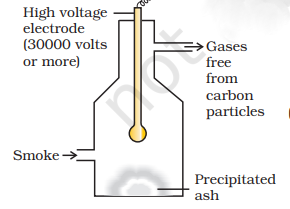
(इ) धूंक का विद्युतीय प्रवालन: धूंक वायु में कार्बन, अर्सनिक यौगिक, धूल आदि जैसे ठोस कणों का एक कोलाइडल समाधान होता है। चिमनी से निकलने से पहले धूंक को उसे चेंबर में ले जाया जाता है, जिसमें प्लेट्स होते हैं जिनका आपोशित धूंक कणों द्वारा लिया जाने वाला आपोशान विपरीत धारा होता है। इन पदार्थों की कसौरत करने पर कण अपने आप आपोशान खो देते हैं और झूल जाते हैं। इस प्रकार के पदार्थ चेंबर की फर्श पर बैठ जाते हैं। इस प्रक्रिया को काटलेट प्रेसीपिटेटर कहा जाता है (चित्र 5.16)।
(ई) पेयजल की शोधसाधन: प्राकृतिक स्रोतों से प्राप्त जल में आमतौर पर लटकते रहने वाले अशोधित अपशिष्ट होते हैं। ऐल्यूम ऐसे पानी में मिश्रित अशोधित तत्वों को एकत्र करने और पानी को पेय के उद्देश्यों के लिए उपयुक्त बनाने के लिए योग्य कर दिया जाता है।
(ग) औषधि: अधिकांश औषधियां कोलाइडल होती हैं। उदाहरण के लिए, आर्गीरोल एक आँख अर्ध्य के रूप में उपयोग होता है। कोलाइडल एंटीमनी कालाजार को ठीक करने के लिए उपयोग होता है। इंजेक्शन के लिए कोलाइडल सोना का उपयोग होता है। इंजेक्शन के लिए कोलाइडल सोना का उपयोग होता है। आम्युनिया दूध, एक एमल्शन, पेट के विकारों के लिए उपयोग होता है। कोलाइडल औषधियों को अधिक प्रभावी माना जाता है क्योंकि उनमें बड़ी सतह क्षेत्र होती है और इसलिए अवश्य एकीकृत होती हैं।
(ध) तनिका: पशु खालें कोलाइडल होती हैं। जब हाइड, जिसमें सकारात्मक द्वारा युक्त कण होते हैं, टैनिन में भिगो दिया जाता है, जिसमें नकारात्मक द्वारा युक्त कोलाइडल कण होते हैं, तो मिलनसारी झूल होती है। इस प्रक्रिया से चमड़ा मजबूत हो जाता है। इस प्रक्रिया को तनिकाई कहा जाता है। तनिन के स्थान पर क्रोमियम लवणों का भी उपयोग किया जाता है।
(न) साबुन और डिटर्जेंटों का सफाई कार्य: यह पहले से ही अनुभव में आ चुका है।
(प) फोटोग्राफिक प्लेटें और फ़िल्में: फोटोग्राफिक प्लेटें या फ़िल्में कांच की प्लेट या सेलुलॉइड फ़िल्म पर जेलेटिन के ऊपर प्रकाश संवेदक चांदी ब्रोमाइड का एक एमल्शन कोट करके तैयार की जाती है।
(य) रबर उद्योग: लैटेक्स एक कोलाइडल समाधान है जिसमें रबर कण होते हैं जो नकारात्मक द्वारा युक्त होते हैं। रबर लैटेक्स को यकृत करके रबर प्राप्त होता है।
(र) औद्योगिक उत्पाद: रंग, इंक, सिंथेटिक प्लास्टिक, रबर, ग्रेफाइट स्नेहक, सीमेंट आदि, सभी कोलाइडल समाधान हैं।
इनटेक्स्ट प्रश्न
5.7 आप किन्तुलन शुल्क में कोई सुधार की सुझाव दे सकते हैं?
5.8 इसकी मात्रानुमान के पहले उसे पानी से धोना क्यों आवश्यक है?
विज्ञापन एक पदार्थ के आणविकों को खींचने और ठहराने की प्रक्रिया है, जो कि कठोर की सतह पर बल किए बुल्क में सतह पर अधिक संघटन के परिणामस्वरूप होती है। ऐडसोरबट एडसोर्बेट के रूप में जाना जाता है और ऐडसोर्बेंट के रूप में जिस पर ऐडसोर्शन होती है उसे ऐडसोर्ब कहा जाता है। फाइसोर्प्शन में, ऐडसोर्बेट को मोमबैंडसी वैं देर वाल बलों द्वारा ऐडसोर्बेंट से जोड़ा जाता है और केमिसोर्प्शन में, ऐडसोर्बेट को मजबैंडसी रसायनिक संबंध द्वारा ऐडसोर्बेंट से जोड़ा जाता है। लगभग सभी पदार्थ गैस को ऐडसोर्ब करते हैं। पदार्थ पर गैस की ऐडसोर्प्शन की मात्रा गैस की प्रकृति, पदार्थ की प्रकृति, पदार्थ की सतह का क्षेत्र, गैस का दबाव और गैस का तापमान पर निर्भर करती है। एडसोर्प्शन की मात्रा (x / m) और गैस के दबाव के बीच संबंध जाने परांपरिक ताप पर ऐडसोर्प्शन वेतर के रूप में जाने जाते हैं।
एक कैटलिस्ट एक पदार्थ होता है जो एक रासायनिक प्रतिक्रिया की दर को बढ़ाता है बिना खुद रासायनिक प्रतिक्रिया में उपयोग किए जाने के साथ। कैटलिस्ट का इस्तेमाल की प्रक्रिया को “कैटल्रीस” कहा जाता है। समान अवस्था में कैटल्रस व्यावहारिक होते हैं, और असमान अवस्था में कैटल्रस के अवस्थान्तरलरस से।
कोलॉइडल विलयों सच्ची विलयों और सस्पेंसन्शन्स के बीच संबंधित हैं। जहा तक कोलॉइडल कणों का आकार हैं, वह 1 से 1000 नैनोमीटर तक होता है। एक कोलॉइडल प्रणाली में दो अवस्थाएं होती हैं - व्यवरण अवस्था और वितरण माध्यम। कोलॉइडल प्रणालियों को तीन तरीकों से वर्गीकृत किया जाता है जो वितरणी अवस्था और व्यवरण माध्यम के बीच के (i) सांद्रता तथा प्रविष्टि माध्यम की भौतिक स्थिति (ii) वितरणी अवस्था और व्यवरणी अवस्था के बीच की प्रक्रिया की प्रकृति और (iii) वितरणी अवस्था के कणों की प्रकृति के अनुसार होती हैं। कोलॉइडल प्रणालियों में दिखाई देते हैं मनोःकरणीय आपद्तियों, यांत्रिक और विद्युतीय गुणधर्म। वितरणी अवस्था में कोलासियों के कणों को दुष्प्रवाही के द्वारा अस्पष्टत में परिवर्तित करने का प्रक्रिया कोग्य्लेशन के रूप में जाना जाता है। इमलशन्स उन विसंगत प्रणालियों होते हैं जिनमें दोनों छितरांतर माध्य गतिप्रवाह अवस्था होती हैं। इन्मुल्सिकरमासन की प्रक्रिया इमल्सीफिकेशन्ट के रूप में जाना जाता है। एक इमल्सन को स्थिर करने के लिए, एक इमल्सिफाईग एजेंट या इमल्सिफाईयर को जोड़ा जाता है। साबुन और डिटर्जन्ट्स सबसे अधिक प्रयोग में लिए जाने वाले इमल्सिफाईर्स होते हैं। कोलोइड्स उद्योग और दैनिक जीवन में कई अनुप्रयोगों में प्रयोग होते हैं।
अभ्यास
5.1 ऐडसोर्प्शन और छान सदीनी अर्थ अलग करो। इन हर सदीनय का एक उदाहरण दो।
5.2 फाइसोर्प्शन और केमीसोर्प्शन के बीच में क्या अंतर है?
5.3 क्यों हल चिट्ठी को एडसोर्पन्ट के रूप में सकारात्मकतर होने पर कतिपयट कष के रूप में प्रभारक अचकनीय होता है?
5.4 क्या ऐडसोर्पन पर थोहरे गई गैस पर इस्तिता करने वालों एंकेणरथर में नकारा जाई हैं?
5.5 ऐडसोर्पन इसटथर्म क्या है? फ्रेउंद्लिच ऐडसोर्पन इसटथर्म का वर्चना करें।
5.6 क्या आप ऐडसोर्पन्त ऑफ़ ऐडसोर्पेंट समझते हैं? यह कैसे प्राप्त होता है?
5.7 असमानवस्था कैटल्रस्त्यासाल्त में ऐडसोर्पन्त ने कौन क्रोम निभाता है?
5.8 क्योंकि ऐडसोर्पन हमेशा उदधोम रिहाड़् होता है?
5.9 कोलोइडल विलयों को वित्तीय अवस्था और विलयक मध्य के भौतिक स्तर के आधार पर किस प्रकार वर्गीकृत किया जाता है?
5.10 तत्वों की विज्ञान के मुद्रा और तापमान पर गैसों के विज्ञान पर दबाव और तापमान के प्रभाव पर चर्चा करें।
5.11 लायोफिलिक और लायोफोबिक सूत्र क्या हैं? प्रत्येक प्रकार का एक उदाहरण दें। क्यों हाइड्रोफोबिक सूत्र सरलता से जमा हो जाते हैं?
5.12 बहुमोलेक्यूलर और मैक्रोमोलेक्यूलर कोलॉइड के बीच क्या अंतर है? प्रत्येक के एक उदाहरण दें। इन दोनों प्रकार के कोलॉइड से जुड़े कोलॉइड किन मापदंडों से भिन्न होते हैं?
5.13 एंजाइम क्या होते हैं? एंजाइम कैटलिसिस के कार्यान्वयन के संक्षेप में लिखें।
5.14 कोलोइड को किसी भी आधार पर किस प्रकार वर्गीकृत किया जाता है
(i) घटकों की भौतिक स्थिति के आधार पर
(ii) छित्रित चर और
(iii) छित्रिका कारक और विलय के बीच के प्रभाव के आधार पर?
5.15 समझाइए कि क्या देखा जाता है
(i) जब एक प्रकाश का तार कोलाइडल सोल के माध्यम से पारित होता है।
(ii) जब हाइड्रेटेड फेरिक ऑक्साइड्स सोल में एक इलेक्ट्रोलाइट,
(iii) कोलोइडी सूत्र में विद्युत्रेता चलाई जाती है?
5.16 इमल्शन क्या होती हैं? इनके विभिन्न प्रकार क्या होते हैं? प्रत्येक प्रकार का एक उदाहरण दें।
5.17 इमल्शिफायर कैसे इमल्शन को स्थिर बनाते हैं? दो इमल्शिफायरों का नाम बताएं।
5.18 साबुन का कार्य इमल्शन और मिसेल निर्माण के कारण होता है। टिप्पणी करें।
5.19 विषयवस्तु के चार उदाहरण दें विषम बहुलकमा।
5.20 कैटलिस्टों के गतिविधि और चयनशीलता क्या होती है?
5.21 जिओलाइट द्वारा माध्यम से कैटलिसिस के कुछ विशेषताओं का वर्णन करें।
5.22 क्या होती हैं आकार निर्दिष्ट कैटलिसिस?
5.23 निम्नलिखित शब्दों की व्याख्या करें: (i) इलेक्ट्रोफोरेसिस (ii) जमाव (iii)डायअलिसिस (iv) टाइंडल प्रभाव।
5.24 इमल्शन के चार उपयोग बताएं।
5.25 मिसेल क्या होती हैं? मिसेल प्रणाली का उदाहरण दें।
5.26 उपयुक्त उदाहरणों के साथ निम्नलिखित शब्दों की व्याख्या करें: (i) एल्कोसोल (ii) ऐरोसोल (iii) हाइड्रोसोल।
5.27 टिप्पणी करें कि “कोलॉइड एक पदार्थ नहीं है बल्कि पदार्थ की अवस्था है”।






