थर्मोडायनामिक्स एमडी
इकाई 6
थर्मोडायनामिक्स
I. बहुविकल्पी प्रश्न (प्रकार-I)
~~ 1. थर्मोडायनामिक्स के संबंध में यह स्पष्ट नहीं होता है।
(i) रासायनिक प्रतिक्रिया में शामिल होने वाले ऊर्जा परिवर्तन।
(ii) रासायनिक प्रतिक्रिया की मात्रा जिसमें प्राकृतिक होती है।
(iii) रासायनिक प्रतिक्रिया की गति।
(iv) रासायनिक प्रतिक्रिया की संभावना।
~~ 2. निम्नलिखित कथनों में से कौन सा सही है?
(i) आवरित उपकरण में प्रतिपादित होने वाले प्रतिक्रिया के उपस्थिति खुले प्रणाली का एक उदाहरण है।
(ii) एक संकीर्ण प्रणाली में प्रणाली और आसपास के बीच ऊर्जा और मादा का आतिरिक्ती होता है।
(iii) तांबे के एक संकीर्ण वास्त्र में प्रतिक्रियाओं की उपस्थिति एक संकीर्ण प्रणाली का एक उदाहरण है।
(iv) थर्मोस फ्लास्क या किसी अन्य संकीर्ण इतर वस्त्र में प्रतिक्रियाओं की उपस्थिति एक संकीर्ण प्रणाली का एक उदाहरण है।
~~ 3. एक गैस की स्थिति को दबाव, आयतन, तापमान के बिच के संबंध को दर्शा कर संकेतित किया जा सकता है।
(i) दबाव, आयतन, तापमान
(ii) तापमान, मात्रा, दबाव
(iii) मात्रा, आयतन, तापमान
(iv) दबाव, आयतन, तापमान, मात्रा
~~ 4. गैस की आयतन को आधे से कम कर दिया जाता है। विशिष्ट उष्णता होगी ——–।
(i) हो जाएगी।
(ii) दोगुनी हो जाएगी
(iii) स्थिर बने रहेंगी।
(iv) चार बार बढ़ जाएगा।
~~ 5. ब्यूटेन के एक मोल के पूर्ण दहन के दौरान, $2658 kJ$ ऊष्मागत होती है। ऊष्मागत प्रतिक्रिया ऊपर के परिवर्तन के लिए है
(i) $2 C_4 H_{10}(g)+13 O_2(g) \longrightarrow 8 CO_2(g)+10 H_2 O(l) \Delta_c H=-2658.0 kJ mol^{-1}$
(ii) $C_4 H_{10}(g)+\frac{13}{2} O_2(g) \longrightarrow 4 CO_2(g)+5 H_2 O(g) \Delta_c H=-1329.0 kJ mol^{-1}$
(iii) $C_4 H_{10}(g)+\frac{13}{2} O_2(g) \longrightarrow 4 CO_2(g)+5 H_2 O(l) \Delta_c H=-2658.0 kJ mol^{-1}$
(iv) $C_4 H_{10}(g)+\frac{13}{2} O_2(g) \longrightarrow 4 CO_2(g)+5 H_2 O(l) \Delta_c H=+2658.0 kJ mol^{-1}$
~~ 6. किसी निश्चित तापमान पर $CH_4(g)$ के गठन की $\Delta_f U^{\ominus}$ $-393 kJ mol^{-1}$ हैं। $\Delta_f H^{\ominus}$ का मान क्या है?
(i) शून्य
(ii) $<\Delta_f U^{\ominus}$
(iii) $>\Delta_f U^{\ominus}$
(iv) $\Delta_f U^{\ominus}$ के बराबर
~~ 7. एक अधिबाहिक प्रक्रिया में, प्रणाली और आसपास के बीच ऊष्मा का कोई संचार नहीं होता है। निम्नलिखित में से आपदा में एक आदर्श गैस की स्वतंत्र विस्तार के लिए सही विकल्प का चयन करें।
(i) $q=0, \Delta T \neq 0, w=0$
(ii) $q \neq 0, \Delta T=0, w=0$
(iii) $q=0, \Delta T=0, w=0$
(iv) $q=0, \Delta T<0, w \neq 0$
~~ 8. एक आदर्श गैस के लिए दबाव-आयतन कार्य व्यक्ति द्वारा उपयोग किए जाने वाले सूत्र $w=-\int {V_i}^{V_f} p{\text{ex }} d V$ से गणना की जा सकती है। कार्य छवि के तहत दी गई सीमाओं के अंतर्गत का निकाल भी किया जा सकता है। जब एक आदर्श गैस (a) पुनरावृत्ति द्वारा या (b) अपुनरावृत्ति द्वारा वास्तविक आयतन से घटाया जाता है. सही विकल्प का चयन करें।
(i) $w$ (पुनरावृत्ति) $=w$ (अपुनरावृत्ति)
(ii) $w$ (पुनरावृत्ति) $<w$ (अपुनरावृत्ति)
(iii) $w$ (पुनरावृत्ति) $>w$ (अपुनरावृत्ति)
(iv) $w$ (पुनर्वर्तनशील) $w$ (अपुनर्वर्तनशील) $+p _{एक्स} . \Delta V$
~~ 9. प्रवालनजाल माध्यम में पानी जमता है, तो नीचे दिए गए बयान में से सही कथन चुनें:
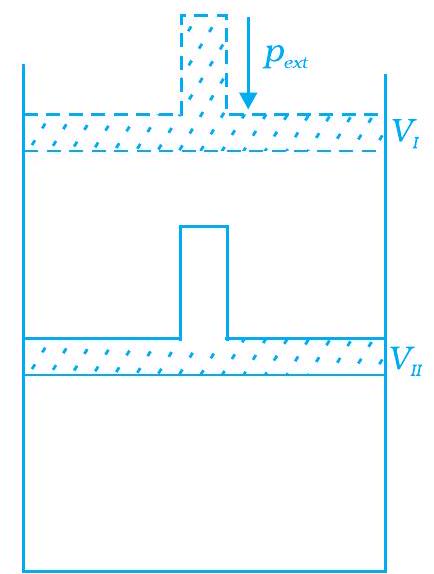
(i) $\quad \Delta S$ (प्रणाली) घटती है लेकिन $\Delta S$ (परिवेश) वही रहती है।
(ii) $\Delta S$ (प्रणाली) बढ़ती है लेकिन $\Delta S$ (परिवेश) कम होती है।
(iii) $\quad \Delta S$ (प्रणाली) घटती है लेकिन $\Delta S$ (परिवेश) बढ़ती है।
(iv) $\Delta S$ (प्रणाली) और $\Delta S$ (परिवेश) दोनों घटती हैं।
~~ 10. थर्मोकेमिकल समीकरण (a), (b) और (c) के आधार पर, निम्नलिखित विकल्पों (i) से (iv) में से कौन सा बयान सही है?
(a) $C$ (ग्रेफाइट) $+O_2$ (गैस) $\longrightarrow CO_2(गैस) ; \Delta_r H=x kJ mol^{-1}$
(b) $\quad C$ (ग्रेफाइट) $+\frac{1}{2} O_2(गैस) \longrightarrow CO(गैस) ; \Delta_r H=y kJ mol^{-1}$
(c) $CO(गैस)+\frac{1}{2} O_2(गैस) \longrightarrow CO_2(गैस) ; \Delta_r H=z kJ mol^{-1}$
(i) $z=x+y$
(ii) $x=y-z$
(iii) $x=y+z$
(iv) $y=2 z-x$
~~ 11. नीचे दिए गए प्रतिक्रियाओं के आधार पर, निम्नलिखित विकल्पों (i) से (iv) में से कौन सा बयान सही है?
(a) $C(गैस)+4 H(गैस) \longrightarrow CH_4(गैस) ; \Delta_r H=x kJ mol^{-1}$
(b) $C$ (ग्रेफाइट, solid) $+2 H_2(गैस) \longrightarrow CH_4(गैस) ; \Delta_r H=y kJ mol^{-1}$
(i) $x=y$
(ii) $x=2 y$
(iii) $x>y$
(iv) $x<y$
~~ 12. प्राकृतिक अवस्था में तत्वों का उत्पादन का उष्णता को शून्य के रूप में लिया जाता है। एक यौगिक के गठन की ऊष्णता
(i) हमेशा नकारात्मक होती है
(ii) हमेशा सकारात्मक होती है
(iii) सकारात्मक या नकारात्मक हो सकती है
(iv) कभी नकारात्मक नहीं होती
~~ 13. किसी पदार्थ के उद्धरण की ऊष्मा संत्कर्षक इकाई के बराबर होती है
(i) पिघलन की ऊष्मा + वाष्पीकरण की ऊष्मा
(ii) पिघलन की ऊष्मा
(iii) वाष्पीकरण की ऊष्मा
(iv) ऊष्मा की ऊष्मा के दोगुना
~~ 14. निम्नलिखित में से कौन सही नहीं है?
(i) $\quad \Delta G$ एक पुनर्वत्ती प्रतिक्रिया के लिए शून्य होती है
(ii) $\Delta G$ एक स्वेच्छिक प्रतिक्रिया के लिए सकारात्मक होती है
(iii) $\Delta G$ एक स्वेच्छिक प्रतिक्रिया के लिए नकारात्मक होती है
(iv) $\Delta G$ एक स्वेच्छिक प्रतिक्रिया के लिए सकारात्मक होती है
II. बहुविकल्पी प्रश्न (प्रकार-II)
निम्नलिखित प्रश्नों में दो या दो से अधिक विकल्प सही हो सकते हैं।
~~ 15. थर्मोडायनामिक्स मुख्य रूप से इस पर ध्यान देती है
(i) प्राकृतिक ऊर्जा के विभिन्न रूपों के आपसी संबंध और उनके रूपों के परिवर्तन से
(ii) कुछ कीटाणुओं युक्त माइक्रोस्कोपिक प्रणालियों में प्रारंभिक और अंतिम स्थितियों पर केवल निर्भर होने वाली प्रक्रियाओं में ऊर्जा परिवर्तन।
(iii) ये ऊर्जा परिवर्तन कैसे होते हैं और किस दर पर कार्यान्वित होते हैं।
(iv) प्राणी की स्थिर स्थिति या एक स्थिर स्थिति से दूसरी स्थिर स्थिति में चल रहे प्रणाली पर।
~~ 16. एक प्रज्वलनिक प्रतिक्रिया में, ऊष्मा उत्पन्न होती है, और प्रणाली पर्यावरण में उष्णता हानि करती है। इस प्रकार की प्रणाली के लिए
(i) $q_p$ नकारात्मक होगी
(ii) $\Delta_r H$ नकारात्मक होगी
(iii) $q_p$ सकारात्मक होगी
(iv) $\Delta_r H$ सकारात्मक होगी
~~
17. यह spontaneity का अर्थ है, बिना बाह्य मदद के आगे बढ़ने की संभावना होना। स्वतः होने वाले प्रक्रियाएँ हैं
(i) ठंडे शरीर से गर्म शरीर में ऊष्मा का प्रवाह।
(ii) एक कंटेनर में गैस एक कोने में संकुचित हो जाती है।
(iii) योग्य आंतरिक आयतन में गैस फैलना।
(iv) ऑक्सीजन में कार्बन को जलाकर कार्बन डायऑक्साइड देना।
~~ 18. एक आदर्श गैस के लिए, समान्य विस्तार का पुनरावर्ती कार्य, उष्णता स्थिति के तहत निम्न अभिव्यक्ति का उपयोग करके हिसाब लगाया जा सकता है $ डब्ल्यू = -nRT \ln \frac{V_f}{V_i}$
71 ऊष्मिकीता
एक आदर्श गैस के $1.0 मोल$ की सैंपल को द्वितीय अनुभवों में उष्णता सीमित रहते हुए और प्रतिस्थापनीय रूप से दस गुना अपने मूल आयतन का विस्तार किया जाता है। विस्तार को $300 K$ और $600 K$ में किया जाता है। सही विकल्प चुनें।
(i) $600 K$ पर किया गया कार्य $300 K$ पर किये गए कार्य का 20 गुना है।
(ii) $300 K$ पर किया गया कार्य $600 K$ पर किये गए कार्य का दोगुना है।
(iii) $600 K$ पर किया गया कार्य $300 K$ पर किये गए कार्य का दोगुना है।
(iv) दोनों केस में $\Delta U=0$ है।
~~ 19. जिंक और ऑक्सीजन के बीच निम्नलिखित प्रतिक्रिया का विचार करें और दिए गए विकल्पों में से सही विकल्प चुनें:
$2 Zn(s)+O_2(g) \longrightarrow 2 ZnO(s) ; \quad \Delta H=-693.8 kJ mol^{-1}$
(i) $ZnO$ के दो मोल की ऊष्मा दो मोल $Zn$ और एक मोल ऑक्सीजन की कुल ऊष्मा से $693.8 kJ$ कम होती है।
(ii) $ZnO$ के दो मोल की ऊष्मा दो मोल $Zn$ और एक मोल ऑक्सीजन की कुल ऊष्मा से $693.8 kJ$ अधिक होती है।
(iii) प्रतिक्रिया में $693.8 kJ mol^{-1}$ ऊर्जा उत्पन्न होती है।
(iv) प्रतिक्रिया में $693.8 kJ mol^{-1}$ ऊर्जा शोषित होती है।
III. Short Answer Type
~~ 20. $18.0 g$ पानी का पूर्णतः वाष्पीकरण $100^{\circ} C$ और 1 bar दबाव पर होता है और इस प्रक्रिया में उष्मा परिवर्तन $40.79 kJ mol^{-1}$ होता है। उसी स्थिति में दो मोल पानी का वाष्पीकरण का उष्मा परिवर्तन क्या होगा? पानी के लिए मानक ऊष्मा परिवर्तन क्या है?
~~ 21. एसिटोन के एक मोल की तुलना में पानी के $1 mol$ को बाष्पीकरण के लिए कम ऊष्मा की आवश्यकता होती है। दोनों तरलों में कौन सा तरल बाष्पीकरण की ऊष्मा में अधिक है?
~~ 22. मानक मोलार ताप, $\Delta_f H^{\ominus}$ मूल क्रिया की केवल एक विशेष विधि है, $\Delta_r H^{\ominus}$ क्रिया की ऊष्मा। क्या निम्नलिखित प्रतिक्रिया के लिए $\Delta_r H^{\ominus}$ $\Delta_f H^{\ominus}$ के बराबर है? अपने उत्तर के लिए कारण दें।
$CaO(s)+CO_2(g) \to CaCO_3(s) ; \quad \Delta_f H^{\ominus}=-178.3 kJ mol^{-1}$
~~ 23. $NH_3$ के लिए $\Delta_f H^{\ominus}$ की मान $-91.8 kJ mol^{-1}$ है। निम्नलिखित प्रतिक्रिया के लिए ऊष्मा परिवर्तन की गणना करें:
$2 NH_3(g) \to N_2(g)+3 H_2(g)$
~~
24. एमॉल्यू एक व्यापक गुण है। सामान्यतया, एक समग्र प्रतिक्रिया $ए \to ब$ की मूल रासायनिकता $\Delta_r H$ और $\Delta_r H_1, \Delta_r H_2, \Delta_r H_3 \ldots$। मध्यवर्ती प्रतिक्रियाओं की रासायनिकता को प्रतिष्ठान वाले बताती है जो उत्पाद $ब$ तक पहुंचने में मध्यवर्ती होती हैं। एक समग्र प्रतिक्रिया की रासायनिकता $\Delta_r H$ और मध्यवर्ती प्रतिक्रियाओं के लिए $\Delta_r H_1, \Delta_r H_2 \ldots$ इत्यादि के बीच संबंध क्या होगा।
~~ 25. अभिक्रिया $CH_4(g) \to C(g)+4 H(g)$ के लिए अण्वीकरण की एमॉल्यू $1665 kJ mol^{-1}$ है। $C-H$ बांध की बॉन्ड ऊर्जा क्या होगी?
~~ 26. $NaBr$ के लिए $\Delta _{\text{ग्रंथ }} H^{\ominus}$ की गणना करने के लिए निम्न आंकड़े का उपयोग करें।
सोडियम धातु के लिए $\Delta _{\text{लघ्व }} H^{\ominus}=108.4 kJ mol^{-1}$
सोडियम का आयनन एमॉल्यू=496 kJ mol^{-1}$
ब्रोमीन का चुंबकीय प्राप्ति एमॉल्यू= -325 kJ mol^{-1}$
ब्रोमीन की बांध टुटने की एमॉल्यू=192 kJ mol^{-1}$
$NaBr(s)$ के लिए $\Delta_f H^{\ominus}=-360.1 kJ mol^{-1}$
~~ 27. दिए गए हैं कि मिश्रण के लिए $\Delta H=0$। सम्पूर्ण कंटेनर में इन गैसों का प्रसारण प्रक्रिया स्वतः होने वाली प्रक्रिया है या नहीं? स्पष्ट करें।
~~ 28. ऊष्मा सामग्री पर एक यादृच्छिक प्रभाव रखती है और तापमान सामग्री में कणों की औसत संकटात्मक गतिविधि का माप है। इन तीन पैरामीटरों के बीच संबंध स्थापित करने वाला गणितीय संबंध लिखें।
~~ 29. परिवेश की एन्थैल्पी में बढ़ोतरी क्षेत्र के नष्ट होने के समान है। क्या प्रणाली और परिवेश का तापमान समान होगा जब वे तापीय संतुलन में हों?
~~ 30. $298 K$ में, $K_p$ अभिक्रिया $N_2 O_4(g) \rightarrow 2 NO_2(g)$ के लिए 0.98 है। यह अभिक्रिया क्या स्वतः होने वाली है या नहीं।
~~ 31. एक $1.0 mol$ का एक एकात्मक आदर्श गैस नमूना तालनिका प्रक्रिया के माध्यम से लिया जाता है, जैसा कि चित्र 6.1 में दिखाया गया है। सामूहिक रूप से चक्र के लिए $\Delta H$ क्या होगा?

चित्र: 6.1
~~ 32. $H_2 O(l)$ का मानक मोलार अण्डास्थलीय स्वेदन यादृच्छिक स्थानिक $70 J K^{-1} mol^{-1}$ है। $H_2 O(s)$ का मानक मोलार अण्डास्थलीय स्वेदन $70 J K^{-1} mol^{-1}$ से अधिक होगा, या कम होगा?
~~ 33. निम्नलिखित में से राज्य कार्य और पथ कार्यों की पहचान करें: उत्थान, अण्डास्थलीयता, ऊष्मा, तापमान, कार्य, मुक्त ऊर्जा।
~~ 34. एसिटोन की मोलर एन्थैल्पी वाष्पीकरण जल की मोलर एन्थैल्पी से कम होती है। इसका कारण क्या है?
~~ 35. संतुलन पर $\Delta_r G$ और $\Delta_r G^{\ominus}$ में से कौनसा मात्रा शून्य होगा?
~~ 36. एक एकात्मक प्रक्रिया में एक अलग विद्यमान के लिए आंतरिक ऊर्जा में परिवर्तन की भविष्यवाणी करें
~~ 37. हालांकि ऊष्मा एक पथ कार्य है, लेकिन विशेष निश्चित स्थितियों के तहत प्रणाली द्वारा अवशोषित ऊष्मा पथ के अनिर्देशित होने से अविपरीत होती है। वह स्थितियाँ क्या हैं? स्पष्ट करें।
~~
कंटेंट का हिंदी संस्करण:
38. एक वाक्यूम में एक गैस का विस्तार मुक्त विस्तार कहलाता है। जब एक आदर्श गैस का 1 लीटर विस्तार करता है और वास्तविक आयाम 5 लीटर होता है, तो कार्य और आंतरिक ऊर्जा में परिवर्तन की गणना करें।
~~ 39. उष्णता क्षमता (Cp) एक घनत्विक संपत्ति है लेकिन विशिष्ट उष्णता (c) एक तत्कालीन संपत्ति है। एक मोल पानी के लिए Cp और c के बीच क्या संबंध होगा?
~~ 40. संख्या $H=U+p V$ का उपयोग करके $C_P$ और $C_V$ के बीच का अंतर की गणना करें। एक आदर्श गैस के 10 मोल के लिए $C_P$ और $C_V$ के बीच का अंतर की गणना करें।
~~ 41. यदि $1 g$ ग्रेफाइट की जलन के कारण $20.7 kJ$ उत्पन्न होती है, तो मोलार ऊष्मागमन क्या होगा? चिह्न की महत्व भी दें।
~~ 42. एक प्रतिक्रिया के लिए नेट ऊष्मागमन परिवर्तन, प्रतिक्रिया के पदार्थों में सभी बंधों को टूटाने के लिए आवश्यक ऊर्जा की मात्रा मिनस उत्पन्न पदार्थों में सभी बंधों के निर्माण के लिए ऊर्जा की मात्रा को दिया जाता है। निम्नलिखित प्रतिक्रिया के लिए ऊष्मागमन परिवर्तन क्या होगा।
$H_2(g)+Br_2(g) \to 2 HBr(g)$
दिया गया है कि $H_2, Br_2$ और $HBr$ का बंध ऊर्जा $435 kJ mol^{-1}, 192 kJ mol^{-1}$ और $368 kJ mol^{-1}$ आवेदित है।
~~ 43. $CCl_4$ का वाष्पीकरण ऊष्मागमन $30.5 kJ mol^{-1}$ है। नियंत्रण दबाव में $284 g$ $CCl_4$ के वाष्पीकरण के लिए आवश्यक ऊष्मागमन की गणना करें। ($CCl_4$ का मूलर Molar मास $=154 g mol^{-1}$ है)।
~~ 44. प्रतिक्रिया के लिए ऊष्मागमन परिवर्तन:
$2 H_2(g)+O_2(g) \to 2 H_2 O(l)$ जब $\Delta_r H^{\ominus}=-572 kJ mol^{-1}$ है।
$H_2 O(l)$ की मानक ऊष्मागमन प्रकृति क्या होगी?
~~ 45. जब एक सिलेंडर में बंद एक आदर्श गैस को एक स्थिर बाह्य दबाव, $ p _ {\text {ext}}$ द्वारा एक ही कदम में संपीड़ित किया जाता है, तो कितना काम किया जाएगा? चित्र 6.2 में तथ्यरूप से समझाएं।
~~ 46. अपारतंत कदमों में दबाव में परिवर्तन करते समय एक आदर्श गैस पर किया गया कार्य कैसे गणना किया जाएगा?
~~ 47. इसके ग्राफिकल रूप में बिंदु ऊर्जा / ऊष्मा परिवर्तन का प्रतिनिधित्व करें
चित्र : 6.2 निम्नलिखित प्रक्रियाओं में से किसमें बिंदु ऊर्जा / ऊष्मा परिवर्तन स्वतंत्रता कारक है?
(a) जमीन से छत तक पत्थर को चालू करना।
(b) $\frac{1}{2} H_2(g)+\frac{1}{2} Cl_2(g) \rightarrow HCl(g) \quad \Delta_r H^{\ominus}=-92.32 kJ mol^{-1}$
~~ 48. एक विशेष प्रतिक्रिया के लिए ऊष्मागमन आरंभिक चित्र चित्र 6.3 में दिया गया है। क्या इस दिए गए आरंभिक चित्र से किसी प्रतिक्रिया की स्वतंत्रता का निर्णय किया जा सकता है। समझाएं।
~~ 49. एक मोनोआणु आदर्श गैस का 1.0 मोल राज्य (1) से राज्य (2) तक विस्तार किया जाता है, जैसा कि चित्र 6.4 में दिखाया गया है। स्थिति (1) से स्थिति (2) तक गैस के विस्तार के लिए कार्य किया जाता है, $298 K$ पर कार्य किया जाता है।
50. एक आदर्श गैस को $10 L$ से $50 L$ तक निरंश प्रेसर के खिलाफ एक बार में स्थिर दबाव 2 बार के बराबर बढ़ा दिया जा रहा है। गैस द्वारा किया गया कार्य की मात्रा की गणना करें। यदि एक ही विस्तार को पुनरावर्ती रूप से कराया जाता हो, तो क्या पहले के मुकाबले कार्य की मात्रा अधिक या कम होगी?
(दिया गया है कि $1 L$ बार $=100 J$ )
चित्र : 6.3

चित्र : 6.4
IV जोड़ने वाली प्रकार
निम्नलिखित प्रश्नों में दोनों स्तंभों के विकल्पों के बीच अधिक से अधिक संरेखण संभव है।
~~ 51. निम्नलिखित को मिलाएँ :
| A | B |
|---|---|
| (i) आदिबेर्मक कार्रवाई | (a) ऊष्मा |
| (ii) अपरिहर्ति प्रणाली | (b) स्थिर मात्रा में |
| (iii) ऊष्मीय परिवर्तन | (c) ऊष्मा का अदान-प्रदान नहीं |
| (iv) पथ-संकेतांक | (d) ऊष्मीय ऊर्जा का संरक्षण का नियम |
| (v) स्थिति-प्रोद्योतक | (e) तापमान के कारणबद्ध |
| (vi) $\Delta U=q$ | (f) स्थैतिक तापमान |
| (vii) ऊर्जा संरक्षण का नियम | (g) आंतरिक ऊर्जा। |
| (viii) पुनर्व्याप्तियोंकरण प्रक्रिया | (h) $p _{\text{ext }}=0$ |
| (ix) मुक्त विस्तार | (i) स्थिर दबाव में |
| (x) $\Delta H=q$ | (j) असीमित धीमी प्रक्रिया जो |
| संतुलन स्थितियों के एक सिरीज से | |
| आगे बढ़ती है। | |
| (xi) प्रतिस्थैतिक गुण. | (k) अन्तःप्रभाव |
| (xii) व्यापक गुण | (l) दबाव |
| (m) विशिष्ट ऊष्मा |
~~ 52. निम्नलिखित प्रक्रियाओं को एंट्रोपी परिवर्तन के साथ मिलाएँ:
| प्रतिक्रिया | एंट्रोपी परिवर्तन |
|---|---|
| (i) एक तरल पारणा हो जाता है | (a) $\Delta S=0$ |
| (ii) प्रतिक्रिया सभी तापमानों पर अस्वतन्त्र है | |
| और $\Delta H$ सकारात्मक है | (b) $\Delta S=$ सकारात्मक |
| (iii) आदर्श गैस का पुनर्व्यापक विस्तार | (c) $\Delta S=$ नकारात्मक |
~~ 53. फिटबंदी के लिए निम्नलिखित पैरामीटरों को विवरण के साथ मिलाएँ :
| — | $\Delta$ (पैरामीटरेज) | — | — | विवरण |
|---|---|---|---|---|
| — | $\Delta_r H^{\ominus}$ | $\Delta_r \mathbf{S}^{\ominus}$ | $\Delta_r G^{\ominus}$ | — |
| (i) | + | - | + | (a) उच्च तापमान पर अस्पंतामित |
| (ii) | - | - | उच्च तापमान पर + | (b) सभी तापमानों में स्वतःपन |
| (iii) | - | + | - | (c) सभी तापमानों पर अस्पंतामित |
~~ 54. निम्नलिखित को मिलाएँ:
| (i) वाष्पीकरण की एंट्रोपी | (a) कम होती है |
|---|---|
| (ii) स्वतःपन प्रक्रिया के लिए $K$ | (b) हमेशा सकारात्मक होता है |
| (iii) बर्फीय स्थिति | (c) सबसे कम एंट्रोपी |
| (iv) आदिबेर्मक प्रकाशन में $\Delta U$ | (d) $\frac{\Delta H_{\text{vap }}}{T_b}$ |
V. दावा और कारण प्रकार
निम्नलिखित प्रश्नों में दावा (A) का कथन और कारण (R) का कथन दिया गया है। मैं क्या सही है विकल्प का चयन करें।
~~ 55. दावा (A): सभी कार्बनिक यौगिकों का दहन एक ऊर्जामान उत्पन्न क्रिया है।
कारण (R) : सभी मानक स्थिति में पाए जाने वाले सभी तत्वों की उसकी उन्नति के निरेश शून्य होते हैं।
(i) दोनों $A$ और $R$ सत्य हैं और $R$ $A$ का सही स्पष्टीकरण है।
(ii) दोनों $A$ और $R$ सत्य हैं लेकिन $R$ $A$ का सही स्पष्टीकरण नहीं है।
(iii) $ए$ सही होता है, लेकिन $आर$ गलत होता है।
(iv) $ए$ गलत होता है, लेकिन $आर$ सही होता है।
~~ 56. अभिकथन (ए) : स्वाभाविक प्रक्रिया एक अअपलयनीय प्रक्रिया है और किसी बाह्य एजेंसी द्वारा उल्टा किया जा सकता है।
कारण (आर): औष्मिकी में छूट को स्वाभावितता का एक योगदानी हांसिदर्शि है।
(i) दोनों $ए$ और $आर$ सही होते हैं और $आर$ $ए$ का सही व्याख्यान है।
(ii) दोनों $ए$ और $आर$ सही होते हैं, लेकिन $आर$ $ए$ का गलत व्याख्यान है।
(iii) $ए$ सही होता है, लेकिन $आर$ गलत होता है।
(iv) $ए$ गलत होता है, लेकिन $आर$ सही होता है।
~~ 57. यथार्थवाद (ए): एक तरल एक कठोर रूप में स्थानान्तरित होता है और एंट्रोपी में घटने के साथ साथ होता है।
कारण (आर): मस्तिष्क में मोलेक्यूल एक व्यवस्थित तरीके से संगठित होती है।
(i) दोनों $ए$ और $आर$ सही होते हैं और $आर$ $ए$ का सही व्याख्यान है।
(ii) दोनों $ए$ और $आर$ सही होते हैं, लेकिन $आर$ $ए$ का गलत व्याख्यान है।
(iii) $ए$ सही होता है, लेकिन $आर$ गलत होता है।
(iv) $ए$ गलत होता है, लेकिन $आर$ सही होता है।
VI. लैंग उत्तर प्रकार
~~ 58. एक आदर्श गैस के लिए $\Delta H$ और $\Delta U$ के बीच संबंध प्राप्त करें। समीकरण में शामिल हर शब्द को समझाएं।
~~ 59. व्यापक गुण पदार्थ की मात्रा पर निर्भर करते हैं, लेकिन Tight सवरूपों के बारे में नहीं। विस्तारशील और घनत्व के आधार पर निम्नलिखित गुणों को व्यापक या घनत्व कहा जाता है।
मास, आंतरिक ऊर्जा, दबाव, तापमान, गर्मी धार, घनत्व, मोल अनुपात, विशेष ऊष्मा, धारिता और molarity.
~~ 60. एक आयनिक यौगिक की जाल ऊष्मीय होती है, जब एक मोल आयनिक यौगिक प्रतिनिधित्व में परिह्राणित होकर उसके आयों में विच्छेदित हो जाता है। इसे प्रयोग द्वारा सीधे निर्धारित करना असंभव होता है। $NaCl(s)$ की ग्रिड सुखावत (lattice enthalpy) को मापने के लिए एक नियमित तरीका सुझाएं और समझाएं।
~~ 61. $\Delta G$ मुख्यतः उपयोगी कार्य करने के लिए उपलब्ध ऊर्जा है और इसलिए “मुक्त ऊर्जा” का एक माप है। सांख्यिकीय रूप से दिखाएं कि $\Delta G$ एक मुक्त ऊर्जा का माप है। $\Delta G$ की इकाई खोजें। यदि किसी प्रक्रिया में सकारात्मक औष्मिकी परिवर्तन और सकारात्मक एंट्रोपी परिवर्तन होते हैं, तो प्रक्रिया होती रहेगी कि माप के तहत कैसी होगी?
~~ 62. यदि एक आदर्श गैस की स्थिति $(p_i, V_i)$ से $(p_f, V_f)$ की ओर पुनर्वर्ती और तापयान्त्रिक रूप से परिवर्तन होता है, तो विस्तृत में कुल कार्यजारी हो रहा काम दिखाएं। $(p_i, V_i)$ से $(p_f, V_f)$ तक के मामले में काम कुल काम के साथ तुलना करने के लिए $p V$ चित्र की सहायता से।
उत्तर
I. Multiple Choice Questions (आकार-I)
~~ 1. (iii)
~~ 2. (iii)
~~ 3. (iv)
~~ 4. (iii)
~~ 5. (iii)
~~ 6. (ii)
~~ 7. (iii)
आधारित कारण: स्वतंत्र विस्तार $\quad w=0$
आद्यापक प्रक्रिया $q=0$
$\Delta U=q+w=0$, इसका मतलब है कि आंतरिक ऊर्जा स्थिर रहती है। इसलिए, $\Delta T=0$।
आदर्श गैस में कोई आंतरमोलकिक आकर्षण नहीं होती है। इसलिए, जब ऐसा गैस ऋणात्मक ऊर्जा के साथ एक वैउम में विस्तार करता है, तो कोई ऊष्मा संश्लेषण या निर्गमन नहीं होता है क्योंकि मोलेक्यूलों को अलग करने के लिए कोई बाह्य काम नहीं किया जाता है।
~~ 8. (ii) $w$ (विपरीतार्थक) $<w$ (अविपरीतार्थक)
उचितता: कवर के नीचे क्षेत्र हमेशा अविलंबी संपीड़न में अधिक होता है, जैसा कि चित्र 6.5 (a) और (b) से देखा जा सकता है।

(a) प्रतिलोमी संपीड़न

(b) अविलंबी संपीड़न
चित्र : 6.5
~~ 9. (iii)
उचितता: जमना एक उत्सर्जनात्मक प्रक्रिया है। उत्सर्जित हुई ऊष्मा पर्यावरण का एंट्रापी बढ़ा देती है।
~~ 10. (iii)
~~ 11. (iii)
उचितता: प्रतिक्रिया (a) और (b) में समान बांध बनते हैं, लेकिन प्रतिक्रिया (b) में केवल प्रतिक्रियाशीलक अणुओं के बीच बंध टूटते हैं।
~~ 12. (iii)
~~ 13. (i)
~~ 14. (ii)
II. बहुविकल्पी प्रश्न (किसी प्रकार-II)
~~ 15. (i), (iv)
~~ 16. (i), (ii)
~~ 17. (iii), (iv)
~~ 18. (iii), (iv)
उचितता: $\frac{w _{600 K}}{w _{\text{जॉय }}}=\frac{1 \times R \times 600 K \ln \frac{10}{1}}{1 \times R \times 300 K \ln \frac{10}{1}}=\frac{600}{300}=2$
आदर्श गैसों के आवर्तीय प्रवर्धन के लिए, $\Delta U=0$
चूँकि तापमान स्थायी है इसका मतलब है कि आंतरिक ऊर्जा में कोई परिवर्तन नहीं हुआ है।
इसलिए, $\Delta U=0$
~~ 19. (i), (iii)
III. संक्षेप उत्तर किसंख्या
~~ 20. $\quad+81.58 kJ, \Delta _{\text{लचक}} H^{\ominus}=+40.79 kJ mol^{-1}$
~~ 21. पानी
~~ 22. नहीं, क्योंकि $CaCO_3$ किसी अन्य यौगिकों से बनता है और नहीं अपने तत्त्वीय तत्वों से।
~~ 23. $\Delta_r H^{\ominus}=+91.8 kJ mol^{-1}$
~~ 24. $\Delta_r H=\Delta_r H_1+\Delta_r H_2+\Delta_r H_3 \ldots$.
~~ 25. $\frac{1665}{4} kJ mol^{-1}=416.2 kJ mol^{-1}$
~~ 26. $\quad+735.5 kJ mol^{-1}$
~~ 27. यह स्वतः होती है प्रक्रिया। हालांकि, ऊष्मीय परिवर्तन शून्य है, लेकिन यापन या व्यवस्था (अर्थात, $\Delta S$ ) में वृद्धि होती है। इसलिए, समीकरण $\Delta G=\Delta H-T \Delta S$, शब्द $T \Delta S$ नकारात्मक होगा। इसलिए, $\Delta G$ नकारात्मक होगा।
~~ 28. $\Delta S=\frac{q _{\text{पुन }:}}{T}$
~~ 29. हाँ
~~ 30. प्रतिक्रिया स्वतः होती है
$\Delta_r G^{\ominus}=-R T \ln K_p$
~~ 31. $\Delta H($ चक्र $)=0$
~~ 32. कम, क्योंकि बर्फ पानीसे कई क्रमशः है। ~~ 33. अवस्था कारक: उष्मा, आंतरिकता, तापमान, मुक्ति ऊर्जा पथ कारक: ऊष्मा, काम
~~ 34. पानी में मजबूत हाइड्रोजन बांधन के कारण, इसका वाष्पकरणे का उष्मा अधिक होता है।
~~ 35. $\Delta_r G$ हमेशा शून्य होगा।
$\Delta_r G^{\ominus}$ के लिए $K=1$ कियाने $\Delta G^{\ominus}=-RT \ln K$, $\Delta G^{\ominus}$ अन्य मानों के लिए शून्य होगा।
~~ 36. निर्देशित प्रणाली के लिए, ऊष्मा या काम के रूप में कोई ऊर्जा प्रसारित नहीं किया जाता है अर्थात, $w=0$ और $q=0$। थर्मोडायनामिक्स के पहले सूत्र के अनुसार।
$ \begin{aligned} \Delta U & =q+w \\ & =0+0=0 \\ \therefore \quad \Delta U & =0 \end{aligned} $ ~~ 37. स्थिर मात्रा में
पहले थर्मोडायनामिक्स के सूत्र के अनुसार:
$ \begin{aligned} q & =\Delta U+(-w) \\
जावास्क्रिप्ट का विमान नव-वर्गीकरण ऍँड जी एल टी एस
content: 
(a)

(b)
Fig. : 6.8 गतििशीलता बदलना प्रक्रियाओं में (a) और (b)
~~ 48. नहीं।
गतिशीलता निर्धारित करने में उदात्तता एक योगदानकारी कारक है लेकिन यह केवल कारक नहीं है। सही परिणाम प्राप्त करने के लिए एक और कारक, यानी एंट्रोपी की योगदान को भी देखना चाहिए।
~~ 49. चित्र से स्पष्ट है कि प्रक्रिया को अनंत कदमों में किया गया है, इसलिए यह तापमान अवरोही विस्तार है।
$w=-2.303 n R T \log \frac{V_2}{V_1}$
लेकिन, $p_1 V_1=p_2 V_2 \Rightarrow \frac{V_2}{V_1}=\frac{p_1}{p_2}=\frac{2}{1}=2$
$ \begin{aligned} इसलिए,\quad w & =-2.303 nRT \log \frac{p_1}{p_2} \\ & =-2.303 \times 1 mol \times 8.314 J mol^{-1} K^{-1} \times 298 K^{-1} \times \log 2 \\ & =-2.303 \times 8.314 \times 298 \times 0.3010 J=-1717.46 J \end{aligned} $
~~ 50. $w=-p _{ex}(V_f-V_i)=-2 \times 40=-80 L$ bar $=-8 kJ$
नकारात्मक चिह्न प्रदर्शित करता है कि प्रणाली द्वारा पर्यावरण पर कार्य किया गया है। कार्य केवलविद्युत्तीर्ण विस्तार में अधिक किया जाएगा क्योंकि आंतरिक दबाव और बाहरी दबाव हर कदम पर लगभग समान होते हैं।
चतुर्थ मिलान प्रकार
~~ 51. (i) $\to$ (e) $\quad$ (ii) $\to$ (d) $\quad$ (iii) $\to$ (f) $\quad$ (iv) $\to$ (a)
(v)$\to$(g),(k),(l) $\quad$ (vi) $\to$ (b) $\quad$ (vii) $\to$ (c) $\quad$ (viii) $\to$(j)
(ix) $\to$ (h) $\quad$ (x)$\to$(i) $\quad$ (xi) $\to$(a),(1),(m) $\quad$ (xii)$\to$(g),(k)
~~ 52. (i) $\to$ (b) $\quad$ (ii) $\to$ (c) $\quad$ (iii) $\to$ (a)
~~ 53. (i) $\to$ (c) $\quad$ (ii) $\to$ (a) $\quad$ (iii) $\to$ (b)
~~ 54. (i) $\to$ (b), (d) $\quad$ (ii) $\r\to$ (b) $\quad$ (iii) $\to$ (c) $\quad$ (iv) $\to$ (a)
व. दावा और कारण प्रकार
~~ 55. (ii)
~~ 56. (ii)
~~ 57. (i)
व. लंबे उत्तर प्रकार
~~ 59. संकेत: दो व्यापक गुणों का अनुपात हमेशा उदासीनी होता है $\frac{\text{ व्यापक }}{\text{ व्यापक }}=$ उदासीनी।
उदाहरण के लिए, एकांत संख्या $=\frac{\text{ मोल }}{\text{ कुल मोल की संख्या }}=\frac{(\text{ व्यापक })}{(\text{ व्यापक })}$
~~ 60. $-Na(s)+\frac{1}{2} Cl_2(g) \to Na^{+}(g)+Cl^{-}(g) ; \quad \Delta _{\text{lattice }} H^{\ominus}$
- बोन - हेबर साइकिल
- बोन - हेबर साइकिल से ज्ञात करने के लिए कदाचित् होता है
- सोडियम धातु का सब्लिमेशन
(1) $Na$ (s) $arrow Na$ (g); $\quad \Delta _{\text{sub }} H^{\ominus}$
(2) सोडियम परमाणुओं का इयनीकरण
$ Na(g) \to Na^{+}(g)+e^{-}(g) ; \quad \Delta_t H^{\ominus} \text{ यानी, इयनीकरण उष्णता } $
(3) क्लोरीन मोलेक्यूल का विघटन
$ \begin{gathered} \frac{1}{2} Cl_2(g) \to Cl(g) ; \quad \frac{1}{2} \Delta _{\text{bond }} H^{\ominus} \quad \text{ यानी, } \\ \text{बांध विघटन के आधा हिस्सा} \end{gathered} $
(४) $Cl(g)+e^{-}(g) \to Cl^{-}(g) ; \quad \Delta _{eg} H^{\ominus}$ यानी, इलेक्ट्रॉन लाभ उष्मा।

~~ 61. $\Delta S _{\text{Total }}=\Delta S _{\text{sus }}+\Delta S _{\text{surr }}$
$ \begin{aligned} \Delta S _{\text{Total }} & =\Delta S _{\text{sys }}+\frac{-\Delta H _{\text{sys }}}{T} \\ T \Delta S _{\text{Total }} & =T \Delta S _{\text{sys }}-\Delta H _{\text{sys }} \end{aligned} $
स्वतःत: होने वाले परिवर्तन के लिए, $\Delta S _{\text{total }}>0$
$ \begin{matrix} \therefore & T \Delta S _{s y s}-\Delta H _{s y s}>0 \\ \Rightarrow & -(\Delta H _{s y s}-T \Delta S _{s y s})>0 \end{matrix} $
लेकिन, $\Delta H _{\text{sys }}-T \Delta S _{\text{sys }}=\Delta G _{\text{sys }}$
$\therefore \quad-\Delta G _{\text{sys }}>0$
$\Rightarrow \Delta G _{\text{sys }}=\Delta H _{\text{sys }}-T \Delta S _{\text{sys }}<0$
$\Delta H _{\text{sys }}=$ प्रतिक्रिया का उष्मा परिवर्तन।
$T \Delta S _{\text{sys }}=$ उपयोगी कार्य करने के लिए अनुपलब्ध ऊर्जा।
$\Delta G _{\text{sys }}=$ उपयोगी कार्य करने के लिए उपलब्ध ऊर्जा।
- $\Delta G$ की इकाई जूल है।
- यह प्रतिक्रिया उच्च तापमान पर स्वतः हो जाएगी।
~~ 62.

चित्र: 6.9
(i) पुनरावृत्ति रूप का कार्य संयुक्त क्षेत्रों और प्रिंट्स द्वारा प्रतिष्ठित किया जाता है।
(ii) स्थिर दबाव, $p_f$ के खिलाफ काम को क्षेत्र द्वारा प्रतिष्ठित किया जाता है। काम (i) $>$ काम (ii)










