एकक 13 ऐमीन
ऐमीनों का मुख्य व्यावसायिक उपयोग औषधियों और तंतुओं के संश्लेषण में मध्यवर्तियों के रूप में होता है।
ऐमीन, अमोनिया अणु से एक अथवा अधिक हाइड्रोजन परमाणुओं के ऐल्किल अथवा ऐरिल समूहों द्वारा विस्थापन से प्राप्त कार्बनिक यौगिकों का एक महत्वपूर्ण वर्ग बनाती हैं। प्रकृति में ये प्रोटीन, विटामिन, ऐल्केलॉइड तथा हॉर्मोनों में पाए जाती हैं। संश्लेषित उदाहरणों में बहुलक, रंजक और औषध सम्मिलित हैं। दो जैव-सक्रिय यौगिक, मुख्यतया - ऐड्रीनलिन और इफेड्रिन, का उपयोग रक्त-चाप बढ़ाने के लिए किया जाता है दोनों में ही द्वितीयक ऐमीनों समूह होता है। एक संश्लेषित यौगिक ‘नोवोकेन’ का उपयोग दंतचिकित्सा में निश्चेतक के रूप में किया जाता है। प्रसिद्ध प्रतिहिस्टैमिन ‘बैनैड्रिल’ में भी तृतीयक ऐमीनो समूह उपस्थित है। चतुष्क अमोनियम लवणों का प्रयोग पृष्ठसक्रियक के रूप में होता है। डाइऐज़ोनियम लवण, रंजकों सहित विभिन्न ऐरोमैटिक यौगिकों को बनाने में मध्यवर्ती होते हैं। इस एकक में आप ऐमीन एवं डाइऐज़ोनियम लवणों के विषय में विस्तृत जानकारी प्राप्त करेंगे।
I. ऐमीन
ऐमीन को अमोनिया के एक, दो अथवा तीनों हाइड्रोजन परमाणुओं को ऐल्किल और/अथवा ऐरिल समूहों द्वारा विस्थापित कर प्राप्त हुए व्युत्पन्न के रूप में माना जा सकता है। उदाहरणार्थ-
$$ \mathrm{CH_3-NH_2, C_6H_5-NH_2, CH_3-NH-CH_3, CH_3-}\mathrm{N \langle \substack{{CH_3} \\ {CH_3}}} $$
9.1 डेमीनों की संरचना
अमोनिया की भाँति, ऐमीन का नाइट्रोजन परमाणु त्रिसंयोजी है एवं इस पर एक असहभाजित इलेक्ट्रॉन युगल है। ऐमीन में नाइट्रोजन के कक्षक $s p^{3}$ संकरित होते हैं तथा ऐमीन की आकृति पिरैमिडी होती है। नाइट्रोजन के तीनों $s p^{3}$ संकरित कक्षकों में से प्रत्येक ऐमीन के संगठन के अनुसार हाइड्रोजन अथवा कार्बन के कक्षकों से अतिव्यापन करता है। सभी ऐमीनों में नाइट्रोजन के चौथे कक्षक में एक असहभाजित इलेक्ट्रॉन युगल स्थित रहता है। असहभाजित इलेक्ट्रॉन युगल की उपस्थिति के कारण $\mathrm{C}-\mathrm{N}-\mathrm{E}$ कोण (जहाँ $\mathrm{E}=\mathrm{C}$ अथवा $\mathrm{H}$ है), $109.5^{\circ}$ से कम होता है। उदाहरण के लिए यह कोण ट्राईमेथिलऐमीन में $108^{\circ}$ होता है जैसा कि चित्र 9.1 में दर्शाया गया है।

चित्र 9.1-ट्राईमेथिलऐमीन की पिरैमिडी आकृति
9.2 वर्गीकरण
अमोनिया अणु में ऐल्किल अथवा ऐरिल समूहों द्वारा प्रतिस्थापित हाइड्रोजन परमाणुओं की संख्या के आधार पर ऐमीनों का वर्गीकरण, प्राथमिक $\left(1^{\circ}\right)$, द्वितीयक $\left(2^{\circ}\right)$ तथा तृतीयक $\left(3^{\circ}\right)$ में किया जाता है। यदि अमोनिया में एक हाइड्रोजन परमाणु $\mathrm{R}$ अथवा $\mathrm{Ar}$ से प्रतिस्थापित हो तो हमें प्राथमिक $\left(1^{\circ}\right)$ एमीन $\mathrm{R}-\mathrm{NH} _{2}$ अथवा $\mathrm{Ar}-\mathrm{NH} _{2}$ प्राप्त होती है। यदि अमोनिया के दो हाइड्रोजन परमाणु अथवा $\mathrm{R}-\mathrm{NH} _{2}$ के एक हाइड्रोजन का प्रतिस्थापन अन्य ऐल्किल/ऐरिल $\left(R^{\prime}\right)$ समूह से होता है तब आप क्या प्राप्त करेंगे? आपको द्वितीयक एमीन, R-NH-R’ प्राप्त होगी। दूसरा एल्किल/ऐरिल समूह समान अथवा भिन्न हो सकता है। एक और हाइड्रोजन परमाणु का विस्थापन ऐल्किल/ऐरिल समूह से होने पर तृतीयक ऐमीन बनती है। यदि सभी ऐल्किल अथवा ऐरिल समूह समान हों तो ऐमीन को ‘सरल’ तथा भिन्न होने पर ‘मिश्रित’ कहते हैं।

9.3 नामपद्धति
सामान्य पद्धति में ऐलिफैटिक ऐमीन का नामकरण ऐमीन शब्द में पूर्वलग्न ऐल्किल लगाकर एक शब्द में, यानी ऐल्किलऐमीन के रूप में किया जाता है, जैसे- मेथिलऐमीन। द्वितीयक एवं तृतीयक ऐमीनों में जब दो अथवा अधिक समूह समान होते हैं तब ऐल्किल समूह के नाम से पहले पूर्वलग्न डाइ अथवा ट्राइ का प्रयोग किया जाता है। आईयूपीएसी पद्धति में ऐमीनों का नामकरण ऐल्केनेमीन के रूप में होता है। उदाहरणार्थ $\mathrm{CH} _{3} \mathrm{NH} _{2}$ का नाम मेथेनेमीन है। यदि मुख्य शृंखला में एक से अधिक स्थानों पर ऐमीन समूह उपस्थित हों तब ऐमीन समूहों की स्थिति कार्बन परमाणु की संख्या जिससे ये जुड़े हों, से व्यक्त कर डाइ, ट्राइ आदि उपयुक्त पूर्वलग्न लगाकर निर्दिष्ट की जाती है। हाइड्रोकार्बन भाग का अनुलग्न बनाए रखा जाता है। उदाहरणार्थ- $\mathrm{H} _{2} \mathrm{~N}-\mathrm{CH} _{2}-\mathrm{CH} _{2}-\mathrm{NH} _{2}$ का नाम एथेन-1, 2-डाइऐमीन है।
द्वितीयक तथा तृतीयक ऐमीन में $\mathrm{N}$ को छोटे एल्किल समूह के साथ जोड़कर विस्थापक के रूप में प्रयुक्त करते हैं। उदाहरणार्थ $\mathrm{CH} _{3} \mathrm{NH} \mathrm{CH} _{2} \mathrm{CH} _{3}$ का नाम है $\mathrm{N}$-मेथिलऐथनामीन तथा $\left(\mathrm{CH} _{3} \mathrm{CH} _{2}\right) _{3} \mathrm{~N}$ का नाम है $\mathrm{N}, \mathrm{N}$-डाइएथिलऐथनामीन। अधिक उदाहरण सारणी 9.1 में दिए हैं। सबसे लम्बी कार्बन शृंखला को मुख्य शृंखला मानते हैं।
ऐरिल ऐमीनों में $-\mathrm{NH} _{2}$ समूह बेन्जीन वलय से सीधे जुड़ा रहता है। ऐरिल ऐमीन का सबसे सरल उदाहरण $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2}$ है। सामान्य पद्धति में इसे ऐनिलीन कहते हैं। यह आइयूपीएसी पद्धति में भी स्वीकार्य नाम है। ऐरिल एमीन का नामकरण करते समय ऐरीन के अंग्रेज़ी में लिखे नाम के अंत में से ’e’ अनुलग्न का प्रतिस्थापन एमीन (‘amine’) शब्द से करते हैं। अतः आइयूपीएसी पद्धति में $\mathrm{C} _{6} \mathrm{H} _{5}-\mathrm{NH} _{2}$ का नाम बेन्जीनेमीन होगा। सारणी 9.1 में कुछ एल्किल एवं ऐरिल ऐमीनों के सामान्य एवं आइयूपीएसी नाम में दिए गए हैं।
सारणी 9.1-कुछ ऐल्किल एवं ऐरिल ऐमीनों की नामपद्धति

पाठ्यनिहित प्रश्न
9.1 निम्नलिखित ऐमीनों को प्राथमिक, द्वितीयक अथवा तृतीयक ऐमीनों में वर्गीकृत कीजिए-

(iii) $\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{2} \mathrm{CHNH} _{2}$
(iv) $\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{2} \mathrm{NH}$
Show Answer
#missing9.2 (i) अणु सूत्र $\mathrm{C} _{4} \mathrm{H} _{11} \mathrm{~N}$ से प्राप्त विभिन्न समावयवी ऐमीनों की संरचना लिखिए।
(ii) सभी समावयवों के आईयूपीएसी नाम लिखिए।
(iii) विभिन्न युग्मों द्वारा कौन से प्रकार की समावयवता प्रदर्शित होती है?
Show Answer
#missing9.4 ऐमीनों का विरचन
ऐमीनों का विरचन निम्नलिखित विधियों से किया जाता है।
1. नाइट्रो यौगिकों का अपचयन
नाइट्रो यौगिक सूक्ष्म विभाजित निकैल, पैलेडियम अथवा प्लैटिनम की उपस्थिति में हाइड्रोजन गैस प्रवाहित करने से ऐमीनों में अपचित हो जाते हैं। अम्लीय माध्यम में धातुओं द्वारा भी इनका अपचयन हो सकता है। इसी प्रकार से नाइट्रोऐल्कीन भी संगत ऐल्केनेमीनों में अपचित की जा सकती हैं।

रद्दी लोहे एवं हाइड्रोक्लोरिक अम्ल द्वारा अपचयन को वरीयता दी जाती है, क्योंकि अभिक्रिया में जनित $\mathrm{FeCl} _{2}$ जलअपघटित होकर हाइड्रोक्लोरिक अम्ल देता है। अतः केवल अभिक्रिया प्रारंभ करने के लिए हाइड्रोक्लोरिक अम्ल की बहुत कम मात्रा में आवश्यकता होती है।
2. ऐल्किल हैलाइडों का ऐमोनीअपघटन
आपने एकक 6 में पढ़ा है कि ऐल्किल अथवा बेन्जिल हैलाइडों में कार्बन-हैलोजन आबंध नाभिकरागी द्वारा सरलता से विदलित हो जाता है। अतः ऐल्किल अथवा बेन्जिल हैलाइड अमोनिया के ऐथेनॉलिक विलयन से नाभिकरागी प्रतिस्थापन अभिक्रिया करते हैं जिसमें हैलोजन परमाणु ऐमीनो $\left(-\mathrm{NH} _{2}\right)$ समूह से प्रतिस्थापित हो जाता है। अमोनिया अणु द्वारा $\mathrm{C}-\mathrm{X}$ आबंध के विदलन की प्रक्रिया को अमोनीअपघटन (ammonolysis) कहते हैं। यह अभिक्रिया $373 \mathrm{~K}$ ताप पर सील बंद नालिका में कराते हैं। इस प्रकार से प्राप्त प्राथमिक ऐमीन नाभिकरागी की तरह व्यवहार करती है और पुनः ऐल्किल हैलाइड से अभिक्रिया करके द्वितीयक एवं तृतीयक एमीन तथा अंततः चतुष्क अमोनियम लवण बना सकती है।

इस अभिक्रिया में हैलाइडों की ऐमीनों से अभिक्रियाशीलता का क्रम $\mathrm{RI}>\mathrm{RBr}>\mathrm{RCl}$ होता है। अमोनियम लवण से मुक्त ऐमीन प्रबल क्षार द्वारा अभिक्रिया से प्राप्त की जा सकती है।
$$ \mathrm{R}-\stackrel{+}{\mathrm{N}} \mathrm{H} _{3} \overline{\mathrm{X}}+\mathrm{NaOH} \rightarrow \mathrm{R}-\mathrm{NH} _{2}+\mathrm{H} _{2} \mathrm{O}+\stackrel{+}{\mathrm{Na}} \overline{\mathrm{X}} $$
अमोनीअपघटन में यह असुविधा है कि इससे प्राथमिक, द्वितीयक एवं तृतीयक ऐमीन तथा चतुष्क अमोनियम लवण का मिश्रण प्राप्त होता है। यद्यपि अमोनिया आधिक्य में लेने पर प्राप्त मुख्य उत्पाद प्राथमिक ऐमीन हो सकता है।
उदाहरण 9.1 निम्नलिखित अभिक्रियाओं के लिए रासायनिक समीकरण लिखिए-
(i) एथेनॉलिक $\mathrm{NH} _{3}$ की $\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{Cl}$ के साथ अभिक्रिया।
(ii) बेन्जिल क्लोराइड का अमोनीअपघटन तथा प्राप्त ऐमीन की दो मोल $\mathrm{CH} _{3} \mathrm{Cl}$ से अभिक्रिया।
हल

3. नाइट्राइलों का अपचयन
नाइट्राइल लीथियम ऐलुमिनियम हाइड्राइड $\left(\mathrm{LiAlH} _{4}\right)$ अथवा उत्प्रेरकी हाइड्रोजनन द्वारा अपचित होकर प्राथमिक ऐमीन बनाते हैं। इस अभिक्रिया का उपयोग ऐमीन श्रेणी के आरोहण (ascent) में, अर्थात् प्रारंभिक ऐमीन से एक अधिक कार्बन वाले ऐमीन के विरचन में किया जाता है।
$$ \mathrm{R}-\mathrm{C} \equiv \mathrm{N} \xrightarrow[\mathrm{Na}(\mathrm{Hg}) / \mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OH}]{\mathrm{H} _{2} / \mathrm{Ni}} \mathrm{R}-\mathrm{CH} _{2}-\mathrm{NH} _{2}$$
4. ऐमाइडों का अपचयन
ऐमाइड लीथियम ऐलुमिनियम हाइड्राइड द्वारा अपचित होकर ऐमीन देते हैं।

5. गैब्रिएल थैलिमाइड संश्लेषण
गैब्रिएल संश्लेषण का प्रयोग प्राथमिक ऐमीनों के विरचन के लिए किया जाता है। थैलिमाइड ऐथेनॉलिक पोटैशियम हाइड्रॉक्साइड से अभिक्रिया द्वारा थैलिमाइड का पोटैशियम लवण बनाता है जो ऐल्किल हैलाइड के साथ गरम करने के पश्चात् क्षारीय जलअपघटन द्वारा संगत प्राथमिक ऐमीन उत्पन्न करता है। ऐरोमैटिक प्राथमिक ऐमीन इस विधि से नहीं बनाई जा सकतीं क्योंकि ऐरिल हैलाइड थैलिमाइड से प्राप्त ऋणायन के साथ नाभिकरागी प्रतिस्थापन; अभिक्रिया नहीं कर सकते।

6. हॉफमान ब्रोमामाइड निम्नीकरण अभिक्रिया
हॉफमान ने प्राथमिक ऐमीनों के विरचन के लिए एक विधि विकसित की जिसमें किसी ऐमाइड की $\mathrm{NaOH}$ के जलीय अथवा ऐथेनॉलिक विलयन में ब्रोमीन से अभिक्रिया करते हैं। इस निम्नीकरण अभिक्रिया में ऐल्किल अथवा ऐरिल समूह का स्थानांतरण ऐमाइड के कार्बोनिल कार्बन से ऐमीन के कार्बोनिल परमाणु पर होता है। इस प्रकार प्राप्त ऐमीन में ऐमाइड से एक कार्बन कम होता है।
$$ \mathrm{R}-\stackrel{\mathrm{O}}{\stackrel{\text{||}}{\mathrm{C}}}-\mathrm{NH_2}+\mathrm{Br_2}+4 \mathrm{NaOH} \longrightarrow \mathrm{R}-\mathrm{NH_2}+\mathrm{Na_2} \mathrm{CO_3}+2 \mathrm{NaBr}+2 \mathrm{H_2} \mathrm{O} $$
उदाहरण 9.2 निम्नलिखित परिवर्तनों के लिए रासायनिक समीकरण लिखिए-
(i) $\mathrm{CH} _{3}-\mathrm{CH} _{2}-\mathrm{Cl}$ से $\mathrm{CH} _{3}-\mathrm{CH} _{2}-\mathrm{CH} _{2}-\mathrm{NH} _{2}$ में
(ii) $\mathrm{C} _{6} \mathrm{H} _{5}-\mathrm{CH} _{2}-\mathrm{Cl}$ से $\mathrm{C} _{6} \mathrm{H} _{5}-\mathrm{CH} _{2}-\mathrm{CH} _{2}-\mathrm{NH} _{2}$ में
हल

उदाहरण 9.3 निम्नलिखित की संरचनाएं एवं आइयूपीएसी नाम लिखिए
(i) ऐमाइड जो हॉफमान ब्रोमेमाइड अभिक्रिया द्वारा प्रोपेनेमीन देता है।
(ii) बेन्ज़ऐमाइड के हॉफमान ब्रोमेमाइड निम्नीकरण से प्राप्त ऐमीन।
हल
(i) प्रोपेनेमीन में तीन कार्बन हैं। अतः ऐमाइड अणु में चार कार्बन परमाणु होने चाहिए। चार कार्बन परमाणु युक्त प्रारंभिक ऐमाइड की संरचना एवं आईयूपीएसी नाम निम्नलिखित हैं-

(ii) बेन्ज़ऐमाइड सात कार्बन परमाणु युक्त एक ऐरोमैटिक ऐमाइड है अतः बेन्ज़ऐमाइड से छः कार्बन युक्त प्राथमिक ऐरोमैटिक ऐमीन प्राप्त होगी।

पाठ्यनिहित प्रश्न
9.3 आप निम्नलिखित परिवर्तन कैसे करेंगे?
(i) बेन्जीन से ऐनिलीन
(ii) बेन्जीन से $\mathrm{N}, \mathrm{N}$-डाइमेथिलऐनिलीन
(iii) $\mathrm{Cl}-\left(\mathrm{CH} _{2}\right) _{4}-\mathrm{Cl}$ से हेक्सेन-1, 6 -डाइऐमीन
Show Answer
#missing9.5 औतिक गुणधर्म
निम्नतर ऐलिफैटिक ऐमीन मत्स्य गंध वाली गैसें हैं। तीन अथवा अधिक कार्बन परमाणु वाली प्राथमिक ऐमीन द्रव तथा इससे उच्चतर ऐमीन ठोस हैं। ऐनिलीन तथा अन्य ऐरिलऐमीन प्राय: रंगहीन होती हैं। परंतु भंडारण के दौरान वातावरण द्वारा ऑक्सीकरण होने से रंगीन हो जाती हैं।
निम्नतर ऐलिफैटिक ऐमीन जल में विलेय होती हैं, क्योंकि यह जल के अणुओं के साथ हाइड्रोजन आबंध बना सकती हैं। हालाँकि, अणुभार में वृद्धि के साथ जलविरागी (Hydrophlic) ऐल्किल भाग बढ़ जाता है अतः जल में विलेयता घटती है। उच्चतर ऐमीन जल में आवश्यक रूप से अविलेय होती हैं। ऐमीन की नाइट्रोजन एवं ऐल्कोहॉल की ऑक्सीजन की विद्युतऋणात्मकता क्रमशः 3.0 एवं 3.5 मानने पर आप ऐमीनों एवं ऐल्कोहलों की जल में विलेयता के पैटर्न की प्रागुक्ति कर सकते हैं। ब्यूटेन-1-ऑल एवं ब्यूटेन-1-ऐमीन में से कौन जल में अधिक विलेय होगा और क्यों? ऐमीन कार्बनिक विलायकों जैसे ऐल्कोहॉल, ईथर एवं बेन्जीन में विलेय होती है। आपको याद होगा कि एल्कोहॉल ऐमीन की तुलना में अधिक ध्रुवित होती हैं तथा ऐमीन की तुलना में प्रबल अंतराआण्विक हाइड्रोजन आबंध बनाती हैं।
प्राथमिक एवं द्वितीयक ऐमीनों में एक अणु का नाइट्रोजन परमाणु दूसरे अणु के हाइड्रोजन परमाणु से आबंधित होने के कारण इनमें अंतराआण्विक संघटन होता है। यह अंतराआण्विक संघटन प्राथमिक ऐमीनों में द्वितीयक एमीनों की तुलना में हाइड्रोजन आबंधन के लिए दो हाइड्रोजन परमाणुओं की उपलब्धता के कारण अधिक होता है। तृतीयक ऐमीन में नाइट्रोजन पर हाइड्रोजन अणुओं के अभाव के कारण अंतराआण्विक संघटन नहीं होता। अतः समावयवी ऐमीनों के क्वथनांकों का क्रम निम्नलिखित होगा-
प्राथमिक > द्वितीयक > तृतीयक प्राथमिक ऐमीन में उपस्थित अंतराआण्विक हाइड्रोजन आबंधन को चित्र 9.2 में दर्शाया गया है।
सारणी 9.2-लगभग समान आण्विक द्रव्यमान वाली ऐमीनों, ऐल्कोहॉलों एवं एल्केनों के क्वथनांकों की तुलना
| क्र. सं. | अौगिक | अणुव्यमान | क्वथनांक (K) |
|---|---|---|---|
| 1. | $\mathrm{n}-\mathrm{C} _{4} \mathrm{H} _{9} \mathrm{NH} _{2}$ | 73 | 350.8 |
| 2. | $\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{2} \mathrm{NH}$ | 73 | 329.3 |
| 3. | $\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{~N}\left(\mathrm{CH} _{3}\right) _{2}$ | 73 | 310.5 |
| 4. | $\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{CH}\left(\mathrm{CH} _{3}\right) _{2}$ | 72 | 300.8 |
| 5. | $\mathrm{n}-\mathrm{C} _{4} \mathrm{H} _{9} \mathrm{OH}$ | 74 | 390.3 |
9.6 राभायनिक अभिक्रिर्याडँ
नाइट्रोजन एवं हाइड्रोजन परमाणुओं की विद्युतऋणात्मकता में अंतर तथा नाइट्रोजन परमाणु पर असहभाजित इलेक्ट्रॉन युगल की उपस्थिति ऐमीन को सक्रिय बना देती है। नाइट्रोजन परमाणुओं से जुड़ी हाइड्रोजन परमाणुओं की संख्या भी ऐमीन की अभिक्रिया का पथ निर्धारित करती है। इसलिए प्राथमिक $\left(-\mathrm{NH} _{2}\right)$, द्वितीयक $(-\mathrm{N}-\mathrm{H})$ एवं तृतीयक ऐमीनों $(\mathrm{N}-)$ की बहुत सी अभिक्रियाओं में भिन्नता होती है। इसके अतिरिक्त, असहभाजित इलेक्ट्रॉन युगल की उपस्थिति के कारण ऐमीन नाभिकरागी की तरह व्यवहार करती हैं। ऐमीनों की कुछ अभिक्रियाओं की व्याख्या नीचे दी गई है-
1. ऐमीनों का क्षारकीय गुण
क्षारकीय प्रकृति होने के कारण ऐमीन अम्लों से अभिक्रिया कर लवण बनाती हैं।

ऐमीन लवण $\mathrm{NaOH}$ जैसे क्षार से अभिक्रिया करके पितृ ऐमीन पुनर्जनित करती हैं।
$$ \stackrel{+}{\mathrm{RNH} _{3}} \overline{\mathrm{X}}+\stackrel{-}{\mathrm{O}} \mathrm{H} \longrightarrow \mathrm{R \ddot{N}H} _{2}+\mathrm{H} _{2} \mathrm{O}+\overline{\mathrm{X}} $$
ऐमीन लवण जल में विलेय किंतु ईथर जैसे कार्बनिक विलायकों में अविलेय होते हैं। यह अभिक्रिया जल में अविलेय अक्षारकीय कार्बनिक यौगिकों को ऐमीन से पृथक् करने का आधार है।
ऐमीन की खनिज अम्लों से अभिक्रिया द्वारा लवणों का बनना इनकी क्षारकीय प्रकृति को दर्शाता है। ऐमीनों में एक असहभाजित इलेक्ट्रॉन युगल उपस्थित होने के कारण यह लूईस क्षारक की भाँति व्यवहार करती है । ऐमीनों के क्षारकीय गुण को उनके $K _{b}$ एवं $p K _{b}$ के मान पर विचार करके भलीभाँति व्याख्या की जा सकती है।
$$ \begin{aligned} & \mathrm{R}-\mathrm{NH_2}+\mathrm{H_2} \mathrm{O} \rightleftarrows \stackrel{+}{\rightleftarrows} \mathrm{R}-\stackrel{-}{\mathrm{N}} \mathrm{H_3} \\ & K=\frac{\left[\mathrm{R}-\stackrel{+}{\mathrm{N}} \mathrm{H_3}\right][\stackrel{\mathrm{O}}{\mathrm{H}}]}{\left[\mathrm{R}-\mathrm{NH_2}\right]\left[\mathrm{H_2} \mathrm{O}\right]} \\ & \text { अथवा } K\left[\mathrm{H_2} \mathrm{O}\right]=\frac{\left[\mathrm{R}-\stackrel{+}{\mathrm{N}} \mathrm{H_3}\right][\stackrel{-}{\mathrm{O}}]}{\left[\mathrm{R}-\mathrm{NH_2}\right]} \\ & \text { अथवा } \quad K_{b}=\frac{\left[\mathrm{R}-\stackrel{+}{\mathrm{N}} \mathrm{H_3}\right][\stackrel{-}{\mathrm{O}} \mathrm{H}]}{\left[\mathrm{R}-\mathrm{NH_2}\right]} \\ & \mathrm{pK_b}=-\log \mathrm{K_b} \end{aligned} $$
$K _{b}$ का मान जितना अधिक होता है अथवा $\mathrm{p} K _{b}$ का मान जितना कम होता है, क्षारक उतना ही प्रबल होता है। कुछ ऐमीनों के $\mathrm{pK} _{b}$ मान सारणी 9.3 में दिए गए हैं।
अमोनिया का $\mathrm{p} K _{b}$ मान 4.75 होता है। ऐलिफैटिक ऐमीन, नाइट्रोजन परमाणु पर ऐल्किल समूहों के $+\mathrm{I}$ प्रभाव के कारण अधिक इलेक्ट्रॉन घनत्व होने से अमोनिया से प्रबल क्षारक होते हैं। इनके $\mathrm{p} K _{b}$ मान 3 से 4.22 के मध्य होते हैं। दूसरी ओर ऐरोमैटिक ऐमीन ऐरिल समूह की इलेक्ट्रॉन खींचने (इलेक्ट्रॉन अपनयन) की प्रकृति के कारण अमोनिया से दुर्बल क्षारक होते हैं।
सारणी 9.3-जलीय प्रावस्था में कुछ ऐमीनों के $\mathrm{pK} _{b}$ मान
| ऐमीन का नाम | $\mathbf{p K} _{\boldsymbol{b}}$ |
|---|---|
| मेथेनेमीन | 3.38 |
| $\mathrm{~N}$-मेथिलमेथेनेमीन | 3.27 |
| $\mathrm{~N}, \mathrm{~N}$-डाइमेथिलमेथेनेमीन | 4.22 |
| एथेनेमीन | 3.29 |
| $\mathrm{~N}$-एथिलऐथेनेमीन | 3.00 |
| $\mathrm{~N}, \mathrm{~N}$-डाइएथिलऐथेनेमीन | 3.25 |
| बेन्जीनऐमीन | 9.38 |
| फ़ेनिलमेथेनेमीन | 4.70 |
| $\mathrm{~N}$-मेथिलऐनिलीन | 9.30 |
| $\mathrm{~N}, \mathrm{~N}$-डाइमेथिलऐनिलीन | 8.92 |
प्रतिस्थापियों के $+\mathrm{I}$ अथवा $-\mathrm{I}$ प्रभाव के आधार पर ऐमीनों के $K _{b}$ मान के प्रतिपादन में आपको कुछ विसंगतियाँ मिल सकती हैं। प्रेरणिक प्रभाव के अतिरिक्त कुछ अन्य प्रभाव, जैसे- विलायकयोजन प्रभाव, त्रिविम अवरोधन आदि भी ऐमीन की क्षारकीय सामर्थ्य को प्रभावित करते हैं। इस पर विचार कीजिए। आपको इसका उत्तर निम्नलिखित अनुच्छेदों में मिल जाएगा।
ऐमीनों की संरचना तथा क्षारकता में संबंध
ऐमीनों की क्षारकता इनकी संरचना से संबंधित होती है। ऐमीनों का क्षारकीय गुण अम्ल से प्रोटॉन ग्रहण कर धनायन बनाने की सहजता पर निर्भर करता है, ऐमीन की तुलना में धनायन जितना अधिक स्थायी होता है ऐमीन उतनी ही अधिक क्षारकीय होती है।
( क) ऐल्केनेमीन बनाम अमोनिया
आइए हम ऐल्केनेमीन और अमोनिया की क्षारकता की तुलना करने के लिए इनकी प्रोटॉन से अभिक्रिया की तुलना करें।

इलेक्ट्रॉन मुक्त करने की प्रकृति के कारण ऐल्किल $(R)$ समूह इलेक्ट्रॉन को नाइट्रोजन की ओर धकेलते हैं और इस प्रकार से नाइट्रोजन के असहभाजित इलेक्ट्रॉन युगल की प्रोटॉन से साझेदारी के लिए उपलब्धता को बढ़ा देते हैं। इसके अलावा ऐमीन से प्राप्त हुआ प्रतिस्थापित अमोनियम आयन, एल्किल समूह के $+I$ प्रभाव के कारण आवेश के वितरण द्वारा स्थायित्व प्राप्त करता है। अतः ऐल्किल-ऐमीन अमोनिया से प्रबल क्षारक होते हैं। इसलिए ऐलिफैटिक ऐमीन की क्षारकता इनमें उपस्थित ऐल्किल समूह की संख्या बढ़ने के साथ बढ़नी चाहिए। गैसीय प्रावस्था में यह क्रम बना रहता है। गैसीय प्रावस्था में ऐमीनों की क्षारकता का क्रम अपेक्षित क्रम में होता है जो इस प्रकार है- तृतीयक ऐमीन $>$ द्वितीयक ऐमीन $>$ प्राथमिक ऐमीन $>$ अमोनिया $\left(\mathrm{NH} _{3}\right)$ । सारणी 9.3 में दिए गए $p K _{b}$ के मानों से स्पष्ट होता है कि यह क्रम जलीय प्रावस्था में क्रमानुसार नहीं होता। जलीय प्रावस्था में प्रतिस्थापित अमोनियम धनायनों का स्थायित्व केवल ऐल्किल समूह के इलेक्ट्रॉन मुक्त करने के प्रभाव $(+\mathrm{I})$ पर ही निर्भर नहीं होता, अपितु जल अणुओं द्वारा विलायक योजन पर भी निर्भर करता है। धनायन का आकार जितना बड़ा होता है उसका विलायक योजन उतना ही कम होता है, आयनों के स्थायित्व का क्रम इस प्रकार है-

प्रतिस्थापित अमोनियम धनायन का स्थायित्व जितना अधिक होता है, संगत ऐमीन का क्षारकीय प्राबल्य उतना ही अधिक होना चाहिए। अतः ऐलिफैटिक एमीनों की क्षारकता का क्रम, प्राथमिक $>$ द्वितीयक $>$ तृतीयक होना चाहिए जो कि प्रेरणिक प्रभाव के विपरीत क्रम है। पुनश्चः जब ऐल्किल समूह- $-\mathrm{CH} _{3}$ की तरह छोटा होता है तो हाइड्रोजन आबंधन में कोई त्रिविम बाधा नहीं होती। यदि ऐल्किल समूह $-\mathrm{CH} _{3}$ समूह से बड़ा होगा तो हाइड्रोजन आबंधन में त्रिविम बाधा आएगी। इसलिए ऐल्किल समूह की प्रकृति में परिवर्तन, जैसे $-\mathrm{CH} _{3}$ से $-\mathrm{C} _{2} \mathrm{H} _{5}$ होने पर क्षारकता सामर्थ्य के क्रम में परिवर्तन हो जाता है। अतः जलीय प्रावस्था में प्रेरणिक प्रभाव, विलायक योजन प्रभाव तथा त्रिविम बाधा का जटिल पारस्परिक प्रभाव क्षारकीय प्राबल्य का निर्धारण करता है। जलीय विलयन में मेथिल और ऐथिल प्रतिस्थापित एमीनों के क्षारकीय प्राबल्य का क्रम इस प्रकार है-
$$ \begin{aligned} & \left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{2} \mathrm{NH}>\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{3} \mathrm{~N}>\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{NH} _{2}>\mathrm{NH} _{3} \\ & \left(\mathrm{CH} _{3}\right) _{2} \mathrm{NH}>\mathrm{CH} _{3} \mathrm{NH} _{2}>\left(\mathrm{CH} _{3}\right) _{3} \mathrm{~N}>\mathrm{NH} _{3} \end{aligned} $$
( ख) ऐरिलऐमीन बनाम अमोनिया
ऐनिलीन के $p K _{b}$ का मान काफ़ी अधिक है। ऐसा क्यों है? ऐसा इसलिए है कि बेन्जीन तथा अन्य ऐरिल ऐमीनों में $-\mathrm{NH} _{2}$ समूह सीधे बेन्जीन वलय से जुड़ा होता है। इससे नाइट्रोजन परमाणु पर उपस्थित असहभाजित इलेक्ट्रॉन युगल, बेन्जीन वलय के साथ संयुग्मन के कारण प्रोटॉनन के लिए कम उपलब्ध होता है। यदि आप ऐनिलीन की विभिन्न संरचनाएं लिखें, तो आप पाएंगे कि ऐनिलीन निम्नलिखित पाँच संरचनाओं का संकर है। दूसरी ओर प्रोटॉन ग्रहण से परिणित ऐनिलीनियम आयन की केवल दो अनुनाद संरचनाएं (केकुले) होती हैं।

ऐनिलीनियम धनायन की अनुनादी संरचनाएं

हम जानते हैं कि जितनी अधिक अनुनादी संरचनाएं होती हैं स्थायित्व उतना ही अधिक होता है। अतः आप निष्कर्ष निकाल सकते हैं कि ऐनिलीन (पाँच अनुनादी संरचनाएं) ऐनिलीनियम आयन से अधिक स्थायी होती हैं। अतः एनिलीन अथवा अन्य ऐरोमैटिक ऐमीनों की प्रोटोन स्वीकार्यता अथवा क्षारक गुण कम होगा। प्रतिस्थापित ऐनिलीन में यह देखा गया है कि इलेक्ट्रॉन मुक्त करने वाले समूह जैसे $-\mathrm{OCH} _{3},-\mathrm{CH} _{3}$, क्षारकीय प्राबल्य में वृद्धि करते हैं जबकि इलेक्ट्रॉन खींचने वाले समूह जैसे $-\mathrm{NO} _{2},-\mathrm{SO} _{3} \mathrm{H},-\mathrm{COOH},-\mathrm{X}$, इसे कम करते हैं।
उदाहरण 9.4 निम्नलिखित को क्षारकीय प्राबल्य के घटते क्रम में लिखिए-
$\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2}, \mathrm{C} _{2} \mathrm{H} _{5} \mathrm{NH} _{2},\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{2} \mathrm{NH}, \mathrm{NH} _{3}$
हल उपरोक्त ऐमीनों एवं अमोनिया के क्षारकीय प्राबल्य में कमी का क्रम इस प्रकार है-
$\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{2} \mathrm{NH}>\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{NH} _{2}>\mathrm{NH} _{3}>\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2}$
2. ऐल्किलन
ऐमीन ऐल्किल हैलाइडों के साथ ऐल्किलन अभिक्रिया देती हैं। (देखें कक्षा 12 , एकक 6)
3. ऐसिलन
ऐलीफैटिक तथा ऐरोमैटिक प्राथमिक एवं द्वितीयक ऐमीन ऐसिड क्लोराइड, ऐनहाइड्राइड और ऐस्टर से नाभिकरागी प्रतिस्थापन अभिक्रिया करते हैं। यह अभिक्रिया ऐसिलन कहलाती है। आप इस अभिक्रिया को $-\mathrm{NH} _{2}$ अथवा $>\mathrm{N}-\mathrm{H}$ समूह में उपस्थित हाइड्रोजन परमाणु का ऐसिल समूह द्वारा प्रतिस्थापन समझ सकते हैं। ऐसिलन अभिक्रिया से प्राप्त उत्पादों को ऐमाइड कहते हैं। यह अभिक्रिया ऐमीन से अधिक प्रबल क्षारक, जैसे पिरीडीन की उपस्थिति में कराई जाती है जो अभिक्रिया में बने $\mathrm{HCl}$ को निकालकर साम्य को दाईं ओर विस्थापित कर देता है।

ऐमीन बेन्जॉयल क्लोराइड $\left(\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{COCl}\right)$ से भी अभिक्रिया करती हैं। इस अभिक्रिया को बेन्ज़ाइलन कहते हैं।
$$\underset{\text{मेथेनेमीन }}{\mathrm{CH_3} \mathrm{NH_2}}+\underset{\text{बेन्जॉयल क्लोराइड}}{\mathrm{C_6} \mathrm{H_5} \mathrm{COCl}} \longrightarrow \underset{\mathrm{N} - \text{मेथिलबेन्ज़ेऐमाइड}}{\mathrm{CH_3} \mathrm{NHCOC_6} \mathrm{H_5}}+\mathrm{HCl}$$
क्या आप जानते हैं कि ऐमीन तथा कार्बोक्सिलिक अम्ल की अभिक्रिया से प्राप्त उत्पाद क्या होगा? ये कमरे के ताप पर ऐमीन से अभिक्रिया द्वारा लवण बनाते हैं।
4. कार्बिलऐमीन अभिक्रिया
ऐलिफैटिक तथा ऐरोमैटिक प्राथमिक ऐमीन, क्लोरोफ़ार्म और एथेनॉलिक पोटैशियम हाइड्रॉक्साइड के साथ गर्म करने पर दुर्गंधयुक्त पदार्थ आइसोसायनाइड अथवा कर्बिलऐमीन का विरचन करती हैं। द्वितीयक एवं तृतीयक ऐमीन यह अभिक्रिया नहीं दर्शातीं। इस अभिक्रिया को कार्बिलऐमीन अभिक्रिया अथवा आइसोसायनाइड परीक्षण कहते हैं तथा यह प्राथमिक ऐमीनों के परीक्षण में प्रयुक्त होती है।
$ \mathrm{R-NH_2 + CHCl_3+ 3KOH} \xrightarrow[]{ताप} \mathrm{R-NC} + \mathrm{KCL+3H_2O} $
5. नाइट्रस अम्ल से अभिक्रिया
खनिज अम्ल एवं सोडियम नाइट्राइट की अभिक्रिया से स्वस्थान (in situ) बनायी गई तीनों वर्गों की ऐमीन नाइट्रस अम्ल से अलग-अलग तरह से अभिक्रिया करती हैं।
( क) प्राथमिक ऐलीफैटिक ऐमीन नाइट्रस अम्ल से अभिक्रिया द्वारा ऐलीफैटिक डाइऐज़ोनीयम लवण बनाती हैं जो अस्थायी होने के कारण मात्रात्मकतः नाइट्रोजन निर्मुक्त करती हैं और एल्कोहॉल बनाती हैं। नाइट्रोजन की मात्रात्मकतः निकासी का उपयोग ऐमीनो अम्लों एवं प्रोटीनों के आकलन में किया जाता है।
$$ \mathrm{R}-\mathrm{NH} _{2}+\mathrm{HNO} _{2} \xrightarrow{\mathrm{NaNO} _{2}+\mathrm{HCl}}\left[\mathrm{R}-\stackrel{+}{\mathrm{N}} _{2}^{-} \mathrm{Cl}\right] \xrightarrow{\mathrm{H} _{2} \mathrm{O}} \mathrm{ROH}+\mathrm{N} _{2}+\mathrm{HCl} $$
( ख) ऐरोमैटिक ऐमीन नाइट्रस अम्ल से कम ताप (273-268 K) पर अभिक्रिया कर डाइऐज़ोनियम लवण बनाती हैं। यह यौगिकों का एक महत्वपूर्ण वर्ग है जिसका उपयोग विभिन्न प्रकार के ऐरोमैटिक यौगिकों के संश्लेषण में होता है। जिनका वर्णन खंड 9.7 में किया गया है।
$$ \underset{\text { ऐनिलीन }}{\mathrm{C_6} \mathrm{H_5}-\mathrm{NH_2}} \xrightarrow{\stackrel{\mathrm{NaNO_2}+2 \mathrm{HCl}}{273-278 \mathrm{~K}}} \underset{\begin{array}{c} \text { बेन्जीनडाइऐज़ोनियम } \\ \text { क्लोराइड } \end{array}}{\mathrm{C_6} \mathrm{H_5}-\stackrel{+}{\mathrm{N}} \mathrm{C_2} \overline{\mathrm{Cl}}+\mathrm{NaCl}}+2 \mathrm{H_2} \mathrm{O} $$
द्वितीयक और तृतीयक ऐमीन नाइट्रस अम्ल से भिन्न प्रकार से अभिक्रिया करती हैं।
6. ऐरिलसल्फोनिल क्लोराइड से अभिक्रिया बेन्जीन सल्फोनिल क्लोराइड $\left(\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{SO} _{2} \mathrm{Cl}\right)$ जिसे हिन्सबर्ग अभिकर्मक भी कहते हैं, प्राथमिक और द्वितीयक ऐमीनों से अभिक्रिया करके सल्फोनैमाइड बनाता है।
(क) बेन्जीनसल्फोनिल क्लोराइड और प्राथमिक ऐमीन की अभिक्रिया से $\mathrm{N}$ - एथिलबेन्जीनसल्फोनिल ऐमाइड प्राप्त होते हैं।
सल्फोनैमाइड की नाइट्रोजन से जुड़ी हाइड्रोजन प्रबल इलेक्ट्रॉन खीचने वाले सल्फोनिल समूह की उपस्थिति के कारण प्रबल अम्लीय होती है। अतः यह क्षार में विलेय होते हैं।
(ख) द्वितीयक ऐमीन की अभिक्रिया से $\mathrm{N}, \mathrm{N}$ - डाइएथिलबेन्जीनसल्फोनैमाइड बनता है।

$\mathrm{N}, \mathrm{N}$-डाइएथिलबेन्जीनसल्फोनैमाइड में कोई भी हाइड्रोजन परमाणु, नाइट्रोजन परमाणु से नहीं जुड़ा है अतः यह अम्लीय नहीं होता तथा क्षार में अविलेय होता है।
( ग) तृतीयक ऐमीन बेन्जीनसल्फोनिल क्लोराइड से अभिक्रिया नहीं करतीं। विभिन्न वर्गों के ऐमीनों का यह गुण जिसमें वे बेन्जीनसल्फोनिल क्लोराइड से भिन्न-भिन्न प्रकार से अभिक्रिया करती हैं, प्राथमिक, द्वितीयक एवं तृतीयक ऐमीनों में विभेद करने एवं इन्हें मिश्रण से पृथक करने में प्रयुक्त होता है। यद्यपि आजकल बेन्जीनसल्फ़ोनिल क्लोराइड के स्थान पर $p$ - टॉलूईनसल्फ़ोनिल क्लोराइड का प्रयोग होता है।
7. इलेक्ट्रॉनरागी प्रतिस्थापन
आपने पहले पढ़ा है कि ऐनिलीन पाँच अनुनादी संरचनाओं का संकर होती है। आप इन संरचनाओं में कौन से स्थान पर सर्वाधिक इलेक्ट्रॉन घनत्व पाते हैं? $-\mathrm{NH} _{2}$ समूह के संदर्भ से आर्थो तथा पैरा स्थानों पर अधिक इलेक्ट्रॉन घनत्व के केंद्र बन जाते हैं। अत: $-\mathrm{NH} _{2}$ समूह आर्थो तथा पैरा निर्देशक एवं शक्तिशाली सक्रियक समूह है।
( क ) ब्रोमीनन ऐनिलीन कक्ष ताप पर ब्रोमीन जल से अभिक्रिया करके 2, 4, 6 -ट्राईब्रोमोऐनिलीन का सफेद अवक्षेप देती है।

ऐरोमैटिक ऐमीन की इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाओं में मुख्य समस्या इनकी उच्च अभिक्रियाशीलता है। प्रतिस्थापन आर्थो तथा पैरा दोनों स्थानों पर हो सकता है। यदि हमें ऐनिलिन का एकल प्रतिस्थापी व्युत्पन्न बनाना हो तो $-\mathrm{NH} _{2}$ समूह के सक्रियण प्रभाव को कैसे नियंत्रित करेंगे? यह $-\mathrm{NH} _{2}$ समूह को ऐसीटिक ऐनहाइड्राइड ऐसीटिलन द्वारा परिरक्षित करने के बाद वांछित प्रतिस्थापन करके और फिर अंत में प्रतिस्थापित ऐमाइड को प्रतिस्थापित ऐमीन में जलअपघटित करके किया जा सकता है।

ऐसिटेनिलाइड की नाइट्रोजन पर उपस्थित एकाकी इलेक्ट्रॉन युगल ऑक्सीजन परमाणु से अनुनाद द्वारा अन्योन्यक्रिया करता है। इसे नीचे दर्शाया गया है-
अतः नाइट्रोजन पर उपस्थित एकाकी इलेक्ट्रॉन युगल अनुनाद द्वारा बेन्जीन वलय को प्रदान करने के लिए कम उपलब्ध होता है। इसलिए $-\mathrm{NHCOCH} _{3}$ समूह का सक्रियण प्रभाव ऐमीनो समूह से कम होता है।
( ख) नाइट्रोकरण ऐनिलीन के सीधे नाइट्रोकरण से नाइट्रो व्युत्पन्नों के अतिरिक्त अन्य कोलतारी ऑक्सीकरण उत्पाद भी बनते हैं। इसके अलावा प्रबल अम्लीय माध्यम में ऐनिलीन प्रोटॉन ग्रहण कर ऐनिलीनियम आयन बनाती है जो मेटा निर्देशक है। इसी कारण आर्थो एवं पैरा व्युत्पन्न के अलावा मेटा व्युत्पन्न की भी महत्वपूर्ण मात्रा बनती है।

ऐसीटिलन अभिक्रिया द्वारा $-\mathrm{NH} _{2}$ समूह का परिरक्षण करके नाइट्रोकरण अभिक्रिया को नियंत्रित किया जा सकता है और पैरा-नाइट्रो व्युत्पन्न को मुख्य उत्पाद के रूप में प्राप्त किया जा सकता है।

( ग ) सल्फोनेशन ऐनिलीन सांद्र सल्फ्युरिक अम्ल से अभिक्रिया द्वारा ऐनिलीनियम हाइड्रोजनसल्फेट बनाती है जो सल्फ्यूरिक अम्ल के साथ $453-473 \mathrm{~K}$ तक गरम करने पर $p$-ऐमीनोबेन्जीन सल्फोनिक अम्ल जिसे सामान्यतः सल्फैनिलिक अम्ल भी कहते हैं, मुख्य उत्पाद के रूप में बनाता है।

ऐलुमिनियम क्लोराइड के साथ लवण बनाने के कारण ऐनीलीन फ्रीडेल-क्राफ्ट्स अभिक्रिया (ऐल्किलन एवं ऐसीटिलन) नहीं करती। ऐलुमिनियम क्लोराइड एक लूईस अम्ल है जो इस अभिक्रिया में उत्प्रेरक का कार्य करता है। लवण बनने से एनिलीन की नाइट्रोजन धन आवेश प्राप्त कर लेती है और फिर आगे की अभिक्रिया में प्रबल निष्क्रियक समूह की तरह व्यवहार करती है।
पाठ्यनिहित प्रश्न
9.4 निम्नलिखित को उनके बढ़ते हुए क्षारकीय प्रबलता के क्रम में लिखिए-
(i) $\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{NH} _{2}, \mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2}, \mathrm{NH} _{3}, \mathrm{C} _{6} \mathrm{H} _{5} \mathrm{CH} _{2} \mathrm{NH} _{2}$ तथा $\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{2} \mathrm{NH}$
(ii) $\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{NH} _{2},\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{2} \mathrm{NH},\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{3} \mathrm{~N}, \mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2}$
(iii) $\mathrm{CH} _{3} \mathrm{NH} _{2},\left(\mathrm{CH} _{3}\right) _{2} \mathrm{NH},\left(\mathrm{CH} _{3}\right) _{3} \mathrm{~N}, \mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2}, \mathrm{C} _{6} \mathrm{H} _{5} \mathrm{CH} _{2} \mathrm{NH} _{2}$
Show Answer
#missing9.5 निम्नलिखित अम्ल-क्षारक अभिक्रिया को पूर्ण कीजिए तथा उत्पादों के नाम लिखिए-
(i) $\mathrm{CH} _{3} \mathrm{CH} _{2} \mathrm{CH} _{2} \mathrm{NH} _{2}+\mathrm{HCl} \rightarrow$
(ii) $\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{3} \mathrm{~N}+\mathrm{HCl} \rightarrow$
Show Answer
#missing9.6 सोडियम कार्बोनेट विलयन की उपस्थिति में मेथिल आयोडाइड के आधिक्य द्वारा ऐनिलीन के ऐल्किलन में उत्पन्न होने वाले उत्पादों के लिए अभिक्रिया लिखिए।
Show Answer
#missing9.7 ऐनिलीन की बेन्जॉयल क्लोराइड के साथ रासायनिक अभिक्रिया द्वारा उत्पन्न उत्पादों के नाम लिखिए।
Show Answer
#missing9.8 अणुसूत्र $\mathrm{C} _{3} \mathrm{H} _{9} \mathrm{~N}$ से प्राप्त विभिन्न समावयवों की संरचना लिखिए। उन समावयवों के आईयूपीएसी नाम लिखिए जो नाइट्रस अम्ल के साथ नाइट्रोजन गैस मुक्त करते हैं।
Show Answer
#missingII. डाइऐज़ोनियम लवण
डाइऐंज़ोनियम लवणों का सामान्य सूत्र $\mathrm{R} \stackrel{+}{\mathrm{N}} 2 \mathrm{X}$ होता है। यहाँ $\mathrm{R}$ एक ऐरिल समूह है तथा $\overline{\mathrm{X}}$ आयन $\mathrm{Cl}^{-}, \mathrm{Br}^{-}{ }^{-} \mathrm{HSO} _{4}^{-}, \mathrm{BF} _{4}^{-}$आदि में से कोई भी हो सकता है। इनका नामकरण करने के लिए जनक हाईड्राकार्बन के नाम में डाइऐज़ोनियम अनुलग्न लगाने के पश्चात् ॠणायन का नाम जैसे क्लोराइड, हाइड्रोजन सल्फेट आदि लिखते हैं। $\stackrel{+}{N} _{2}$ समूह को डाइऐज़ोनियम समूह कहते हैं। उदाहरण के लिए $\mathrm{C}_6 \mathrm{H}_5 \mathrm{~N}_2^{+} \overline{\mathrm{C}}$ को बेन्जीनडाइऐज़ोनियम क्लोराइड तथा $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{~N} _{2}^{+} \mathrm{HSO} _{4}^{-}$ को बेन्जीन डाइऐज़ोनियम हाइड्रोजनसल्फेट कहते हैं।
ऐलिफैटिक प्राथमिक ऐमीन अति अस्थायी ऐल्किल डाइऐज़ोनयम लवण बनाती हैं (खंड 9.6)। ऐरोमैटिक प्राथमिक ऐमीन ऐरीनडाइऐज़ोनियम लवण बनाती हैं जो विलयन में निम्न ताप पर (273-278 K) अल्प समय के लिए स्थायी होते हैं। ऐरीनडाइऐज़ोनियम आयन के स्थायितत्व को अनुनाद के आधार पर समझा जा सकता है।

9.7 डाइड्डोनियम लवणों के विरचन की विधि
बेन्जीनडाइऐज़ोनियम क्लोराइड को ऐनिलीन एवं नाइट्रस अम्ल की अभिक्रिया द्वारा 273-278K ताप पर बनाया जाता है। नाइट्रस अम्ल को अभिक्रिया मिश्रण में ही सोडियम नाइट्राइट तथा हाइड्रोक्लोरिक अम्ल की अभिक्रिया से उत्पन्न करते हैं। प्राथमिक ऐरोमैटिक ऐमीन के डाइऐज़ोनियम में परिवर्तन को डाइऐज़ोकरण कहते हैं। अस्थायी प्रकृति के कारण डाइऐंज़ोनियम लवण का भंडारण नहीं करते और बनते ही तुरंत प्रयोग कर लेते हैं।
$$\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2}+\mathrm{NaNO} _{2}+2 \mathrm{HCl} \xrightarrow{273-278 \mathrm{~K}} \mathrm{C} _{6} \mathrm{H} _{5} \mathrm{~N} _{2}^{+} \mathrm{Cl}^{-}+\mathrm{NaCl}+2 \mathrm{H} _{2} \mathrm{O}$$
9.8 भौतिक शुण
बेन्जीनडाइऐज़ोनियम क्लोराइड एक रंगहीन क्रिस्टलीय ठोस है। यह जल में विलेय तथा ठंडे में स्थायी है किंतु गरम करने पर जल से अभिक्रिया करता है यह ठोस अवस्था में आसानी से विघटित हो जाता है। बेन्जीन डाइऐज़ोनियमफ्लुओबोरेट जल में अविलेय तथा कक्ष ताप पर स्थायी होता है।
9.9 राभायनिक अभिक्रियाएँ
डाइऐज़ोनियम लवणों की अभिक्रियाओं को मुख्य रूप से दो संवर्गों में बाँटा जा सकता है। (क) नाइट्रोजन प्रतिस्थायन अभिक्रियाएं तथा (ख) अभिक्रियाएं जिनमें डाइऐज़ोसमूह सुरक्षित (Retention) रहता है।
( क) नाइट्रोजन प्रतिस्थापन अभिक्रियाएँ डाइऐज़ोनियम समूह एक उत्तम अवशिष्ट समूह (Leaving group) होने के कारण $\mathrm{Cl}^{-}, \mathrm{Br}^{-}, \mathrm{I}^{-}, \mathrm{CN}^{-}$एवं $\mathrm{OH}$ आदि समूहों द्वारा सरलता से प्रतिस्थापित हो जाता है। ये समूह ऐरोमैटिक वलय से नाइट्रोजन मुक्त करते हैं। बनी हुई नाइट्रोजन अभिक्रिया मिश्रण से गैस के रूप में निकल जाती है।
1. हैलाइड अथवा सायनाइड आयन द्वारा प्रतिस्थापन बेन्जीन वलय में $\mathrm{Cl}^{-}, \mathrm{Br}^{-}$तथा $\mathrm{CN}^{-}$नाभिकरागियों को $\mathrm{Cu}(\mathrm{I})$ की उपस्थिति में सरलता से प्रवेश कराया जा सकता है। इस अभिक्रिया को सैन्डमायर अभिक्रिया कहते हैं।
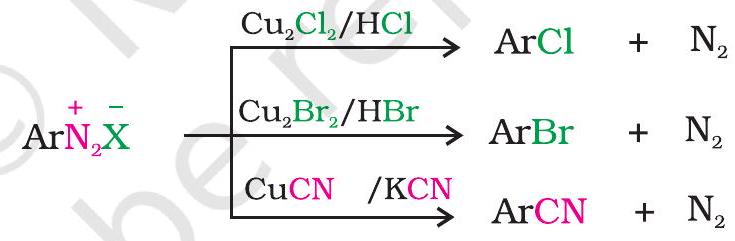
दूसरी ओर ताम्रचूर्ण की उपस्थिति में डाइऐज़ोनियम लवण के विलयन की संगत हैलोजन अम्ल से अभिक्रिया द्वारा क्लोरीन अथवा ब्रोमीन को भी बेन्जीन वलय में जोड़ा जा सकता है। इस अभिक्रिया को गाटरमान अभिक्रिया कहते हैं।

गाटरमान अभिक्रिया की तुलना में सैन्डमायर अभिक्रिया की लब्धि अधिक होती है।
2. आयोडाइड आयन द्वारा प्रतिस्थापन आयोडीन को सीधे बेन्जीन वलय में सरलता से नहीं जोड़ा जा सकता; किंतु जब डाइऐज़ोनियम लवण के विलयन की अभिक्रिया पोटैशियम आयोडाइड से कराते हैं तो आयोडोबेन्जीन बनती है।
$\stackrel{+}{\mathrm{ArN}} \overline{\mathrm{Cl}}+\mathrm{HBF}_4 \rightarrow \mathrm{Ar}-\stackrel{+}{\mathrm{N}} \mathrm{BF}_4 \xrightarrow{\Delta} \mathrm{Ar}-\mathrm{F}+\mathrm{BF}_3+\mathrm{N}_2$
3. फ्लुओराइड आयन द्वारा प्रतिस्थापन जब ऐरीनडाइऐज़ोनियम क्लोराइड की अभिक्रिया फ्लुओरोबोरिक अम्ल से कराते हैं तो ऐरीन डाइऐज़ोनियम फ्लुओरोबोरेट अवक्षेपित हो जाता है, जो गरम करने पर विघटित होकर ऐरिल फ्लुओराइड देता है।
$$ \mathrm{Ar} _{2}^{+} \overline{\mathrm{Cl}}+\mathrm{HBF} _{4} \longrightarrow \mathrm{Ar}-\stackrel{+}{\mathrm{N}} _{2} \mathrm{BF} _{4} \xrightarrow{\Delta} \mathrm{Ar}-\mathrm{F}+\mathrm{BF} _{3}+\mathrm{N} _{2} $$
4. $\mathrm{H}$ द्वारा प्रतिस्थापन हाइपोफ़ास्फ़ोरस अम्ल (फ़ॉस्फ़िनिक अम्ल) अथवा एथेनॉल जैसे दुर्बल अपचयन कर्मक डाइऐज़ोनियम लवणों को ऐरीनों में अपचित कर देते हैं और स्वयं क्रमशः फ़ोस्फ़ोरस अम्ल अथवा एथेनैल में ऑक्सीकृत हो जाते हैं।
$\mathrm{Ar}_2^{+} \stackrel{+}{\mathrm{Cl}}+\mathrm{H}_3 \mathrm{PO}_2+\mathrm{H}_2 \mathrm{O} \longrightarrow \mathrm{ArH}+\mathrm{N}_2+\mathrm{H}_3 \mathrm{PO}_3+\mathrm{HCl}$
$$ \begin{aligned} & \mathrm{ArN} _{2} \stackrel{+}{\mathrm{Cl}}+\mathrm{CH} _{3} \mathrm{CH} _{2} \mathrm{OH} \longrightarrow \mathrm{ArH}+\mathrm{N} _{2}+\mathrm{CH} _{3} \mathrm{CHO}+\mathrm{HCl} \end{aligned} $$
5. हाइड्रॉक्सिल समूह द्वारा प्रतिस्थापन यदि डाइऐज़ोनियम लवण विलयन का ताप $283 \mathrm{~K}$ तक बढ़ने दिया जाए तो लवण जलअपघटित होकर फीनॉल देते हैं।
$$ \mathrm{Ar} _{2}^{+} \stackrel{-}{\mathrm{Cl}}+\mathrm{H} _{2} \mathrm{O} \longrightarrow \mathrm{ArOH}+\mathrm{N} _{2}+\mathrm{HCl} $$
6. $-\mathrm{NO} _{2}$ समूह द्वारा प्रतिस्थापन जब डाइऐज़ोनियम फलुओरोबोरेट को कॉपर की उपस्थिति में सोडियम नाइट्राइट के जलीय विलयन में गरम किया जाता है, तब डाइऐज़ोनियम समूह, $-\mathrm{NO} _{2}$ समूह द्वारा प्रतिस्थापित हो जाता है।
(ख) अभिक्रियाएँ जिनमें डाइएज़ो समूह सुरक्षित रहता है युग्मन अभिक्रियाएँ
युग्मन अभिक्रिया से प्राप्त ऐज़ो उत्पादों में दोनों ऐरोमैटिक वलयों एवं इन्हें जोड़ने वाले $-\mathrm{N}=\mathrm{N}-$ आबंध के बीच विस्तारित संयुग्मन होता है। ये यौगिक प्राय: रंगीन होते हैं तथा रंजकों की तरह प्रयोग में आते हैं। बेन्जीन डाइएज़ोनियम क्लोराइड फ़ीनॉल से अभिक्रिया करने पर इसके पैरा स्थान पर युग्मित होकर पैरा हाइड्रोक्सीऐज़ोबेन्जीन बनाता है। इसी प्रकार की अभिक्रिया को युग्मन अभिक्रिया कहते हैं। इसी प्रकार से डाइऐज़ोनियम लवण की एनीलीन से अभिक्रिया द्वारा पेराऐमीनोऐजोबेन्जीन बनती है। यह एक इलेक्ट्रॉनरागी अभिक्रिया का उदाहरण है।

9.10 इरोमेटिक यौगिकों के संश्लेषण में डाइडेजोलवणों का महत्व
उपरोक्त अभिक्रियाओं से यह स्पष्ट है कि डाइऐज़ोनियम लवण बेन्जीन वलय में $-\mathrm{F},-\mathrm{Cl}$, $-\mathrm{Br},-\mathrm{I},-\mathrm{CN},-\mathrm{OH},-\mathrm{NO} _{2}$ आदि समूहों के प्रवेश के लिए उत्तम माध्यमिक हैं।
ऐरिल फ्लुओराइड एवं आयोडाइड को सीधे हैलोजनन द्वारा नहीं बनाया जा सकता। क्लोरोबेन्जीन में क्लोरीन के नाभिकरागी प्रतिस्थापन द्वारा सायनाइड समूह का प्रवेश नहीं कराया जा सकता, किंतु डाइऐज़ोनियम लवण से सायनोबेन्जीन को सरलता से बनाया जा सकता है।
अतः डाइऐज़ो समूह का अन्य समूहों द्वारा प्रतिस्थापन ऐसे ऐरोमैटिक प्रतिस्थापित यौगिकों को बनाने में सहायक है, जो सीधे बेन्जीन अथवा प्रतिस्थापित बेन्जीन से नहीं बनते।
उदाहरण 9.5 आप 4-नाइट्रोटॉलूईन को 2-ब्रोमोबेन्ज़ोइक अम्ल में कैसे परिवर्तित करेंगे?
हल

पाठ्यनिहित प्रश्न
9.9 निम्नलिखित परिवर्तन कीजिए।
(i) 3-मेथिलऐनिलीन से 3-नाइट्रोटॉलूईन
(ii) ऐनिलीन से $1,3,5$-ट्राइब्रोमोबेन्जीन
सारांश
ऐमीनों को अमोनिया के हाइड्रोजन परमाणुओं का ऐल्किल अथवा ऐरिल समूहों से प्रतिस्थापित व्युत्पन्न मान सकते हैं। अमोनिया में एक हाइड्रोजन परमाणु के प्रतिस्थापन से प्राप्त संरचना $\mathbf{R}-\mathbf{N H} _{\mathbf{2}}$ को प्राथमिक ऐमीन कहते हैं। द्वितीयक ऐमीन को $\mathbf{R}-\mathbf{N H R} R^{\prime}$ अथवा $\mathbf{R} _{2} \mathbf{N H}$ संरचना से तथा तृतीयक ऐमीनों को $\mathbf{R} _{3} \mathbf{N}, \mathbf{R N R}^{\prime} \mathbf{R}^{\prime \prime}$ अथवा $\mathbf{R} _{2} \mathbf{N R}^{\prime}$ संरचना द्वारा प्रदर्शित करते हैं। द्वितीयक एवं तृतीयक ऐमीन को सभी एल्किल समूह समान होने पर सरल ऐमीन तथा भिन्न होने पर मिश्रित ऐमीन कहते हैं। अमोनिया की भाँति तीनों तरह की ऐमीनों में नाइट्रोजन पर एक असहभाजित इलेक्ट्रॉन युगल होता है जिसके कारण ये लूईस क्षारक की तरह व्यवहार करती हैं।
ऐमीन प्राय: नाइट्रो, हैलाइड, ऐमाइड, इमाइड इत्यादि यौगिकों से बनती हैं। ये हाइड्रोजन आबंधन प्रदर्शित करती हैं जिससे इनके भौतिक गुण प्रभावित होते हैं। ऐल्किल ऐमीन में इलेक्ट्रॉन त्यागने, त्रिविम, तथा $\mathrm{H}$-आबंधन कारक प्रोटिक विलायक में प्रतिस्थापित अमोनियम धनायन के स्थायित्व अर्थात् क्षारकता को प्रभावित करते हैं। ऐल्किल ऐमीन अमोनिया से प्रबल क्षारक होते हैं। ऐरोमैटिक अमीन में इलेक्ट्रॉन विमोचक व अपनयक समूह क्रमशः क्षारकता में वृद्धि एवं ह्रास करते हैं। ऐनिलीन अमोनिया से दुर्बल क्षारक है। ऐमीनों की अभिक्रियाएं नाइट्रोजन पर उपस्थित असहभाजित इलेक्ट्रॉन युगल की उपलब्धता द्वारा निर्धारित होती हैं। नाइट्रोजन परमाणु पर उपस्थित हाइड्रोजन परमाणुओं की संख्या का अभिक्रिया के प्रकार तथा प्राप्त उत्पाद की प्रकृति पर प्रभाव प्राथमिक, द्वितीयक एवं तृतीयक ऐमीनों की पहचान तथा विभेद के लिए उत्तरदायी है। पेराटॉलूईनसल्फोनिल क्लोराइड प्राथमिक, द्वितीयक एवं तृतीयक एमीनों की पहचान के लिए प्रयोग में लाया जाता है। बेन्जीन वलय में ऐमीनो समूह की उपस्थिति ऐरोमैटिक ऐमीन की अभिक्रियाशीलता को बढ़ा देती है। ऐरोमैटिक ऐमीनों की अभिक्रियाशीलता को ऐसिलन द्वारा नियंत्रित किया जा सकता है। ऐसिलन में एमीन की ऐसिल क्लोराइड अथवा ऐसीटिक एनहाइड्राइड से अभिक्रिया कराते हैं। ट्राइमेथिलएमीन जैसी तृतीयक ऐमीन का प्रयोग कीट आकर्षणकर्मक के रूप में किया जाता है।
प्रायः ऐरिलऐमीन से प्राप्त किए जाने वाले ऐरिलडाइएज़ोनियम लवण; विभिन्न प्रकार के नाभिकरागियों द्वारा प्रतिस्थापित किए जा सकते हैं जिससे डाइएज़ो समूह के अपचायक निष्कासन द्वारा ऐरिल हैलाइड, सायनाइड, फ़ीनॉल तथा ऐरीन प्राप्त करने की लाभप्रद विधि उपलब्ध होती है। डाइऐज़ोनियम लवण की फ़ीनॉल अथवा ऐरिल ऐमीन के साथ युग्मन अभिक्रिया से ऐज़ो रंजक प्राप्त होते हैं।
अभ्यास
9.1 निम्नलिखित यौगिकों को प्राथमिक द्वितीयक एवं तृतीयक ऐमीनों में वर्गीकृत कीजिए तथा इनके आइयूपीएसी नाम लिखिए।
(i) $\left(\mathrm{CH} _{3}\right) _{2} \mathrm{CHNH} _{2}$
(ii) $\mathrm{CH} _{3}\left(\mathrm{CH} _{2}\right) _{2} \mathrm{NH} _{2}$
(iii) $\mathrm{CH} _{3} \mathrm{NHCH}\left(\mathrm{CH} _{3}\right) _{2}$
(iv) $\left(\mathrm{CH} _{3}\right) _{3} \mathrm{CNH} _{2}$
(v) $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NHCH} _{3}$
(vi) $\left(\mathrm{CH} _{3} \mathrm{CH} _{2}\right) _{2} \mathrm{NCH} _{3}$
(vii) $m-\mathrm{BrC} _{6} \mathrm{H} _{4} \mathrm{NH} _{2}$
Show Answer
#missing9.2 निम्नलिखित युगलों के यौगिकों में विभेद के लिए एक रासायनिक परीक्षण दीजिए-
(i) मेथिलऐमीन एवं डाइमेथिलऐमीन
(ii) द्वितीयक एवं तृतीयक ऐमीन
(iii) ऐथलऐमीन एवं ऐनिलीन
(iv) ऐनिलीन एवं बेन्जिलऐमीन
(v) ऐनिलीन एवं $\mathrm{N}$ मेथिलऐनिलीन।
Show Answer
#missing9.3 निम्नलिखित के कारण बताइए-
(i) ऐनिलीन का $p \mathrm{~K} _{\mathrm{b}}$ मेथिलऐमीन की तुलना में अधिक होता है।
(ii) ऐथिलऐमीन जल में विलेय है जबकि ऐनिलीन नहीं।
(iii) मेथिलऐमीन फेरिक क्लोराइड के साथ जल में अभिक्रिया करने पर जलयोजित फेरिक आक्साइड का अवक्षेप देता है।
(iv) यद्यपि ऐमीनों समूह इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाओं में आर्थो एव पैरा निर्देशक होता है फिर भी ऐनिलीन नाइट्रोकरण द्वारा यथेष्ट मात्रा में मेटानाइट्रोऐनीलीन देती है।
(v) ऐनिलीन फ़िडेल क्राफ्ट्स अभिक्रिया प्रदर्शित नहीं करती।
(vi) ऐरोमैटिक ऐमीनों के डाइऐज़ोनियम लवण ऐलीफैटिक ऐमीनों से प्राप्त लवण से अधिक स्थायी होते हैं।
(vii) प्राथमिक ऐमीन के संश्लेषण में गैब्रिएल थैलिमाइड संश्लेषण को प्राथमिकता दी जाती है।
Show Answer
#missing9.4 निम्नलिखित को क्रम में लिखिए-
(i) $p \mathrm{~K} _{\mathrm{b}}$ मान के घटते क्रम में-
$\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{NH} _{2}, \mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NHCH} _{3},\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{2} \mathrm{NH}$ एवं $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2}$
(ii) क्षारकीय प्राबल्य के घटते क्रम में-
$\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2}, \mathrm{C} _{6} \mathrm{H} _{5} \mathrm{~N}\left(\mathrm{CH} _{3}\right) _{2},\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{2} \mathrm{NH}$ एवं $\mathrm{CH} _{3} \mathrm{NH} _{2}$
(iii) क्षारकीय प्राबल्य के बढ़ते क्रम में-
(क) ऐनिलीन, पैरा-नाइट्रोऐनिलीन, एवं पैरा-टॉलूडीन
(ख) $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2}, \mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NHCH} _{3}, \mathrm{C} _{6} \mathrm{H} _{5} \mathrm{CH} _{2} \mathrm{NH} _{2}$
(iv) गैस अवस्था में घटते हुए क्षारकीय प्राबल्य के क्रम में-
$\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{NH} _{2},\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{2} \mathrm{NH},\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{3} \mathrm{~N}$ एवं $\mathrm{NH} _{3}$
(v) क्वथनांक के बढ़ते क्रम में-
$\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OH},\left(\mathrm{CH} _{3}\right) _{2} \mathrm{NH}, \mathrm{C} _{2} \mathrm{H} _{5} \mathrm{NH} _{2}$
(vi) जल में विलेयता के बढ़ते क्रम में-
$\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2},\left(\mathrm{C} _{2} \mathrm{H} _{5}\right) _{2} \mathrm{NH}, \mathrm{C} _{2} \mathrm{H} _{5} \mathrm{NH} _{2}$
Show Answer
#missing9.5 इन्हें आप कैसे परिवर्तित करेंगे-
(i) एथेनॉइक अम्ल को मेथेनेमीन में
(ii) हैक्सेननाइट्राइल को 1-ऐमीनोपेन्टेन में
(iii) मेथेनॉल को एथेनॉइक अम्ल में
(iv) एथेनेमीन को मेथेनेमीन में
(v) एथेनॉइक अम्ल को प्रोपेनॉइक अम्ल में
(vi) मेथेनेमीन को ऐथेनेमीन में
(vii) नाइट्रोमेथेन को डाइमेथिलऐमीन में
(viii) प्रोपेनॉइक अम्ल को ऐथेनॉइक अम्ल में?
Show Answer
#missing9.6 प्राथमिक, द्वितीयक एवं तृतीयक ऐमीनों की पहचान की विधि का वर्णन कीजिए। इन अभिक्रियाओं के रासायनिक समीकरण भी लिखिए।
Show Answer
#missing9.7 निम्न पर लघु टिप्पणी लिखिए-
(i) कार्बिलऐमीन अभिक्रिया
(ii) डाइऐज़ोकरण
(iii) हॉफमान ब्रोमेमाइड अभिक्रिया
(iv) युग्मन अभिक्रिया
(v) अमोनीअपघटन
(vi) ऐसीटिलन
(vii) गैब्रिएल थैलिमाइड संश्लेषण
Show Answer
#missing9.8 निम्न परिवर्तन निष्पादित कीजिए-
(i) नाइट्रोबेन्जीन सें बेन्ज़ोइक अम्ल
(ii) बेन्जीन से $m$-ब्रोमोफीनॉल
(iii) बेन्ज़ोइक अम्ल से ऐनिलीन
(iv) ऐनिलीन से 2, 4, 6-ट्राइब्रोमोफ्लुओरोबेन्ज़ीन
(v) बेन्ज़िल क्लोराइड से 2-फ़ेनिलएथेनेमीन
(vi) क्लोरोबेन्ज़ीन से $p$-क्लोरोऐनिलीन
(vii) ऐनिलीन से $p$-ब्रोमोऐनिलीन
(viii) बेन्ज़एएमाइड से टॉलूईन
(ix) ऐनीलीन से बेन्ज़ाइल ऐल्कोहॉल।
Show Answer
#missing9.9 एक ऐरोमैटिक यौगिक ’ $\mathrm{A}$ ’ जलीय अमोनिया के साथ गरम करने पर यौगिक ’ $\mathrm{B}$ ’ बनाता है जो $\mathrm{Br} _{2}$ एवं $\mathrm{KOH}$ के साथ गरम करने पर अणु सूत्र $\mathrm{C} _{6} \mathrm{H} _{7} \mathrm{~N}$ वाला यौगिक ’ $\mathrm{C}$ ’ बनाता है। $\mathrm{A}, \mathrm{B}$ एवं $\mathrm{C}$ यौगिकों की संरचना एवं इनके आइयूपीएसी नाम लिखिए।
Show Answer
#missing9.10 निम्नलिखित अभिक्रियाओं को पूर्ण कीजिए-
(i) $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2}+\mathrm{CHCl} _{3}+$ (ऐल्कोहॉली ) $\mathrm{KOH} \rightarrow$
(ii) $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{~N} _{2} \mathrm{Cl}+\mathrm{H} _{3} \mathrm{PO} _{2}+\mathrm{H} _{2} \mathrm{O} \rightarrow$
(iii) $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2}+\mathrm{H} _{2} \mathrm{SO} _{4}$ (सांद्र) $\rightarrow$
(iv) $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{~N} _{2} \mathrm{Cl}+\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OH} \rightarrow$
(v) $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2}+\mathrm{Br} _{2}($ aq) $\rightarrow$
(vi) $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH} _{2}+\left(\mathrm{CH} _{3} \mathrm{CO}\right) _{2} \mathrm{O} \rightarrow$
(vii) $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{~N} _{2} \mathrm{Cl} \xrightarrow[\text { (ii) } \mathrm{NaNO} _{2} / \mathrm{Cu}, \Delta]{\left(\text { i) } \mathrm{HBF} _{4}\right.}$
Show Answer
#missing9.11 ऐरोमैटिक प्राथमिक ऐमीन को गैब्रिएल थैलिमाइड संश्लेषण से क्यों नहीं बनाया जा सकता?
Show Answer
#missing9.12 ऐलीफैटिक एवं ऐरोमैटिक प्राथमिक ऐमीनों की नाइट्रस अम्ल से अभिक्रिया लिखिए।
Show Answer
#missing9.13 निम्नलिखित में प्रत्येक का संभावित कारण बताइए-
(i) समतुल्य अणु द्रव्यमान वाले ऐमीनों की अम्लता ऐल्कोहॉलों से कम होती है।
(ii) प्राथमिक ऐमीनों का क्वथनांक तृतीयक एमीनों से अधिक होता है।
(iii) ऐरोमैटिक ऐमीनों की तुलना में ऐलीफैटिक ऐमीनों प्रबल क्षारक होते हैं।










