एकक 11 ऐल्कोहॉल, फ़ीनॉल एवं ईथर
ऐल्कोहॉल, फ्रीनॉल और ईथर क्रमशः अपमार्जक, पूतिरोधी एवं सुगंधि बनाने के मूल यौगिक हैं।
आपने पढ़ा है कि किसी हाइड्रोकार्बन के एक या उससे अधिक हाइड्रोजन परमाणुओं के दूसरे परमाणु या परमाणुओं के समूहों द्वारा प्रतिस्थापन से पूर्णतः नए यौगिकों का निर्माण होता है, जिनके गुणधर्म और अनुप्रयोग बिलकुल भिन्न होते हैं। जब ऐलिफ़ैटिक और ऐरोमैटिक हाइड्रोकार्बन का कोई हाइड्रोजन परमाणु हाइड्रॉक्सिल समूह द्वारा प्रतिस्थापित होता है तो क्रमशः ऐल्कोहॉल तथा फ़ीनॉल बनते हैं। इन वर्गों के यौगिकों के, उद्योगों और हमारे दैनिक जीवन में अनेक अनुप्रयोग हैं। उदाहरणार्थ, क्या आपने कभी ध्यान दिया है कि लकड़ी के फ़र्नीचर की पॉलिश में प्रयुक्त होने वाली सामान्य स्प्रिट मुख्य रूप से हाइड्रॉक्सिल समूह युक्त यौगिक एथेनॉल है। खाद्य शर्करा, वस्त्रों में प्रयुक्त कपास, लिखने के लिए कागज़, सभी $-\mathrm{OH}$ समूह युक्त यौगिकों से निर्मित हैं। आप ज़रा, कागज़ के बिना जीवन के बारे में कल्पना करें; जब कोई पुस्तक, पुस्तिका, समाचार पत्र, मुद्रा-नोट, चैक, प्रमाणपत्र नहीं होंगे। सुन्दर चित्रों तथा रुचिकर कहानियों वाली पत्रिकाएं हमारे जीवन से विलुप्त हो जाएंगी। यह वास्तव में एक भिन्न संसार होगा।
ऐल्कोहॉल में एक अथवा अधिक हाइड्रॉक्सिल $(-\mathrm{OH})$ समूह, ऐलिफ़ैटिक तंत्र $(\mathrm{R}-\mathrm{OH})$ के कार्बन परमाणु (परमाणुओं) से सीधे जुड़े होते हैं जबकि फ़ीनॉल में हाइड्रॉक्सिल $(-\mathrm{OH})$ समूह ऐरोमैटिक तंत्र $(\mathrm{Ar}-\mathrm{OH})$ के कार्बन परमाणु (परमाणुओं) से सीधे जुड़े होते हैं।
ऐल्कॉक्सी अथवा ऐरिलॉक्सी ( $\mathrm{R}-\mathrm{O} / \mathrm{ArO})$ समूह द्वारा हाइड्रोजन के प्रतिस्थापन से यौगिकों का एक दूसरा वर्ग प्राप्त होता है; जिन्हें ईथर कहते हैं। उदाहरणार्थ, $\mathrm{CH} _{3} \mathrm{OCH} _{3}$ (डाइमेथिल ईथर)। आप यह भी कल्पना कर सकते हैं कि ईथर वह यौगिक हैं जो किसी ऐल्कोहॉल अथवा फ़ीनॉल के हाइड्रॉक्सिल समूह की हाइड्रोजन के, किसी एल्किल या एरिल समूह द्वारा विस्थापन से बनती हैं। इस एकक में, हम तीन वर्गों के यौगिकों के बारे में पढ़ेंगे; यह हैं- ऐल्कोहॉल, फ़ीनॉल एवं ईथर।
7.1 वर्गीकरण
यौगिकों के वर्गीकरण से उनका अध्ययन क्रमबद्ध एवं सरल हो जाता है। इसलिए आइए, हम पहले यह सीखें कि ऐल्कोहॉलों, फ़ीनॉलों एवं ईथरों को किस प्रकार वर्गीकृत किया जाता है?
7.1.1 एल्कोहॉल मोनो, डाइ, ट्राइ एवं पॉलीहाइड्रिक एल्कोहॉल
ऐल्कोहॉलों और फ़ीनॉलों को उनके यौगिकों में उपस्थित एक (मोनो-), दो (डाइ-), तीन (ट्राइ-) अथवा अधिक हाइड्रॉक्सिल $(-\mathrm{OH})$ समूहों की संख्या के अनुसार क्रमशः मोनो, डाइ, ट्राइ अथवा पॉलीहाइड्रिक यौगिकों में वर्गीकृत किया जाता है, जैसा कि निम्नलिखित संरचनाओं में दिखाया गया है-
$ \underset{\text{मोनोहाइड्रिक}}{\mathrm{C_2}\mathrm{H_5}\mathrm{OH}} \quad\quad\quad$ $\underset{\text{डाइहाइड्रिक}}{\underset{\large\mathrm{CH_2}\mathrm{OH}}{\large\underset{\text{|}}{\mathrm{C}}\mathrm{H_2OH}}}$ $\quad\quad\quad$ $ \large\underset{\text{ट्राइहाइड्रिक}}{\large\stackrel{\stackrel{\large\mathrm{CH_2OH}}{\large\stackrel{\text{|}}{\mathrm{C}}\mathrm{HOH}}}{\large\stackrel{\large\text{|}}{\mathrm{C}}\mathrm{H_2OH}}} $
मोनोहाइड्रिक ऐल्कोहॉलों को हाइड्रॉक्सिल समूह से जुड़े कार्बन परमाणु की संकरण अवस्था के अनुसार पुन: वर्गीकृत किया जा सकता है।
(i) यौगिक जिनमें $\left(\mathrm{C} _{s p^{3}}-\mathrm{OH}\right)$ आबंध उपस्थित हो ऐल्कोहॉलों के इस वर्ग में हाइड्रॉक्सिल $(-\mathrm{OH})$ समूह ऐल्किल समूह के $s p^{3}$ संकरित कार्बन परमाणु से जुड़ा होता है। इन्हें पुनः निम्नलिखित प्रकार से वर्गीकृत किया जा सकता है-
प्राथमिक, द्वितीयक तथा तृतीयक ऐल्कोहॉल- इन तीन प्रकार के ऐल्कोहॉलों में हाइड्रॉक्सिल $(-\mathrm{OH})$ समूह क्रमशः प्राथमिक, द्वितीयक तथा तृतीयक कार्बन परमाणु से जुड़ा होता है, जैसा कि नीचे दर्शाया गया है-
ऐलिलिक ऐल्कोहॉल- इस प्रकार के ऐल्कोहॉल में - $\mathrm{OH}$ समूह, कार्बन-कार्बन द्विक्आबंध से अगले $s p^3$ संकरित कार्बन परमाणु पर अर्थात् ऐलिलिक कार्बन परमाणु से जुड़ा होता है।
बेन्ज़िलिक ऐल्कोहॉल- इस प्रकार के ऐल्कोहॉल में - $\mathrm{OH}$ समूह ऐरोमैटिक वलय से अगले $s p^{3}$ संकरित कार्बन परमाणु पर जुड़ा होता है। उदाहरणार्थ-

ऐलिलिक एवं बेंज़िलिक ऐल्कोहॉल भी प्राथमिक, द्वितीयक अथवा तृतीयक हो सकती हैं।
(ii) यौगिक जिनमें $\left(\mathrm{C} _{s p^{2}}-\mathrm{OH}\right)$ आबंध उपस्थित हो इन ऐल्कोहॉलों में -OH समूह कार्बन-कार्बन द्विक्आबंध जैसे वाइनिलिक कार्बन या ऐरिल कार्बन से जुड़ा होता है इन्हें वाइनिलिक ऐल्कोहॉल भी कहते हैं।
वाइनिलिक ऐल्कोहॉल- $\mathrm{CH} _{2}=\mathrm{CH}-\mathrm{OH}$
पाठ्यनिहित प्रश्न
7.1 निम्नलिखित को प्राथमिक, द्वितीयक एवं तृतीयक ऐल्कोहॉल में वर्गीकृत कीजिए-
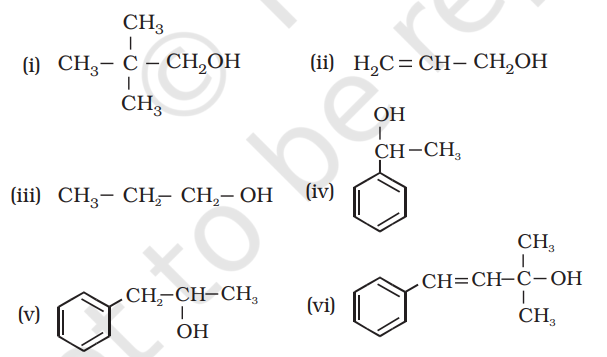
Show Answer
#missing7.2 उपरोक्त उदाहरणों में से ऐलिलिक ऐल्कोहॉलों को पहचानिए।
Show Answer
#missing7.1.2 फ़ीनॉल मोनो, डाइ एवं ट्राई हाइड्रिक फ़ीनोलों

7.1.3 ईथर
फ़ीनोलों को भी हाइड्रॉक्सिल समूह की संख्या के अुनसार मोनो, डाई एवं ट्राई हाइड्रिक में वर्गीकृत किया जाता है। फ़ीनॉल ईथरों में यदि ऑक्सीजन परमाणु से जुड़े दोनों ऐल्किल अथवा ऐरिल समूह एक समान हों तो उन्हें सरल अथवा सममित ईथर और यदि ये दोनों समूह भिन्न-भिन्न हों तो इन्हें मिश्रित अथवा असममित ईथर में वर्गीकृत करते हैं। $\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OC} _{2} \mathrm{H} _{5}$ एक सममित ईथर है जबकि $\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OCH} _{3}$ तथा $\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OC} _{6} \mathrm{H} _{5}$ असममित ईथर हैं।
7.2 नामपद्धति
(क) ऐल्कोहॉलऐल्कोहॉल के सामान्य नाम को व्युत्पन्न करने के लिए, हाइड्रॉक्सिल समूह से जुड़े ऐल्किल समूह के सामान्य नाम के साथ ऐल्कोहॉल शब्द जोड़ा जाता है। उदाहरणार्थ, $\mathrm{CH} _{3} \mathrm{OH}$ मेथिल ऐल्कोहॉल है।
आईयूपीएसी (IUPAC) पद्धति (एकक-8, कक्षा-11) के अनुसार ऐल्कोहॉल का नाम व्युत्पन्न करने के लिए उस ऐल्केन के अंग्रेज़ी में लिखे नाम के अंतिम ’ $\mathrm{e}$ ’ को अनुलग्न ऑल $(\mathrm{ol})$ से प्रतिस्थापित किया जाता है, जिससे उस ऐल्कोहॉल की व्युत्पत्ति हुई है। प्रतिस्थापियों की स्थिति अंकों द्वारा इंगित की जाती है। इसके लिए सबसे लंबी कार्बन शृंखला (जनक शृंखला) का क्रमांकन उस सिरे से करते हैं जो हाइड्रॉक्सिल समूह के समीप हो। $-\mathrm{OH}$ समूह तथा अन्य प्रतिस्थापियों की स्थितियाँ उन कार्बन परमाणुओं के क्रमांक को प्रयुक्त कर दर्शाई जाती हैं जिससे वे जुड़े हों। पॉलिहाइड्रिक ऐल्कोहॉलों का नामकरण करने के लिए ऐल्केन के अंग्रेज़ी के नाम का अंतिम $\mathrm{e}$ उसी प्रकार रखकर अंत में ‘ऑल’ जोड़ दिया जाता है। $-\mathrm{OH}$ समूहों की संख्या को ‘ऑल’ से पहले गुणात्मक पूर्वलग्न, डाइ, ट्राइ आदि लगाकर इंगित किया जाता है। $-\mathrm{OH}$ समूह की स्थिति को उपयुक्त स्थितिसूचक द्वारा इंगित करते हैं। उदाहरणार्थ$\mathrm{HO}-\mathrm{CH} _{2}-\mathrm{CH} _{2}-\mathrm{OH}$ का नाम एथेन-1,2-डाइऑल है। सारणी 7.1 में कुछ ऐल्कोहॉलों के सामान्य एवं आइयूपीएसी नाम दिए गए हैं।
सारणी 7.1 - कुछ ऐल्कोहॉलों के सामान्य तथा आईयूपीएसी नाम
| यौगिक | सामान्य नाम | आईयूपीएसी (IUPAC) नाम |
|---|---|---|
| $\mathrm{CH} _{3}-\mathrm{OH}$ | मेथिल | मेथेनॉल |
| $\mathrm{CH} _{3}-\mathrm{CH} _{2}-\mathrm{CH} _{2}-\mathrm{OH}$ | $\mathrm{n}$ - प्रोपिल ऐल्कोहॉल | प्रोपेन - 1- ऑल |
| $\mathrm{CH} _{3}-\mathrm{CH}-\mathrm{CH} _{3}$ $\mathrm{O}$ $\mathrm{OH}$ | आइसोप्रोपिल ऐल | प्रोपेन -2- ऑल |
| $\mathrm{CH} _{3}-\mathrm{CH} _{2}-\mathrm{CH} _{2}-\mathrm{CH} _{2}-\mathrm{OH}$ | $\mathrm{n}$ - ब्यूटिल ऐल्कोहॉल | ब्यूटेन -1- ऑल |
| $\mathrm{CH} _{3}-\mathrm{CH}-\mathrm{CH} _{2}-\mathrm{CH} _{3}$ OH | द्वितीयक-ब्यूटिल ऐल्कोहॉल | ब्यूटेन -2- ऑल |
| $\underset{\text { I }}{\mathrm{CH} _{3}-\mathrm{CH}}-\mathrm{CH} _{2}-\mathrm{OH}$ | आइसोब्यूटिल ऐल्कोहॉल | 2- मेथिलप्रोपेन-1-ऑल |
| $\mathrm{CH} _{3}-\underset{\text { | }}{\mathrm{C}} \mathrm{C}-\mathrm{OH}$ | तृतीयक-ब्यूटिल ऐल्कोहॉल | 2- मेथिलप्रोपेन-2-ऑल |
| $\mathrm{H} _{2} \mathrm{C}$ $-\mathrm{OH}$ I $\mathrm{H} _{2} \mathrm{C}$ $\mathrm{OH}$ | इथलीन ग्लाईकाल | एथेन- 1,2 ,-डाइऑल |
| $\mathrm{CH} _{2}$ $-\mathrm{CH}-$ $\mathrm{CH} _{2}$ | | | $\mathrm{OH}$ $\mathrm{OH}$ $\mathrm{OH}$ | ग्लिसरॉल | प्रोपेन $-1,2,3$,-ट्राइऑल |
चक्रीय ऐल्कोहॉलों का नामकरण पूर्वलग्न साइक्लो लगाकर तथा $-\mathrm{OH}$ समूह को $\mathrm{C}-1$ पर मानकर किया जाता है।

( ख) फ़ीनॉल बेन्जीन का सबसे सरलतम हाइड्रॉक्सिल व्युत्पन्न फ़ीनॉल है। यह इसका सामान्य नाम तथा आईयूपीएसी द्वारा अनुमत नाम भी है। चूँकि फ़ीनॉल की संरचना में बेन्जीन वलय होती है अतः इसके प्रतिस्थापित यौगिकों में ऑर्थो ( 1,2 द्विप्रतिस्थापित), मेटा ( 1,3 द्विप्रतिस्थापित) तथा पैरा ( 1,4 द्विप्रतिस्थापित) भी प्रायः सामान्य नाम में प्रयुक्त होते हैं।

बेन्जीन के डाइहाइड्रॉंक्सी व्युत्पन्नों को बेन्जीन $1,2-, 1,3-$, या 1,4 -, डाइऑल कहते हैं।
( ग ) ईथर ईथरों के साधारण नाम की व्युत्पत्ति के लिए ऐल्किल अथवा ऐरिल समूहों के नामों को अग्रेज़ी वर्णमाला के वर्णात्मक (alphabatical) क्रम में अलग-अलग लिखकर अंत में ‘ईथर’ शब्द लिखा जाता है। उदाहरण के लिए $\mathrm{CH} _{3} \mathrm{OC} _{2} \mathrm{H} _{5}$ एथिल मेथिल ईथर है। यदि दोनों ऐल्किल समूह समान हों तो ऐल्किल समूह से पूर्वलग्न ‘डाइ’ लगाते हैं। उदाहरणार्थ-
सारणी 7.2 - कुछ ईथरों के साधारण तथा आईयूपीएसी नाम
| यौगिक | साधारण नाम | आईयूपीएसी नाम |
|---|---|---|
| $\mathrm{CH} _{3} \mathrm{OCH} _{3}$ | डाइमेथिल ईथर | मेथॉक्सीमेथेन |
| $\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OC} _{2} \mathrm{H} _{5}$ | डाइएथिल ईथर | एथॉक्सीएथेन |
| $\mathrm{CH} _{3} \mathrm{OCH} _{2} \mathrm{CH} _{2} \mathrm{CH} _{3}$ | मेथिल n-प्रोपिल ईथर | 1-मेथॉक्सीप्रोपेन |
| $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{OCH} _{3}$ | मेथिल फ़ेनिल ईथर ( ऐनिसोल) | मेथॉक्सीबेन्जीन ( ऐनिसोल ) |
| $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{OCH} _{2} \mathrm{CH} _{3}$ | एथिल फ़ेनिल ईथर (फ़ेनीटॉल) | एथॉक्सीबेन्जीन |
| $\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{O}\left(\mathrm{CH} _{2}\right) _{6}-\mathrm{CH} _{3}$ | हेप्टिल फ़ेनिल ईथर | 1-फ़ीनॉक्सी हेप्टेन |
| $\mathrm{CH} _{3} \mathrm{O}-\underset{\mathrm{l}}{\mathrm{CH}}-\mathrm{CH} _{3}$ $\mathrm{CH} _{3}$ | मेथिल आइसोप्रोपिल ईथर | 2-मेथॉक्सीप्रोपेन |
| $\mathrm{C} _{6} \mathrm{H} _{5}-\mathrm{O}-\mathrm{CH} _{2}-\mathrm{CH} _{2}-\underset{1}{\mathrm{CH}}-\mathrm{CH} _{3}$ | फ़ेनिल आइसोपेन्टिल ईथर | 3-मेथिल ब्यूटॉ |
| $\mathrm{CH} _{3}-\mathrm{O}-\mathrm{CH} _{2}-\mathrm{CH} _{2}-\mathrm{OCH} _{3}$ | - | 1,2 -ड |
| - | 2 - एथॉक्सी-1,1-डाइमेथिल साइक्लोहेक्सेन |
यदि दोनों ऐल्किल समूह समान हों तो ऐल्किल समूह से पूर्वलग्न ‘डाइ’ लगाते हैं। उदाहरणार्थ- $\mathrm{C_2} \mathrm{H_5} \mathrm{OC_2} \mathrm{H_5}$
आईयूपीएसी नामपद्धति में, ईथरों को हाइड्रोकार्बनों का व्युत्पन्न माना जाता है जिनके हाइड्रोजन परमाणु $-\mathrm{OR}$ समूह अथवा $-\mathrm{OAr}$ समूह द्वारा प्रतिस्थापित होते हैं, जहाँ $\mathrm{R}$ व $\mathrm{Ar}$ क्रमश: ऐल्किल व ऐरिल समूह हैं। इनमें बड़े ऐल्किल $(R)$ समूह को मूल हाइड्रोकार्बन चुना जाता है। कुछ ईथरों के नाम उदाहरण के रूप में सारणी 7.2 में दिए गए हैं।
उदाहरण 7.1
निम्नलिखित यौगिकों के आईयूपीएसी नाम लिखिए-

हल
(i) 4-क्लोरो-2, 3-डाइमेथिलपेन्टेन-1-ऑल
(iii) 2,6-डाइमेथिलफ़ीनॉल
(ii) 2-एथॉक्सीप्रोपेन
(iv) 1-एथॉक्सी-2-नाइट्रोसाइक्लोहेक्सेन
पाठ्यनिहित प्रश्न
7.3 निम्नलिखित यौगिकों के आईयूपीएसी (IUPAC) नामपद्धति से नाम दीजिए-

Show Answer
#missing7.3 प्रकार्यात्मक समूहों की संरचनाएँ
ऐल्कोहॉलों में - $\mathrm{OH}$ समूह की ऑक्सीजन कार्बन के साथ एक सिग्मा $(\sigma)$ आबंध द्वारा जुड़ी होती है। जो कार्बन के $s p^{3}$ संकरित कक्षक और ऑक्सीजन के $s p^{3}$ संकरित कक्षक के अतिव्यापन द्वारा बनता है। चित्र 7.1 मेथेनॉल, फ़ीनॉल तथा मेथॉक्सीमेथेन के संरचनात्मक पहलुओं को प्रदर्शित करता है।

चित्र 7.1 - मेथेनॉल, फ़ीनॉल तथा मेथॉक्सीमेथेन की संरचनाएँ
ऐल्कोहॉलों में आबंध कोण चतुष्फलकीय कोण $\left(109^{\circ} 28^{\prime}\right)$ से थोड़ा सा कम होता है। ऐसा ऑक्सीजन के असहभाजित इलेक्ट्रॉन युगलों के मध्य प्रतिकर्षण के कारण होता है। फ़ीनॉलों में, $-\mathrm{OH}$ समूह ऐरोमैटिक वलय के $s p^{2}$ संकरित कार्बन के साथ जुड़ा होता है। फ़ीनॉलों के कार्बन-ऑक्सीजन आबंध की लंबाई $(136 \mathrm{pm})$ मेथेनॉल में उपस्थित इस आबंध की लंबाई से थोड़ी कम होती है। इसका कारण है-
(i) ऑक्सीजन के असहभाजित इलेक्ट्रॉन युगल का ऐरोमैटिक वलय के साथ संयुग्मन होना; जिससे यह आबंध आंशिक द्विक्आबंध गुण प्राप्त करता है (खंड 7.4.4) एवं
(ii) उस कार्बन की $s p^{2}$ संकरित अवस्था, जिससे ऑक्सीजन जुड़ी है।
ईथरों में ऑक्सीजन पर उपस्थित चार इलेक्ट्रॉन युगल यानी कि दो आबंधी इलेक्ट्रॉन युगल और दो अनाबंधित इलेक्ट्रॉन युगल, लगभग चतुष्फलकीय रूप में व्यवस्थित होते हैं। दो स्थूल $\mathrm{R}$ समूहों के मध्य प्रतिकर्षक अन्योन्यक्रिया के कारण आबंध कोण चतुष्फलकीय कोण से थोड़ा अधिक होता है। ईथरों में $\mathrm{C}-\mathrm{O}$ आबंध की लंबाई ( $141 \mathrm{pm})$; ऐल्कोहॉलों के $\mathrm{C}-\mathrm{O}$ आबंध की लंबाई के लगभग समान होती है।
7.4 डेल्कोहॉलों और फ़ीनॉलों का विरचन
ऐल्कोहॉलों को निम्नलिखित विधियों द्वारा विरचित किया जाता है-
7.4.1 ऐल्कोहॉलों का विरचन
1. ऐल्कीनो से
(i) अम्ल उत्प्रेरित जलयोजन द्वारा— ऐल्कीन तनु अम्ल की उत्प्रेरकों की तरह उपस्थिति में जल के साथ अभिक्रिया करके ऐल्कोहॉल बनाती हैं। असममित ऐल्कीनों में योगज अभिक्रिया मार्कोनीकॉफ नियम के अनुसार होती है। (एकक-9, कक्षा-11)

क्रियाविधि- अभिक्रिया की क्रियाविधि में निम्नलिखित तीन चरण सम्मिलित होते हैं-
चरण 1- $\mathrm{H} _{3} \mathrm{O}^{+}$के इलेक्ट्रॉनरागी आक्रमण के द्वारा ऐल्कीनों के प्रोटॉनन से कार्बोकैटायन बनते हैं।

हाइड्रोबोरॉनन-आक्सीकरण का विवरण सर्वप्रथम एच. सी. ब्राउन द्वारा 1959 में दिया गया था। बोरॉनयुक्त कार्बनिक यौगिकों के अध्ययन के लिए ब्राउन ने 1979 में रसायन विज्ञान का नोबेल पुरस्कार, जी.विटिग के साथ संयुक्त रूप से प्राप्त किया।
(ii) हाइड्रोबोरॉनन-ऑक्सीकरण के द्वारा- डाइबोरेन $\left(\mathrm{BH} _{3}\right) _{2}$ एल्कीनों से अभिक्रिया करके एक योगज उत्पाद ट्राइऐल्किल बोरेन बनाता है जो जलीय सोडियम हाइड्राक्साइड की उपस्थिति में हाइड्रोजन परआक्साइड द्वारा ऑक्सीकृत होकर ऐल्कोहॉल देता है।

द्विक्आबंध पर बोरेन का योजन इस प्रकार होता है कि बोरॉन परमाणु, उस $s p^{2}$ संकरित कार्बन परमाणु पर जुड़ता है जिस पर पहले से ही अधिक हाइड्रोजन परमाणु उपस्थित होते हैं। इस प्रकार प्राप्त ऐल्कोहॉल, ऐसी दिखती है जैसे कि यह ऐल्कीनों से, मार्कोनीकॉफ के नियम के विपरीत जल योजन से बनी हो। इस अभिक्रिया में ऐल्कोहॉलों की लब्धि उत्तम होती है।
2. कार्बोनिल यौगिकों से
(i) ऐल्डिहाइड व कीटोन के अपचयन द्वारा— ऐल्डिहाइड एवं कीटोन उत्प्रेरक की उपस्थिति में हाइड्रोजन के योजन (उत्प्रेकी हाइड्रोजनन) द्वारा संगत ऐल्कोहॉलों में अपचित हो जाते हैं। सामान्यतः सूक्ष्म विभाजित धातु, जैसे-प्लैटिन, पैलेडियम या निकैल उत्प्रेरक का कार्य करती हैं। ये ऐल्डिहाइड और कीटोनों की सोडियम बोरोहाइड्राइड $\left(\mathrm{NaBH} _{4}\right)$ अथवा लीथियम ऐलुमिनियम हाइड्रॉइड $\left(\mathrm{LiAlH} _{4}\right)$ के साथ अभिक्रिया द्वारा भी बनाई जा सकती हैं। ऐल्डिहाइड प्राथमिक ऐल्कोहॉल देते हैं, जबकि कीटोन द्वितीयक ऐल्कोहॉल देते हैं।
$$ \mathrm{RCHO} + \mathrm{H_2} \xrightarrow[]{\mathrm{Pd}} \mathrm{RCH_2} \mathrm{OH} $$
$$ \mathrm{RCOR^\prime} \xrightarrow[]{\mathrm{NaBH _4}} \mathrm{R}- \underset{\large\mathrm{OH}}{\large\underset{\text{|}}{\mathrm{C}} \mathrm{H}}-\mathrm{R^\prime} $$
तीर के निशान पर, अभिकर्मकों के नाम से पहले लिखी हुई संख्या इंगित करती है कि दूसरा अभिकर्मक तभी प्रयुक्त किया जाता है जब पहले अभिकर्मक के साथ अभिक्रिया पूर्णत: संपन्न हो जाती है।
(ii) कार्बोक्सिलिक अम्लों तथा एस्टरों के अपयचन द्वारा- कार्बोक्सिलिक अम्ल लीथियम ऐलुमिनियम हाइड्राइड जैसे प्रबल अपचायक द्वारा अपचित हो जाते हैं और प्राथमिक ऐल्कोहॉलों की उत्तम लब्धि देते हैं।
$$ \mathrm{RCOOH} \xrightarrow[\text{(ii)}\mathrm{H_2O}]{\text{(i)} \mathrm{LiAlH_4}} \mathrm{RCH_2} \mathrm{OH} $$
$\mathrm{LiAlH} _{4}$ एक महँगा अभिकर्मक है अतः इसका प्रयोग केवल विशेष रसायनों को बनाने के लिए किया जाता है। औद्योगिक स्तर पर कार्बोक्सिलिक अम्लों का ऐल्कोहॉलों में अपचयन करने के लिए उन्हें एस्टर में परिवर्तित कर लिया जाता है (खंड 7.4.4) तत्पश्चात् उत्प्रेरक की उपस्थिति में एस्टर को हाइड्रोजन द्वारा अपचित कर लिया जाता है। (उत्प्रेरकी हाइड्रोजनन )
$$ \mathrm{RCOOH} \xrightarrow[\mathrm{H}^{+}]{\mathrm{R}^{\prime} \mathrm{OH}} \mathrm{RCOOR}^{\prime} \xrightarrow[\text { Catalyst }]{\mathrm{H_2}} \mathrm{RCH_2} \mathrm{OH}+\mathrm{R}^{\prime} \mathrm{OH} $$
3. ग्रीन्यार अभिकर्मकों से
ग्रीन्यार अभिकर्मकों की ऐल्डिहाइड और कीटोन के साथ अभिक्रिया कराने पर ऐल्कोहॉल प्राप्त होती हैं (एकक 6 , कक्षा 12 )।

अभिक्रिया के प्रथम चरण में कार्बोनिल समूह पर ग्रीन्यार अभिकर्मक का नाभिकरागी संयोजन योगोत्पाद बनता है। योगोत्पाद के जल अपघटन से ऐल्कोहॉल प्राप्त होती है।
ग्रीन्यार अभिकर्मक की मेथेनैल द्वारा अभिक्रिया से प्राथमिक ऐल्कोहॉल प्राप्त होती है, अन्य ऐल्डिहाइड द्वितीयक ऐल्कोहॉल तथा कीटोन तृतीयक ऐल्कोहॉल देते हैं।
विभिन्न ऐल्डिहाइडों एवं कीटोनों की समग्र अभिक्रियाएं निम्नलिखित हैं-

आप देख सकते हैं कि मेथेनैल के साथ प्राथमिक ऐल्कोहॉल, किसी अन्य ऐल्डिहाइड के साथ द्वितीयक ऐल्कोहॉल तथा कीटोन के साथ तृतीयक ऐल्कोहॉल प्राप्त होती हैं।
उदाहरण 7.2 निम्नलिखित अभिक्रियाओं के संभव उत्पादों की संरचनाएं तथा उनके आईयूपीएसी नाम दीजिए-
(क) ब्यूटेनैल का उत्प्रेरकी अपचयन
(ख) तनु सल्फ्यूरिक अम्ल की उपस्थिति में प्रोपीन का जलयोजन
(ग) प्रोपेनोन की मेथिलमैग्नीशियम ब्रोमाइड के साथ अभिक्रिया तत्पश्चात् जल अपघटन
हल

7.4 .2 फ़ीनॉलों का विरचन
फ़ीनॉल, जिसे कार्बोलिक अम्ल भी कहते हैं, का पथक्करण सर्वप्रथम उन्नीसवीं शताब्दी के प्रारंभ में कोलतार से किया गया था। आजकल फ़ीनॉल का औद्योगिक उत्पादन संश्लेषण द्वारा किया जाता है। प्रयोगशाला में फ़ीनॉल को बेन्जीन के व्युत्पन्नों से निम्नलिखित में से किसी भी विधि से प्राप्त किया जा सकता है-
1. हैलोऐरीनों से क्लोरोबेन्जीन को $\mathrm{NaOH}$ के साथ $623 \mathrm{~K}$ ताप एवं 320 वायुमंडलीय दाब पर संगलित किया जाता है। इस प्रकार प्राप्त सोडियम फ़ीनॉक्साइड का अम्लन करने पर फ़ीनॉल प्राप्त होती है (एकक 6 , कक्षा 12 )।

2. बेन्जीन सल्फोनिक अम्लों से बेन्जीन का ओलियम द्वारा सल्फोनेशन किया जाता है तथा इससे प्राप्त सल्फोनिक अम्ल को गलित सोडियम हाइड्रॉक्साइड के साथ गरम करके सोडियम फ़ीनॉक्साइड में परिवर्तित कर लिया जाता है। सोडियम लवण के अम्लन से फ़ीनॉल प्राप्त हो जाती है।

3. डाइऐज़ोनियम लवणों से प्राथमिक ऐरोमैटिक ऐमीन की $(273-278 \mathrm{~K})$ ताप पर नाइट्रस अम्ल $\left(\mathrm{NaNO} _{2}+\mathrm{HCl}\right)$ के साथ अभिक्रिया द्वारा डाइऐज़ोनियम लवण बनते हैं। डाइऐज़ोनियम लवण जल के साथ गर्म करने पर अथवा तनु अम्लों के साथ क्रिया करने पर जल अपघटित हो जाते हैं और फ़ीनाल देते हैं (एकक 9, कक्षा 12)।

विश्व में फ़ीनॉल का अधिकतर उत्पादन क्यूमीन से किया जाता है।
4. क्यूमीन से फ़ीनॉल का उत्पादन हाइड्रोकार्बन क्यूमीन से किया जाता है। क्यूमीन (आइसोप्रोपिल बेन्जीन) को वायु की उपस्थिति में क्यूमीन हाइड्रोपरऑक्साइड में ऑक्सीकृत कर लिया जाता है। तनु अम्ल के साथ क्रिया द्वारा इसे फ़ीनॉल तथा ऐसीटोन में परिवर्तित किया जाता है। इस विधि से उत्पादन में इस अभिक्रिया का उपोत्पाद ऐसीटोन भी अधिक मात्रा में प्राप्त होता है।

पाठ्यनिहित प्रश्न
7.4 दर्शाइए कि मेथेनैल पर उपयुक्त ग्रीन्यार अभिकर्मक से अभिक्रिया द्वारा निम्नलिखित ऐल्कोहॉल कैसे विरचित किए जाते हैं?

Show Answer
#missing7.5 निम्नलिखित अभिक्रिया के उत्पादों की संरचना लिखिए-
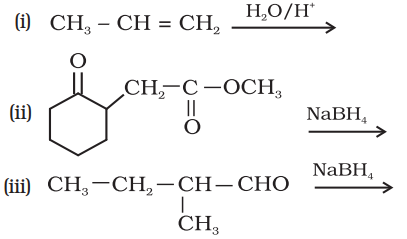
Show Answer
#missing7.4.3 भौतिक गुणधर्म
ऐल्कोहॉलों एवं फ़ीनॉलों के दो भाग होते हैं- एक ऐल्किल/ऐरिल समूह तथा दूसरा हाइड्रॉक्सिल समूह। ऐल्कोहॉलों एवं फ़ीनॉलों के गुणधर्म मुख्यतः $-\mathrm{OH}$ समूह के कारण होते हैं। ऐल्किल और ऐरिल समूह की प्रकृति इन गुणधर्मों को सामान्यतः संशोधित करती हैं
क्वथनांक
ऐल्कोहॉलों और फ़ीनॉलों के क्वथनांक कार्बन परमाणुओं की संख्या में वृद्धि के साथ (वांडरवाल्स बलों में वृद्धि) बढ़ते हैं। ऐल्कोहॉलों में, शाखन के बढ़ने के साथ-साथ (पृष्ठ क्षेत्रफल घटने से वांडरवाल बलों में कमी के कारण) क्वथनांक कम हो जाते हैं।
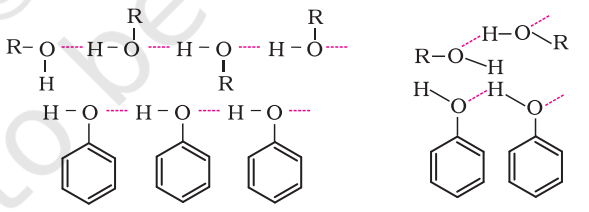
ऐल्कोहॉलों और फ़ीनॉलों में - $\mathrm{OH}$ समूह अंतराआण्विक हाइड्रोजन आबंध बनाते हैं जैसा कि चित्रों में प्रदर्शित किया गया है।
यह रोचक तथ्य है कि लगभग समान आण्विक द्रव्यमान वाले अन्य वर्गों के यौगिकों यानी कि हाइड्रोकार्बनों, ईथरों और हैलोऐल्केनों हैलोऐरीनो के यौगिकों की तुलना में ऐल्कोहॉलों तथा फ़ीनॉलों के क्वथनांक उच्चतर होते हैं। उदाहरणार्थ, एथेनॉल तथा प्रोपेन के आण्विक द्रव्यमान समतुल्य हैं किंतु इनके क्वथनांकों में काफ़ी अंतर है, मेथॉक्सीमेथेन का क्वथनांक इन दोनों के क्वथनांकों के मध्यवर्ती होता है।

ऐल्कोहॉलों के उच्च क्वथनांक मुख्यतः अंतराआण्विक हाइड्रोजन आबंध की उपस्थिति के कारण होते हैं जिसका ईथरों एवं हाइड्रोकार्बनों में अभाव है।
विलेयता
ऐल्कोहॉलों और फ़ीनॉलों की जल में विलेयता उनकी जल के अणुओं के साथ हाइड्रोजन आबंध बनाने की क्षमता के कारण होती है, जैसा कि चित्र में दिखाया गया है। यह विलेयता ऐल्किल/ऐरिल (जलविरागी) समूहों के आकार बढ़ने के साथ घटती है। अधिकांश निम्न आण्विक द्रव्यमान वाले ऐल्कोहॉल जल में सभी अनुपातों में मिश्रणीय होते हैं।

उदाहरण 7.3 निम्नलिखित समूहों के यौगिकों को उनके क्वथनांकों के बढ़ते हुए क्रम में व्यवस्थित कीजिए-
(क) पेन्टेन-1-ऑल, ब्यूटेन-1-ऑल, ब्यूटेन-2-ऑल, एथेनॉल, प्रोपेन-1-ऑल, मेथेनॉल
(ख) पेन्टेन-1-ऑल, $\mathrm{n}$-ब्यूटेन, पेन्टेनैल, एथॉक्सीएथेन
हल
(क) मेथेनॉल, एथेनॉल, प्रोपेन-1-ऑल, ब्यूटेन -2-ऑल, ब्यूटेन-1-ऑल, पेन्टेन-1-ऑल
(ख) $\mathrm{n}$-ब्यूटेन, एथॉक्सीएथेन, पेन्टैनैल, पेन्टेन-1-ऑल
7.4.4 रासायनिक अभिक्रियाएँ
( ऐल्कोहॉल नाभिकरागी के रूप में) ऐल्कोहॉल सर्वतोमुखी यौगिक हैं। ये नाभिकरागी (nucleophile) एवं इलेक्ट्रॉनरागी (electrophiles) दोनों के रूप में अभिक्रिया करती हैं। जब ऐल्कोहॉल नाभिकरागी के रूप में अभिक्रिया करती हैं तो $\mathrm{O}-\mathrm{H}$ के मध्य आबंध टूटता है।

(ii) जब ऐल्कोहॉल इलेक्टॉनरागी के रूप में अभिक्रिया करती है तो $\mathrm{C}-\mathrm{O}$ के मध्य आबंध टूटता है। प्रोटॉनित ऐल्कोहॉल इस प्रकार अभिक्रिया करती हैं-
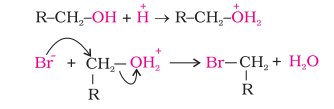
( प्रोटॉनित ऐल्कोहॉल इलेक्ट्रानरागी के रूप में)
$\mathrm{O}-\mathrm{H}$ व $\mathrm{C}-\mathrm{O}$ आबंध के विदलन के आधार पर ऐल्कोहॉलों एवं फ़ीनॉलों की अभिक्रिया को दो वर्गों में बाँटा जा सकता है-
(क) अभिक्रियाएँ जिनमें $\mathbf{O}-\mathrm{H}$ आबंध का विदलन होता है
1. ऐल्कोहॉलों एवं फ़ीनॉलों की अम्लता
(i) धातुओं के साथ अभिक्रियाएँ- ऐल्कोहॉल और फ़ीनॉल सक्रिय धातुओं, जैसे- सोडियम, पोटैशियम तथा ऐलुमिनियम के साथ अभिक्रिया करके संगत ऐल्कॉक्साइड/फ़ीनॉक्साइड एवं हाइड्रोजन देती हैं।

इसके अतिरिक्त फ़ीनॉल जलीय सोडियम हाइड्रॉक्साइड के साथ अभिक्रिया द्वारा सोडियम फ़ीनॉक्साइड बनाती हैं।
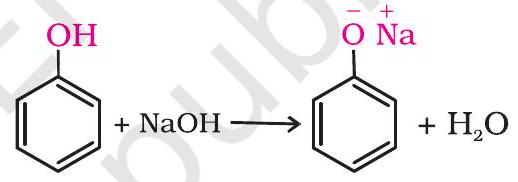
उपरोक्त अभिक्रियाएं दर्शाती हैं कि ऐल्कोहॉल एवं फ़ीनॉल अम्लीय प्रकृति की होती हैं। वास्तव में, ऐल्कोहॉल एवं फ़ीनॉल ब्रंसटेद अम्ल है अर्थात् वे किसी प्रबल क्षारक (B:) को प्रोटॉन प्रदान कर सकती हैं।
(ii) ऐल्कोहॉलों की अम्लता- ऐल्कोहॉलों की अम्लीय प्रकृति ध्रुवीय $\mathrm{O}-\mathrm{H}$ आबंध के कारण होती है इलेक्ट्रॉन विमोचक (दाता) समूह $\left(-\mathrm{CH} _{3},-\mathrm{C} _{2} \mathrm{H} _{5}\right)$ ऑक्सीजन परमाणु पर इलेक्ट्रॉन घनत्व बढ़ा देते हैं जिससे $\mathrm{O}-\mathrm{H}$ आबंध की ध्रुवता कम हो जाती है इससे अम्ल सामर्थ्य कम हो जाती है। इसके कारण ऐल्कोहॉलों की अम्ल-सामर्थ्य निम्नलिखित क्रम में घटती है-

ऐल्कोहॉल जल की अपेक्षा दुर्बल अम्ल होती हैं। जल की ऐल्कॉक्साइड से अभिक्रिया कराने पर यह स्पष्ट हो जाता है।

यह अभिक्रिया प्रदर्शित करती है कि ऐल्कोहॉल की अपेक्षा जल एक बेहतर प्रोटॉन दाता है। (यानी कि प्रबलतर अम्ल), उपरोक्त अभिक्रिया में हम यह भी देख सकते हैं कि एक ऐल्कॉक्साइड आयन हाइड्रॉक्साइड आयन की अपेक्षा एक बेहतर प्रोटॉनग्राही होता है। जो यह संकेत देता है कि ऐल्कॉक्साइड प्रबलतर क्षारक होते हैं। (सोडियम एथॉक्साइड, सोडियम हाइड्रॉक्साइड से अधिक क्षारीय होता है।)
ऐल्कोहॉल भी ब्रंसटेद क्षारकों की भाँति कार्य करते हैं। ऐसा ऑक्सीजन पर उपस्थित असहभाजित इलेक्ट्रॉन युगलों के कारण होता है जो इन्हें प्रोटॉनग्राही बनाते हैं।
(iii) फ़्रीनॉलों की अम्लता- फ़ीनॉल की धातुओं (उदाहरणार्थ; सोडियम तथा ऐलुमिनियम) तथा सोडियम हाइड्रॉक्साइड के साथ अभिक्रियाएं इसकी अम्लीय प्रकृति को दर्शाती हैं। फ़ीनॉल में हाइड्रॉक्सिल समूह बेन्जीन वलय के $s p^{2}$ संकरित कार्बन से सीधा संयुक्त रहता है जो कि इलेक्ट्रॉन अपनयक समूह के रूप में कार्य करता है। इसके कारण फ़ीनॉल अणु में आवेश वितरण से $-\mathrm{OH}$ समूह की ऑक्सीजन धनावेशित हो जाती है जैसा कि अनुनादी संरचनाओं द्वारा चित्रित किया गया है।

फ़ीनॉल की जलीय सोडियम हाइड्रॉक्साइड के साथ अभिक्रिया यह इंगित करती है कि फ़ीनॉल, ऐल्कोहॉलों तथा जल की अपेक्षा अधिक प्रबल अम्ल होती हैं। आइए, यह जाँचें कि ऐरोमैटिक वलय से जुड़ा हाइड्रॉक्सिल समूह, ऐल्किल समूह से जुड़े हाइड्रॉक्सिल समूह की अपेक्षा अधिक अम्लीय कैसे हो जाता है।
किसी ऐल्कोहॉल तथा फ़ीनॉल का आयनन निम्नलिखित प्रकार से होता है।

फ़ीनॉल में - $\mathrm{OH}$ से संयुक्त $s p^{2}$ संकरित कार्बन की उच्च विद्युतऋणात्मकता के कारण ऑक्सीजन पर इलेक्ट्रॉन घनत्व कम हो जाता है जिससे $\mathrm{O}-\mathrm{H}$ आबंध की ध्रुवता बढ़ती है, जिसके फलस्वरूप ऐल्कोहॉल की अपेक्षा फ़ीनॉल के आयनन में वृद्धि होती है। अब, हम ऐल्कॉक्साइड एवं फ़ीनॉक्साइड आयनों के स्थायित्व के बारे में जाँच करें। ऐल्कॉक्साइड आयनों में ऋणावेश ऑक्सीजन पर स्थानागत होता है जबकि फ़ीनॉक्साइड आयनों में विस्थानित होता है। ऋणावेश का विस्थानन (संरचना I-V) फ़ीनॉक्साइड आयनों को अधिक स्थायी बनाता है। तथा फ़ीनॉल के आयनन में सहायक होता है। यद्यपि फ़ीनॉल में भी आवेश का विस्थानन होता है परंतु इसकी अनुनादी संरचनाओं में आवेशों का पृथकन होता है जिसके कारण फ़ीनॉक्साइड आयन की अपेक्षा फ़ीनॉल अणु कम स्थायी होता है।

प्रतिस्थापित फ़ीनॉलों में नाइट्रो समूह जैसे इलेक्ट्रॉन अपनयक (प्रत्याहार्य) समूह, फ़ीनॉल की अम्लीय सामर्थ्य को बढ़ा देते हैं। जब ऐसे समूह ऑर्थो एवं पैरा स्थितियों पर उपस्थित होते हैं तो यह प्रभाव अधिक प्रबल हो जाता है। इसका कारण फ़ीनॉक्साइड आयन के आर्थो एवं पैरा स्थान पर के ऋणावेश का प्रभावी विस्थानन होता है। दूसरी ओर ऐल्किल समूह जैसे इलेक्ट्रॉन विमोचक (दाता) समूह सामान्य रूप से फ़ीनॉक्साइड आयन के बनने में सहायक नहीं होते, परिणामस्वरूप अम्ल सामर्थ्य में कमी आ जाती है। उदाहरणार्थ; फ़ीनॉल की अपेक्षा क्रीसॉल कम अम्लीय होते हैं।
$p K _{a}$ मान जितना अधिक होगा, अम्ल उतना ही दुर्बल होगा
सारणी 7.3- कुछ फ़ीनॉलों और ऐथेनॉल के $\mathrm{pK} _{\mathrm{a}}$ का मान
| यौगिक | सूत्र | $\mathbf{p K} _{\mathrm{a}}$ |
|---|---|---|
| $o$-नाइट्राफ़ीनॉल | $o-\mathrm{O} _{2} \mathrm{~N}-\mathrm{C} _{6} \mathrm{H} _{4}-\mathrm{OH}$ | 7.2 |
| $m$-नाइट्रोफ़ीनॉल | $m-\mathrm{O} _{2} \mathrm{~N}-\mathrm{C} _{6} \mathrm{H} _{4}-\mathrm{OH}$ | 8.3 |
| $p$-नाइट्रोफ़ीनॉल | $p-\mathrm{O} _{2} \mathrm{~N}-\mathrm{C} _{6} \mathrm{H} _{4}-\mathrm{OH}$ | 7.1 |
| फ़ीनॉल | $\mathrm{C} _{6} \mathrm{H} _{5}-\mathrm{OH}$ | 10.0 |
| $o$-क्रीसॉल | $o-\mathrm{CH} _{3}-\mathrm{C} _{6} \mathrm{H} _{4}-\mathrm{OH}$ | 10.2 |
| $m$-क्रीसॉल | $m-\mathrm{CH} _{3}-\mathrm{C} _{6} \mathrm{H} _{4}-\mathrm{OH}$ | 10.1 |
| $p$-क्रीसॉल | $p-\mathrm{CH} _{3}-\mathrm{C} _{6} \mathrm{H} _{4}-\mathrm{OH}$ | 10.2 |
| एथेनॉल | $\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OH}$ | 15.9 |
उपरोक्त आँकड़ों के आधार पर आप देखेंगे कि फ़ीनॉल एथेनॉल की तुलना में दस लाख गुना अधिक अम्लीय है।
उदाहरण 7.4 निम्नलिखित यौगिकों को उनके अम्ल-सामर्थ्य के बढ़ते क्रम में व्यवस्थित कीजिएप्रोपेन-1-ऑल, 2,4,6-ट्राइनाइट्रोफ़ीनॉल, 3-नाइट्रोफ़ीनॉल, 3,5-डाइनाइट्रोफ़ीनॉल, फ़ीनॉल, 4-मेथिलफ़ीनॉल,
हल
प्रोपेन-1-ऑल ; 4-मेथिलफ़ीनॉल; फ़ीनॉल; 3-नाइट्रोफ़ीनॉल ; 3,5-डाइनाइट्रोफ़ीनॉल; $2,4,6$-ट्राइनाइट्रोफ़ीनॉल
2. एस्टरीकरण
ऐल्कोहॉल एवं फ़ीनॉल कार्बाक्सिलिक अम्लों, अम्ल क्लोराइडों एवं अम्ल ऐनहाइड्राइडों के साथ अभिक्रिया द्वारा एस्टर बनाती हैं।
$\mathrm{Ar} / \mathrm{ROH}+\mathrm{R}^{\prime}-\mathrm{COOH} \stackrel{\mathrm{H}^{+}}{\rightleftharpoons} \mathrm{Ar} / \mathrm{ROCOR}^{\prime}+\mathrm{H_2} \mathrm{O}$
$\mathrm{Ar} / \mathrm{R}-\mathrm{OH}+\left(\mathrm{R}^{\prime} \mathrm{CO}\right)_{2} \mathrm{O} \stackrel{\mathrm{H}^{+}}{\rightleftharpoons} \mathrm{Ar} / \mathrm{ROCOR}^{\prime}+\mathrm{R}^{\prime} \mathrm{COOH}$
$\mathrm{R} / \mathrm{ArOH}+\mathrm{R}^{\prime} \mathrm{COCl} \xrightarrow{\text { पिरिडीन }} \mathrm{R} / \mathrm{ArOCOR}^{\prime}+\mathrm{HCl}$
ऐस्पिरिन, पीड़ाहारी, शोथनाशी एवं ज्वरनाशी गुणधर्म वाली होती है।
कार्बाक्सिलिक अम्ल तथा अम्ल ऐनहाइड्राइड की अभिक्रिया सांद्र सल्फ्यूरिक अम्ल की कुछ मात्रा की उपस्थिति में संपन्न होती है। यह अभिक्रिया उत्क्रमणीय होती है, अतः इसमें बने जल को तुरंत निष्कासित कर दिया जाता है। अम्ल क्लोराइड के साथ अभिक्रिया क्षारक (पिरिडीन) की उपस्थिति में की जाती है जिससे कि अभिक्रिया से बने $\mathrm{HCl}$ को उदासीन किया जा सके। यह साम्य को दाईं ओर विस्थापित कर देता है। ऐल्कोहॉल तथा फ़ीनॉल में ऐसीटिल $\left(\mathrm{CH} _{3} \mathrm{CO}\right)$ समूह का प्रवेश ऐसीटिलन कहलाता है। ऐस्पिरिन सैलिसिलिक अम्ल के ऐसीटिलन से प्राप्त होती है।

(ख) अभिक्रियाएँ जिनमें कार्बन-ऑक्सीजन (C-O) आबंध का विदलन (Cleavage) होता है
$\mathrm{C}-\mathrm{O}$ आबंध विदलन की अभिक्रियाएँ केवल ऐल्कोहॉलों में पाई जाती हैं। फ़ीनॉल इस प्रकार की अभिक्रिया केवल जस्त चूर्ण के साथ प्रदर्शित करती हैं।
1. हाइड्रोजन हैलाइडों के साथ अभिक्रिया ऐल्कोहॉल, हाइड्रोजन हैलाइडों के साथ अभिक्रिया करके ऐल्किल हैलाइड बनाती हैं (देखिए- एकक 6, कक्षा 12)
$$ \mathrm{ROH}+\mathrm{HX} \rightarrow \mathrm{R}-\mathrm{X}+\mathrm{H} _{2} \mathrm{O} $$
इन तीनों वर्गों की ऐल्कोहॉलों की $\mathrm{HCl}$ के प्रति अभिक्रियाशीलता के आधार पर इनमें विभेद किया जा सकता है ( ल्यूकास परीक्षण)। ऐल्कोहॉल ल्यूकास अभिकर्मक (सांद्र $\mathrm{HCl}$ एवं $\mathrm{ZnCl} _{2}$ ) में विलेय होती हैं जबकि उनके हैलाइड अमिश्रणीय होते हैं तथा विलयन में धुँधलापन (आविलता) उत्पन्न कर देते हैं। तृतीयक ऐल्कोहॉलों द्वारा धुँधलापन तत्काल उत्पन्न हो जाता है; क्योंकि वे आसानी से हैलाइड बनाती हैं। प्राथमिक ऐल्कोहॉल सामान्य ताप पर धुँधलापन उत्पन्न नहीं करतीं।
2. फॉस्फोरस ट्राइहैलाइडों के साथ अभिक्रिया फ़ॉस्फ़ोरस ट्राइब्रोमाइड के साथ अभिक्रिया करने पर ऐल्कोहॉल, ऐल्किल ब्रोमाइड में परिवर्तित हो जाती है (देखिए- एकक 6 , कक्षा 12)।
3. निर्जलन ऐल्कोहॉल के सांद्र $\mathrm{H} _{2} \mathrm{SO} _{4}$ या $\mathrm{H} _{3} \mathrm{PO} _{4}$ जैसे प्रोटिक अम्लों अथवा निर्जलित ज़िंक क्लोराइड ऐलुमिना जैसे उत्प्रेरकों के द्वारा निर्जलित होने (जल के अणु के निष्कासन) पर ऐल्कीन बनती हैं। (एकक-9, कक्षा-11)
$443 \mathrm{~K}$ ताप पर सांद्र $\mathrm{H} _{2} \mathrm{SO} _{4}$ के साथ गरम करने पर एथेनॉल का निर्जलन हो जाता है। $\mathrm{H_2} \mathrm{SO_4}$ at $443 \mathrm{~K}$. $ \mathrm{C_2} \mathrm{H_5} \mathrm{OH} \xrightarrow[443 \mathrm{~K}]{\mathrm{H_2} \mathrm{SO_4}} \mathrm{CH_2}=\mathrm{CH_2}+\mathrm{H_2} \mathrm{O} $
$$ \mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OH} \xrightarrow[443 \mathrm{~K}]{\mathrm{H} _{2} \mathrm{SO} _{4}} \mathrm{CH} _{2}=\mathrm{CH} _{2}+\mathrm{H} _{2} \mathrm{O} $$
तृतीयक कार्बोकैटायन अधिक स्थायी होते हैं, अतः द्वितीयक एवं तृतीयक कार्बोकैटायनों की अपेक्षा आसानी से बनते हैं। तृतीयक ऐल्कोहॉलों का निर्जलन करना सबसे अधिक आसान है। द्वितीयक तथा तृतीयक ऐल्कोहॉलों का निर्जलन अपेक्षाकृत मध्यम परिस्थितियों में किया जाता है। उदाहरणार्थ-
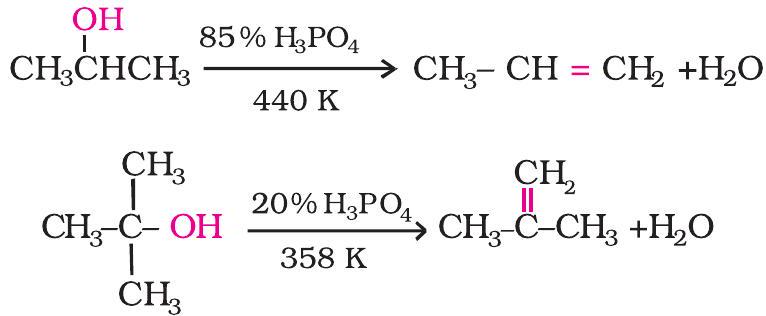
त्तीयक कार्बाकैटायन अधिक स्थायी होते हैं, अत: द्वितीयक एवं तृतीयक कार्बोकैटायनों की अपेक्षा आसानी से बनते हैं। तृतीयक ऐल्कोहॉलों का निर्जलन करना सबसे अधिक आसान है।
क्रियाविधि
चरण 1- प्रोटॉनित ऐल्कोहॉल का बनना-

चरण 2- कार्बोकैटायन का बनना-यह सबसे धीमा चरण है अतः यह अभिक्रिया का दर निर्धारक चरण होता है।

चरण 3- प्रोटॉन के निकल जाने से प्रोपीन का बनना-

चरण 1 में प्रयुक्त अम्ल, अभिक्रिया के चरण 3 में मुक्त हो जाता है। साम्य को दाईं ओर विस्थापित करने के लिए, प्रोपीन बनते ही निष्कासित कर ली जाती है।
4. ऑक्सीकरण- ऐल्कोहॉलों के ऑक्सीकरण में $\mathrm{O}-\mathrm{H}$ एवं $\mathrm{C}-\mathrm{H}$ आबंधों का विदलन होता है तथा कार्बन-ऑक्सीजन द्विआबंध बनता है।
आबंधों का ऐसा विदलन एवं निर्माण ऑक्सीकरण अभिक्रियाओं में होता है। इन्हें विहाइड्रोजनन अभिक्रियाएं भी कहते हैं क्योंकि इनमें ऐल्कोहॉल अणु में से डाइहाइड्रोजन अणु की कमी हो जाती है। प्रयुक्त ऑक्सीकरण कर्मक के आधार पर, प्राथमिक ऐल्कोहॉल, ऐल्डिहाइड में ऑक्सीकृत हो जाती हैं जो बाद में कार्बोक्सिलिक अम्ल में ऑक्सीकृत हो जाता है।
ऐल्कोहॉलों से सीधे कार्बोक्सिलिक अम्लों को प्राप्त करने के लिए प्रबल ऑक्सीकरण कर्मकों, जैसे अम्लीकृत पोंटैशियम परमैंगनेट का उपयोग किया जाता है। ऐल्डिहाइडों को पृथक् करने के लिए $\mathrm{CrO} _{3}$ का निर्जल माध्यम में ऑक्सीकरण कर्मक की तरह उपयोग किया जाता है।
प्राथमिक ऐल्कोहॉल के ऑक्सीकरण से ऐल्डिहाइड की अच्छी लब्धि प्राप्त करने के लिए पिरिडीनियम क्लोरोक्रोमेट (PCC) श्रेष्ठ अभिकर्मक है जो कि क्रोमियम ट्राइऑक्साइड का पिरिडीन व $\mathrm{HCl}$ के साथ संकुल है।
$$ \mathrm{CH} _{3}-\mathrm{CH}=\mathrm{CH}-\mathrm{CH} _{2} \mathrm{OH} \xrightarrow{\mathrm{PCC}} \mathrm{CH} _{3}-\mathrm{CH}=\mathrm{CH}-\mathrm{CHO} $$
द्वितीयक ऐल्कोहॉल क्रोमिक ऐनहाइड्राइड $\left(\mathrm{CrO} _{3}\right)$ द्वारा कीटोनों में ऑक्सीकृत हो जाती हैं।
तृतीयक ऐल्कोहॉल ऑक्सीकरण अभिक्रिया नहीं करते। प्रबल अभिक्रिया परिस्थितियों, जैसे- प्रबल आक्सीकरण कर्मकों $\left(\mathrm{KMnO} _{4}\right)$ एवं उच्च ताप पर विभिन्न $\mathrm{C}-\mathrm{C}$ आबंधों का विदलन होता है। जिससे कार्बोक्सिलिक अम्लों का मिश्रण प्राप्त होता है जिनमें कार्बन परमाणुओं की संख्या कम होती है।

जब प्राथमिक अथवा द्वितीयक ऐल्कोहॉल के वाष्पों को $573 \mathrm{~K}$ पर तप्त कॉपर के ऊपर से प्रवाहित किया जाता है तो विहाइड्रोजनन होता है तथा ऐल्डिहाइड अथवा कीटोन बनते हैं। जबकि तृतीयक ऐल्कोहॉलों का निर्जलन होता है।
मेथेनॉल एवं एथेनॉल के जैविक ऑक्सीकरण से शरीर में संगत ऐल्डिहाइड बनते हैं, तत्पश्चात् अम्ल बनते हैं। कभी-कभी मद्यव्यसनी गलती से मेथेनॉल मिश्रित ऐथेनॉल जिसे विगुणित ऐल्कोहॉल भी कहते हैं, पी लेते हैं। शरीर में मेथेनॉल पहले मेथेनैल में ऑक्सीकृत होती है; तत्पश्चात् मेथेनॉइक अम्ल में, जो कि अन्धता एवं मृत्यु का कारण बन सकता है। मेथेनॉल की विषाक्तता के रोगी का उपचार तनुकृत ऐथेनॉल को अंतः शिरा द्वारा प्रदान करके किया जाता है। ऐल्डीहाइड (HCHO) को अम्ल में ऑक्सीकृत करने के लिए उत्तरदायी एन्जाइम जल ग्रहण कर लेता है जिससे वृक्क को मेथेनॉल उत्सर्जित करने के लिए समय प्राप्त हो जाता है।
( ग ) फ़ीनॉल की अभिक्रियाएँ निम्नलिखित अभिक्रियाएँ केवल फ़ीनालों द्वारा दर्शायी जाती हैं-
1. ऐरोमैटिक इलेक्ट्रॉनरागी प्रतिस्थापन- फ़ीनॉलों में ऐरोमैटिक वलय पर होने वाली अभिक्रियाएँ इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाएँ होती हैं। (एकक-9, कक्षा-11) बेन्जीन वलय पर जुड़ा $-\mathrm{OH}$ समूह इसे इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रिया की ओर सक्रियित करता है और आने वाले समूह को वलय में ऑर्थो एवं पैरा स्थिति पर निर्दिष्ट करता है। जिससे $-\mathrm{OH}$ समूह के अनुनाद प्रभाव के कारण ये स्थितियाँ इलेक्ट्रॉन-धनी हो जाती हैं। इनकी अनुनादी संरचनाएँ फ़ीनॉलों की अम्लता शीर्षक के अंतर्गत दर्शायी गई हैं।
फ़ीनॉलों की सामान्य इलेक्ट्रॉनरागी ऐरोमैटिक प्रतिस्थापन अभिक्रियाएँ निम्नलिखित हैं-
(i) नाइट्रोकरण निम्न ताप $(298 \mathrm{~K})$ पर तनु नाइट्रिक अम्ल के साथ फ़ीनॉल के नाइट्रोकरण से ऑर्थो-नाइट्रोफ़ीनॉल एवं पैरा नाइट्रोफ़ीनॉल का मिश्रण प्राप्त होता है।

ऑर्थो एवं पैरा समावयवों को वाष्पीय आसवन द्वारा पृथक् किया जा सकता है। आंतरआण्विक हाइड्रोजन आबंध के कारण ऑर्थो-नाइट्रोफ़ीनॉल भाप द्वारा वाष्पित होती है जबकि पैरा-नाइट्रोफ़ीनॉल कम वाष्पशील होती है क्योंकि इसमें अंतराआण्विक हाइड्रोजन आबंध विद्यमान होता है, जिससे अणु संगुणित हो जाते हैं।

2,4,6-ट्राइनाइट्रोफ़ीनॉल तीन इलेक्ट्रॉन अपनयक $-\mathrm{NO}_2$ समूहों की उपस्थिति के कारण प्रबल अम्ल होती है। यह समूह हाइड्रोजन आयन निकलने में सहायक होते हैं।
(अंतराआण्विकहाइड्रोजन आबंध) सांद्र नाइट्रिक अम्ल के साथ फ़ीनॉल $2,4,6$-ट्राइनाइट्रोफ़ीनॉल में परिवर्तित हो जाती है। उत्पाद को सामान्यतः पिक्रिक अम्ल कहते हैं। अभिक्रिया उत्पाद की लब्धि बहुत कम होती है।

आजकल पिक्रिक अम्ल को बनाने के लिए सर्वप्रथम फ़ीनॉल की अभिक्रिया सांद्र $\mathrm{H} _{2} \mathrm{SO} _{4}$ के साथ करते हैं जिससे यह फ़ीनॉल-2, 4 -डाइसल्फ़ोनिक अम्ल में परिवर्तित हो जाती है। तत्पश्चात् सांद्र $\mathrm{HNO} _{3}$ के साथ अभिक्रिया द्वारा $2,4,6$ - ट्राइनाइट्रोफ़ीनॉल प्राप्त कर लेते हैं। क्या आप इसमें सम्मिलित अभिक्रियाओं का समीकरण लिख सकते हैं?
(ii) हैलोजनन फ़ीनॉल की ब्रोमीन के साथ अभिक्रिया द्वारा अलग-अलग प्रायोगिक अवस्थाओं में अलग-अलग उत्पाद प्राप्त होते हैं।
(क) जब $\mathrm{CHCl} _{3}$ अथवा $\mathrm{CS} _{2}$ जैसे कम ध्रुवीय विलायकों में निम्न ताप पर अभिक्रिया की जाती है तो मोनोब्रोमोफ़ीनॉल प्राप्त होती है।

बेन्जीन का सामान्य हैलोजनन $\mathrm{FeBr} _{3}$ जैसे लूइस अम्ल की उपस्थिति में होता है (एकक 6 , कक्षा 12), जो हैलोजन अणु को ध्रुवित कर देता है। फ़ीनॉल की अभिक्रिया में ब्रोमीन का ध्रुवण लूइस अम्ल की अनुपस्थिति में भी संभव होता है। इसका कारण बेन्जीन से जुड़े $-\mathrm{OH}$ समूह का वलय पर उच्च सक्रियण प्रभाव होता है।
(ख) जब फ़ीनॉल की अभिक्रिया ब्रोमीन जल के साथ की जाती है तो $2,4,6$-ट्राइब्रोमोफ़ीनॉल श्वेत अवक्षेप के रूप में बनता है।

उदाहरण 7.5
निम्नलिखित अभिक्रियाओं से बनने वाले मुख्य उत्पादों की संरचनाएं दीजिए।
(क) 3-मेथिलफ़ीनॉल का मोनोनाइट्रोकरण
(ख) 3-मेथिलफ़ीनॉल का डाइनाइट्रोकरण
(ग) फ़ेनिलऐथेनोएट का मोनोनाइट्रोकरण
हल $-\mathrm{OH}$ और $-\mathrm{CH} _{3}$ समूहों का संयुक्त प्रभाव प्रवेश करने वाले समूहों की स्थिति निर्धारित करता है।

2. कोल्बे अभिक्रिया
फ़ीनॉल को सोडियम हाइड्रॉक्साइड के साथ अभिकृत कराने से बना फ़ीनॉक्साइड आयन, फ़ीनॉल की अपेक्षा इलेक्ट्रॉनरागी ऐरोमैटिक प्रतिस्थापन अभिक्रिया के प्रति अधिक क्रियाशील होता है। अतः यह $\mathrm{CO} _{2}$ जैसे दुर्बल इलेक्ट्रॉनरागी के साथ इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रिया करता है। इससे ऑर्थो हाइड्रॉक्सीबेन्ज़ोइक अम्ल मुख्य उत्पाद के रूप में प्राप्त होता है।

3. राइमर-टीमन अभिक्रिया
फ़ीनॉल की सोडियम हाइड्रॉक्साइड की उपस्थिति में क्लोरोफ़ार्म के साथ अभिक्रिया से बेन्जीन में, $-\mathrm{CHO}$ समूह ऑर्थो स्थिति पर प्रवेश कर जाता है। इस अभिक्रिया को राइमर-टीमन अभिक्रिया (Reimer-Tiemann reaction) कहते हैं।
प्रतिस्थापित मध्यवर्ती बेन्ज़िल क्लोराइड क्षार की उपस्थिति में अपघटित होकर सैलिसैल्डिहाइड बनाता है।

4. फ्रीनॉल की यशदरज के साथ अभिक्रिया
यशदरज के साथ गरम करने पर फ़ीनॉल बेन्जीन में परिवर्तित हो जाती है।

5. आक्सीकरण
फ़ीनॉल के क्रोमिक अम्ल द्वारा आक्सीकरण से संयुग्मित डाइकीटोन बनता है जिसे बेन्ज्रोक्विनोन कहते हैं। वायु की उपस्थिति में फ़ीनॉल धीरे-धीरे गहरे रंग के क्विनोनों के मिश्रण में ऑक्सीकृत हो जाते हैं।
पाठ्यनिहित प्रश्न
7.6 यदि निम्नलिखित ऐल्कोहॉल क्रमशः (क) $\mathrm{HCl}-\mathrm{ZnCl} _{2}$ (ख) $\mathrm{HBr}$ (ग) $\mathrm{SOCl} _{2}$ से अभिक्रिया करें तो आप अपेक्षित उत्पादों की संरचनाएं दीजिए।
(i) ब्यूटेन -1-ऑल
(ii) 2-मेथिलब्यूटेन-2-ऑल
Show Answer
#missing7.7 अम्ल उत्प्रेरित निर्जलन के मुख्य उत्पादों की प्रागुक्ति कीजिए।
(i) 1-मेथिलसाइक्लोहैक्सेनॉल और
(ii) ब्यूटेन-1-ऑल के
Show Answer
#missing7.8 ऑर्थों तथा पैरा नाइट्रोफ़ीनॉल, फ़ीनॉल से अधिक अम्लीय होती हैं। उनके संगत फ़ीनॉक्साइड आयनों की अनुनादी संरचनाएं बनाइए।
Show Answer
#missing7.9 निम्नलिखित अभिक्रियाओं में सम्मिलित समीकरण लिखिए-
(i) राइमर-टीमन अभिक्रिया
(ii) कोल्बे अभिक्रिया
Show Answer
#missing7.5 महत्व के कुछ डेल्कोहॉल
मेथेनॉल एवं एथेनॉल दो औद्योगिक महत्व की ऐल्कोहॉल हैं।
1. मेथेनॉल
मेथेनॉल, $\mathrm{CH} _{3} \mathrm{OH}$ जिसे ‘काष्ठ स्प्रिट’ भी कहते हैं, लकड़ी के भंजक आसवन द्वारा प्राप्त की जाती थी। वर्तमान में अधिकांश मेथेनॉल का उत्पादन उच्च ताप एवं दाब पर $\mathrm{ZnO}-\mathrm{Cr} _{2} \mathrm{O} _{3}$ उत्प्रेरक की उपस्थिति में कार्बन मोनोक्साइड के उत्प्रेरकी हाइड्रोजनन द्वारा किया जाता है।
$$ \mathrm{CO}+2 \mathrm{H} _{2} \xrightarrow[\substack{200-300 \text { atm } \\ 573-673 \mathrm{~K}}]{\mathrm{ZnO}-\mathrm{Cr} _{2} \mathrm{O} _{3}} \mathrm{CH} _{3} \mathrm{OH} $$
मेथेनॉल एक रंगहीन द्रव है, जिसका क्वथनांक $337 \mathrm{~K}$ होता है। यह अत्यंत विषैली प्रकृति की होती है। इसके बहुत कम मात्रा में सेवन से भी अंधापन हो सकता है और इसकी अधिक मात्रा से मृत्यु भी हो सकती है। मेथेनॉल का उपयोग पेंट और वार्निश के लिए विलायक के रूप में और मुख्य रूप से फॉर्मेल्डीहाइड को बनाने के लिए किया जाता है।
2. एथेनॉल
ऐथेनॉल $\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OH}$ को औद्योगिक स्तर पर किण्वन द्वारा प्राप्त किया जाता है। शर्करा के किण्वन से एथेनॉल प्राप्त करने की यह विधि सबसे पुरानी है। मोलैसेज (शीरे), गन्ने अथवा अंगूर जैसे फलों की शर्करा को इनवर्टेस एन्जाइम की उपस्थिति में ग्लूकोस एवं फ्रक्टोज़ (दोनों का आण्विक सूत्र $\mathrm{C} _{6} \mathrm{H} _{12} \mathrm{O} _{6}$ है) में परिवर्तित कर लिया जाता है। ग्लूकोस एवं फ्रक्टोज़ को यीस्ट में पाए जाने वाले दूसरे एन्जाइम जाइमेज द्वारा किण्वन किया जाता है।
$$ \begin{aligned} & \mathrm{C} _{12} \mathrm{H} _{22} \mathrm{O} _{11}+\mathrm{H} _{2} \mathrm{O} \xrightarrow{\text { इनवर्टेज }} \underset{\text{ ग्लूकोस }} {\mathrm{C} _{6} \mathrm{H} _{12} \mathrm{O} _6}+\underset{\text{ फ्रक्टोज़ }}{\mathrm{C} _{6} \mathrm{H} _{12} \mathrm{O} _6} \\ & \mathrm{C} _{6} \mathrm{H} _{12} \mathrm{O} _{6} \xrightarrow{\text { जाइमेज }} 2 \mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OH}+2 \mathrm{CO} _{2} \end{aligned} $$
शराब बनाने के लिए अंगूर शर्करा (द्राक्ष-शर्करा) तथा यीस्ट का स्रोत होते हैं। जब अंगूर पक जाते हैं तो उनमें शर्करा की मात्रा बढ़ जाती है तथा उनकी ऊपरी सतह पर यीस्ट उत्पन्न हो जाती है। जब अंगूरों को कुचला जाता है तो शर्करा एवं एन्जाइम संपर्क में आते हैं तथा किण्वन आरंभ हो जाता है। किण्वन अवायवीय स्थितियों यानी कि वायु की अनुपस्थिति में होता है। किण्वन में कार्बनडाइऑक्साइड निर्मुक्त होती है।
एथेनॉल के सेवन का प्रभाव केंद्रीय तंत्रिका तंत्र पर पड़ता है। मध्यम मात्रा में यह निर्णय क्षमता पर प्रभाव डालती है तथा अंतर्बाधा को कम करती है। अधिक सांद्रता मितली और बेहोशी लाती है। उच्च सांद्राओं में यह स्वतः श्वसन क्रिया में भी बाधा डालती है और प्राणघातक हो सकती है।
उत्पन्न ऐल्कोहॉल की मात्रा $14 \%$ से अधिक हो जाने पर जाइमेज की क्रिया संदमित हो जाती है। यदि किण्वन मिश्रण में वाय आ जाती है तो वायु की ऑक्सीजन एथेनॉल को एथेनोइक अम्ल में आक्सीकृत कर देती है, जिससे ऐल्कोहॉली पेय का स्वाद नष्ट हो जाता है।
एथेनॉल एक रंगहीन द्रव है, जिसका क्वथनांक $351 \mathrm{~K}$ है। यह पेंट उद्योग में विलायक के रूप में तथा कार्बन के अनेक यौगिकों के विरचन में प्रयुक्त की जाती है। औद्योगिक ऐल्कोहॉल (सामान्य एथेनॉल) को कुछ कॉपर सल्फेट (रंग प्रदान करने के लिए) एवं पिरिडीन (दुर्गंधयुक्त तरल) मिलाकर पीने के अयोग्य बना दिया जाता है। इस प्रक्रम को ऐल्कोहॉल का विकृतीकरण कहते हैं।
आजकल एथेनॉल की अधिक मात्रा एथीन के जलयोजन द्वारा प्राप्त की जाती है (खंड 7.4)।
7.6 ईथर
7.6.1 ईथरों का विरचन
1. ऐल्कोहॉलों के निर्जलन द्वारा
प्रोटिक अम्लों $\left(\mathrm{H} _{2} \mathrm{SO} _{4}, \mathrm{H} _{3} \mathrm{PO} _{4}\right)$ की उपस्थिति में ऐल्कोहॉल निर्जलित हो जाती है। अभिक्रिया का उत्पाद ऐल्कीन होगा अथवा ईथर; यह अभिक्रिया की परिस्थितियों पर निर्भर करता है। उदाहरणार्थ; $443 \mathrm{~K}$ ताप पर सल्फ्यूरिक अम्ल की उपस्थिति में एथेनॉल निर्जलित होकर एथीन देती है। $413 \mathrm{~K}$ ताप पर एथॉक्सीएथेन मुख्य उत्पाद होता है।
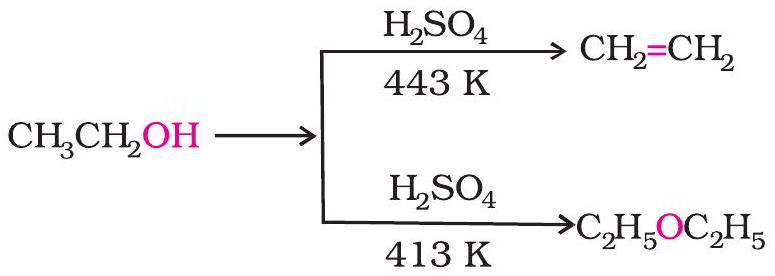
डाइएथिल ईथर का उपयोग अंत:श्वसन निश्चेतक के रूप में होता रहा है। परंतु इसके धीमे असर एवं अप्रिय स्वास्थ्यलाभ समय के कारण, इसका प्रतिस्थापन दूसरे यौगिकों द्वारा कर दिया गया है।
ईथर का विरचन एक द्विअणुक नाभिकरागी प्रतिस्थापन अभिक्रिया $\left(\mathrm{S} _{\mathrm{N}} 2\right.$ अभिक्रिया) है जिसमें ऐल्कोहॉल अणु एक प्रोटॉनित ऐल्कोहॉल अणु पर आक्रमण करता है जैसा कि नीचे दर्शाया गया है-

ऐल्कोहॉलों का अम्लीय निर्जलन, जिसमें ऐल्कीन बनती है, एक प्रतिस्थापन अभिक्रिया से भी संबंधित है जो ईथर देती है।
यह विधि केवल प्राथमिक ऐल्किल समूह युक्त ईथरों के विरचन के लिए ही उपयुक्त होती है। ऐल्किल समूह अबाधित तथा तापक्रम निम्न होना चाहिए अन्यथा अभिक्रिया ऐल्कीन के बनने में सहायक होगी। जब ऐल्कोहॉल द्वितीयक या तृतीयक होती है तो अभिक्रिया $\mathrm{S} _{\mathrm{N}} 1$ पथ का अनुसरण करती है, जिसके बारे में आप उच्च कक्षाओं में अध्ययन करेंगे। तथापि द्वितीयक और तृतीयक ऐल्कोहॉलों के निर्जलन से ईथरों को प्राप्त करना असफल होता है; क्योंकि प्रतिस्थापन और विलोपन की प्रतिस्पर्धा में प्रतिस्थापन की बजाय विलोपन होने के परिणामस्वरूप ऐल्कीनें सरलता से बनती हैं।
क्या आप समझा सकते हैं कि द्विअणुक निर्जलन, एथिल मेथिल ईथर के विरचन के लिए उपयुक्त क्यों नहीं है?
ऐलेक्ज्रेंडर विलियम विलियम्सन (1824-1904) का जन्म लंदन में स्कॉट परिवार में हुआ। वह 1849 में यूनिवर्सिटी कॉलेज, लंदन में प्रोफ़ेसर नियुक्त हुए।
2. विलियम्सन संश्लेषण
यह सममित और असममित ईथरों को बनाने की एक महत्वपूर्ण प्रयोगशाला विधि है। इस विधि में, ऐल्किल हैलाइड की सोडियम ऐल्कॉक्साइड के साथ अभिक्रिया कराई जाती है।
$$ \mathrm{R}-\mathrm{X}+\mathrm{R}^{\prime}-\stackrel{-}{\mathrm{O}} \mathrm{Na}^{+} \longrightarrow \mathrm{R}-\ddot{\mathrm{O}}^{-}-\mathrm{R}^{\prime}+\mathrm{Na} \mathrm{X} $$
प्रतिस्थापित (द्वितीयक अथवा तृतीयक) ऐल्किल समूह युक्त ईथर भी इस विधि द्वारा बनाई जा सकती हैं। इस अभिक्रिया में प्राथमिक ऐल्किल हैलाइड पर ऐल्कॉक्साइड आयन का $\left(\mathrm{S} _{\mathrm{N}} 2\right)$ आक्रमण होता है।

अगर ऐल्किल हैलाइड प्राथमिक होता है तो अच्छे परिणाम प्राप्त होते हैं। द्वितीयक एवं तृतीयक ऐल्किल हैलाइडों की अभिक्रिया में विलोपन, प्रतिस्पर्धा में प्रतिस्थापन से आगे होता है। यदि तृतीयक ऐल्किल हैलाइड का उपयोग किया जाए तो उत्पाद के रूप में केवल ऐल्कीन प्राप्त होती है एवं कोई ईथर नहीं बनती। उदाहरणार्थ; $\mathrm{CH} _{3} \mathrm{ONa}$ की $\left(\mathrm{CH} _{3}\right) _{3} \mathrm{C}-\mathrm{Br}$ के साथ अभिक्रिया द्वारा केवल 2 -मेथिलप्रोपीन प्राप्त होती है।
ऐसा इसलिए होता है क्योंकि ऐल्कॉक्साइड न केवल नाभिकरागी होते हैं अपितु प्रबल
उदाहरण 7.6 निम्नलिखित अभिक्रिया तृतीयक ब्यूटिल एथिल ईथर बनाने के लिए उपयुक्त नहीं है।
$ \mathrm{C_2H_5ONa} + \mathrm{CH_3}- \underset{\large\mathrm{CH_3}}{\large\underset{\large\text{|}}{\stackrel{\stackrel{\large\mathrm{CH_3}}{\text{|}}}{\large\mathrm{C}}}}-\mathrm{Cl} \longrightarrow \mathrm{CH_3}- \underset{\large\mathrm{CH_3}}{\large\underset{\large\text{|}}{\stackrel{\stackrel{\large\mathrm{CH_3}}{\text{|}}}{\large\mathrm{C}}}} - \mathrm{C_2H_5} $
(i) इस अभिक्रिया का मुख्य उत्पाद क्या होगा?
(ii) तृतीयक-ब्यूटिलएथिल ईथर बनाने के लिए उपयुक्त अभिक्रिया लिखिए?
हल
(i) दी गई अभिक्रिया में 2 -मेथिलप्रोप-1-ईन मुख्य उत्पाद है; क्योंकि सोडियम एथॉक्साइड एक प्रबल नाभिकरागी एवं प्रबल क्षारक है, अतः विलोपन प्रतिस्थापन से अधिक प्रधान होता है।

क्षारक भी होते हैं। वे ऐल्किल हैलाइडों के साथ विलोपन अभिक्रिया करते हैं। इस विधि से फ़ीनॉलों को भी ईथरों में परिवर्तित किया जाता है। इसमें फ़ीनॉल का उपयोग फ़ीनाक्सॉइड अर्धांश (Moiety) के रूप में होता है।

7.6.2 भौतिक गुणधर्म
ईथर में $\mathrm{C}-\mathrm{O}$ आबंध ध्रुवीय होते हैं, अतः ईथरों का नेट द्विध्रुव आघूर्ण होता है। ईथरों की अल्प ध्रुवता उनके क्वथनांकों को बहुत अधिक प्रभावित नहीं करती, जो कि समतुल्य आण्विक द्रव्यमान वाले ऐल्केनों के क्वथनांकों के समान होते हैं, परंतु वे ऐल्कोहॉलों के क्वथनांकों से बहुत कम होते हैं, जैसा कि निम्नलिखित स्थितियों में दर्शाया गया है-
| सूत्र | $\mathrm{CH} _{3}\left(\mathrm{CH} _{2}\right) _{3} \mathrm{CH} _{3}$ | $\mathrm{C} _{2} \mathrm{H} _{5}-\mathrm{O}-\mathrm{C} _{2} \mathrm{H} _{5}$ | $\mathrm{CH} _{3}\left(\mathrm{CH} _{2}\right) _{3}-\mathrm{OH}$ |
|---|---|---|---|
| $\mathrm{n}$-पेन्टेन | एथॉक्सीएथेन | ब्यूटेन-1-ऑल | |
| क्वथनांक/ $\mathbf{K}$ | 309.1 | 307.6 | 390 |
ऐल्कोहॉलों एवं ईथरों के क्वथनांकों में अधिक अंतर का कारण ऐल्कोहॉलों में हाइड्रोजन आबंधों की उपस्थिति है।
ईथरों की जल में मिश्रणीयता, समान आण्विक द्रव्यमान वाले ऐल्कोहॉलों से सदृश्य होती है। एथॉक्सीएथेन एवं ब्यूटेन-1-ऑल दोनों ही जल में लगभग समान रूप से मिश्रणीय होते हैं अर्थात् $100 \mathrm{~mL}$ जल में क्रमशः $7.5 \mathrm{~g}$ तथा $9 \mathrm{~g}$ है जबकि पेन्टेन जल में अमिश्रणीय है। क्या आप इस प्रेक्षण को समझा सकते हैं? इसका कारण यह है कि ऐल्कोहॉलों की भाँति ईथरों का ऑक्सीजन परमाणु भी जल के साथ हाइड्रोजन आबंध बनाता है; जैसा कि चित्र में दर्शाया गया है।
7.6.3 रासायनिक अभिक्रियाएँ
1. ईथरों में $\mathbf{C}-\mathbf{O}$ आबंध का विदलन
ईथर प्रकार्यात्मक समूहों में सबसे कम अभिक्रियाशील होती हैं। ईथरों के $\mathrm{C}-\mathrm{O}$ आबंध का विदलन उग्र परिस्थितियों में हाइड्रोजन हैलाइडों के आधिक्य में होता है। डाइऐल्किल ईथर की अभिक्रिया से ऐल्किल हैलाइड के दो अणु प्राप्त होते हैं।
$$ \begin{aligned} & \mathrm{R}-\mathrm{O}-\mathrm{R}+\mathrm{HX} \longrightarrow \mathrm{RX}+\mathrm{R}-\mathrm{OH} \\ & \mathrm{R}-\mathrm{OH}+\mathrm{HX} \longrightarrow \mathrm{RX}+\mathrm{H} _{2} \mathrm{O} \end{aligned} $$
ऐरिल-ऑक्सीजन आबंध के अधिक स्थायी होने के कारण ऐल्किल ऐरिल ईथर का ऐल्किल-ऑक्सीजन आबंध विदलित होता है। इस अभिक्रिया से फ़ीनॉल एवं ऐल्किल हैलाइड प्राप्त होते हैं।
$$ \mathrm{R}-\mathrm{O}-\mathrm{R}^{\prime}+\mathrm{HX} \longrightarrow \mathrm{R}-\mathrm{X}+\mathrm{R}^{\prime}-\mathrm{OH} $$
दो विभिन्न ऐल्किल समूहों वाली ईथर भी इसी प्रकार से विदलित होती हैं।
$\mathrm{HI}>\mathrm{HBr}>\mathrm{HCl}$ ईथरों का विदलन सांद्र $\mathrm{HI}$ अथवा $\mathrm{HBr}$ द्वारा उच्च ताप पर होता है। जब इनमें से एक ऐल्किल समूह तृतीयक समूह होता है, तो तृतीयक हैलाइड प्राप्त होते हैं।
क्रियाविधि
ईथर की सांद्र $\mathrm{HI}$ के साथ अभिक्रिया, ईथर के अणु के प्रोटॉनन से प्रारंभ होती है।
चरण-1

अभिक्रिया $\mathrm{HI}$ या $\mathrm{HBr}$ के साथ होती है; क्योंकि ये अभिकर्मक पर्याप्त अम्लीय होते हैं।
चरण-2
आयोडाइड एक अच्छा नाभिकरागी है। यह पद 1 से प्राप्त ऑक्सोनियम आयन के अल्पतम प्रतिस्थापित कार्बन पर आक्रमण करता है और $\mathrm{S} _{\mathrm{N}} 2$ क्रियाविधि से ऐल्कोहॉल अणु को विस्थापित कर देता है। अतः दो भिन्न ऐल्किल समूह युक्त मिश्रित ईथर के विदलन से बनने वाली ऐल्कोहॉल तथा ऐल्किल आयोडाइड कौन से होंगे यह ऐल्किल समूहों की प्रकृति पर निर्भर करता है। जब प्राथमिक अथवा द्वितीयक ऐल्किल समूह उपस्थित होते हैं तो निम्नतर ऐल्किल समूह ऐल्किल आयोडाइड $\left(\mathrm{S} _{\mathrm{N}} 2\right.$ अभिक्रिया) बनते हैं।

जब $\mathrm{HI}$ आधिक्य में होता है और अभिक्रिया उच्च ताप पर की जाती है तो एथेनॉल, $\mathrm{HI}$ के दूसरे अणु के साथ अभिक्रिया करके एथिल आयोडाइड में परिवर्तित हो जाती है।
चरण-3

इसका कारण अभिक्रिया के चरण 2 में निष्कासित होने वाले $\left(\mathrm{OH}-\mathrm{CH} _{3}\right)$ समूह के निष्कासन से अधिक स्थायी कार्बोकेटायन $\left[\left(\mathrm{CH} _{3}\right) _{3} \mathrm{C}^{+}\right]$का बनाना जिससे अभिक्रिया $\mathrm{S} _{\mathrm{N}} 1$ क्रियाविधि द्वारा संपन्न होती है।

ऐनिसोल में ईथर के प्रोटॉनन द्वारा मेथिलफेनिल ऑक्सोनियम आयन $\mathrm{C} _{6} \mathrm{H} _{5}-\stackrel{+}{\mathrm{O}}-\mathrm{CH} _{3}$ बनता है। फेनिल समूह के कार्बन की $s p^{2}$ संकरण अवस्था तथा $\left(\mathrm{O}-\mathrm{C} _{6} \mathrm{H} _{5}\right)$ समूह के आंशिक द्विआबंध अभिलक्षण के कारण $\mathrm{O}-\mathrm{CH} _{3}$ का आबंध $\mathrm{O}-\mathrm{C} _{6} \mathrm{H} _{5}$ आबंध की तुलना में दुर्बल होता है। इसलिए $\mathrm{I}^{-}$आयन का आक्रमण $\mathrm{O}-\mathrm{CH} _{3}$ आबंध को तोड़कर $\mathrm{CH} _{3} \mathrm{I}$ बनाता है। फ़ीनॉल पुन: अभिक्रिया करके हैलाइड नहीं देते क्योंकि फ़ीनॉल का $s p^{2}$ संकरित कार्बन (नाभिकरागी) प्रतिस्थापन अभिक्रिया नहीं दर्शा सकता जो कि हैलाइड में परिवर्तन के लिए आवश्यक है।
उदाहरण 7.7 निम्नलिखित ईथरों को $\mathrm{HI}$ के साथ गरम करने से प्राप्त मुख्य उत्पाद दीजिए।

हल

2. इलेक्ट्रॉनरागी प्रतिस्थापन ऐल्कॉक्सी समूह (-OR) ऑर्थो एवं पैरा निर्देशक होता है तथा यह फ़ीनॉल के $-\mathrm{OH}$ समूह के समान ही ऐरोमैटिक वलय को इलेक्ट्रॉनरागी प्रतिस्थापन के प्रति सक्रिय करता है।

(i) हैलोजनन- फ़ेनिलऐल्किल ईथर, बेन्जीन वलय में सामान्य हैलोजनन अभिक्रियाएं देता है। उदाहरणार्थ; ऐनिसोल का ब्रोमीनन, एथेनॉइक अम्ल में घुली ब्रोमीन द्वारा, आयरन (III) ब्रोमाइड उत्प्रेरक की अनुपस्थिति में भी होता है। ऐसा मेथॉक्सी समूह द्वारा बेन्जीन वलय के सक्रिमण के कारण होता है। इसमें पैरा समावयवी की लब्धि $90 \%$ होती है।

(ii) फ्रीडेल क्राफ्ट अभिक्रिया- ऐनिसोल फ्रीडेल-क्राफ्ट अभिक्रिया देता है ऐलुमीनियम क्लोराइड (एक लुईस अम्ल) उत्प्रेरक की उपस्थिति में ऐल्किल हैलाइड तथा ऐसिल हैलाइड की अभिक्रिया द्वारा ऐल्किल तथा ऐसिल समूह ऑर्थो तथा पैरा स्थितियों पर प्रवेश करते हैं।

(iii) नाइट्रोकरण— ऐनिसोल, सांद्र $\mathrm{H} _{2} \mathrm{SO} _{4}$ और सांद्र $\mathrm{HNO} _{3}$ के मिश्रण के साथ अभिक्रिया द्वारा ऑर्थो और पैरा नाइट्रोएनिसोल का मिश्रण देता है।

पाठ्यनिहित प्रश्न
7.10 एथेनॉल एवं 3 -मेथिलपेन्टेन-2-ऑल से प्रारंभ कर 2 -एथॉक्सी-3-मेथिलपेन्टेन के विलयम्सन संश्लेषण की अभिक्रिया लिखिए।
Show Answer
#missing7.11 1-मेथॉक्सी-4-नाइट्रोबेन्जीन के विरचन के लिए निम्नलिखित अभिकारकों में से कौन सा युग्म उपयुक्त है और क्यों?

Show Answer
#missing7.12 निम्नलिखित अभिक्रियाओं से प्राप्त उत्पादों का अनुमान लगाइए-

Show Answer
#missingसारांश
ऐल्कोहॉलों एवं फ़ीनॉलों का वर्गीकरण- (i) हाइड्रॉक्सिल समूहों की संख्या व (ii) कार्बन परमाणु के $s p^{3}$ या $s p^{2}$ संकरण जिससे कि $-\mathrm{OH}$ समूह जुड़ा होता है, के आधार पर किया जाता है। ईथरों का वर्गीकरण ऑक्सीजन परमाणु से जुड़े समूहों के आधार पर किया जाता है।
ऐल्कोहॉलों को निम्नलिखित विधियों द्वारा बनाया जा सकता है-(1) ऐल्कीनों के जलयोजन से- (i) अम्ल की उपस्थिति में तथा (ii) हाइड्रोबोरॉनन-आक्सीकरण अभिक्रिया द्वारा (2) कार्बोनिल यौगिकों से- (i) उत्प्रेकी अपयचन तथा (ii) ग्रीन्यार अभिकर्मक की क्रिया द्वारा फ़ीनॉलों को निम्नलिखित विधियों द्वारा बनाया जा सकता है- (1) $-\mathrm{OH}$ समूह से प्रतिस्थापन द्वारा- (i) हैलोऐरीन में हैलोजन परमाणु का तथा (ii) ऐरिल सल्फोनिक अम्ल में सल्फोनिक अम्ल समूह का प्रतिस्थापन। (2) डाइऐज़ोनियम लवणों के जलअपघटन द्वारा। (3) क्यूमीन से औद्योगिक उत्पादन द्वारा।
लगभग तुल्य द्रव्यमान वाले अन्य वर्गों, जैसे- हाइड्रोकार्बनों, ईथरों तथा हैलोऐल्केनों के यौगिकों की तुलना में ऐल्कोहॉलों के क्वथनांक अधिक होते हैं। ऐल्कोहॉलों, फ़ीनॉलों एवं ईथरों की जल के साथ अंतराआण्विक हाइड्रोजन आबंध बनाने की क्षमता के कारण यह जल में घुलनशील होती हैं।
ऐल्कोहॉल एवं फ़ीनॉल अम्लीय प्रकृति की होती हैं। फ़ीनॉलों में इलेक्ट्रॉन अपनयक समह इनकी अम्ल प्रबलता को बढ़ाते हैं तथा इलेक्ट्रॉन दाता ( विमोचक ) समूह अम्ल प्रबलता को कम करते हैं।
ऐल्कोहॉल हाइड्रोजन हैलाइडों के साथ नाभिकरागी प्रतिस्थापन द्वारा ऐल्किल हैलाइड प्रदान करते हैं। ऐल्कोहॉलों का निर्जलन ऐल्कीन देता है। दुर्बल ऑक्सीकारकों द्वारा प्राथमिक ऐल्कोहॉल ऑक्सीकृत होकर ऐल्डिहाइड प्रदान करते हैं तथा प्रबल ऑक्सीकारकों द्वारा कार्बोक्सिलिक अम्ल प्राप्त होते हैं। जबकि द्वितीयक ऐल्कोहॉल कीटोन देते हैं। तृतीयक ऐल्कोहॉल ऑक्सीकरण प्रतिरोधी होते हैं।
फ़ीनॉलों में, $-\mathrm{OH}$ समूह की उपस्थिति, ऐरोमैटिक वलय को इलेक्ट्रॉनरागी प्रतिस्थापन के प्रति सक्रियित कर देती है एवं अनुनादी प्रभाव के कारण आने वाले समूह को ऑर्थो तथा पैरा स्थितियों की ओर निर्दिष्ट करती है। फ़ीनॉल की राइमर-टीमन अभिक्रिया सैलिसैल्डिहाइड प्रदान करती है। सोडियम हाइड्राक्साइड की उपस्थिति में फ़ीनॉल फ़ीनॉक्साइड आयन देता है जो फ़ीनॉल से अधिक क्रियाशील होता है अतः क्षारीय माध्यम में फ़ीनॉल कोल्बे अभिक्रिया देती है।
ईथरों को- (i) ऐल्कोहॉलों के निर्जलन तथा (ii) विलियम्सन संश्लेषण विधि द्वारा बनाया जाता है। ईथरों के क्वथनांक ऐल्केनों से मिलते-जुलते होते हैं। जबकि इनकी विलेयता समान आण्विक द्रव्यमान वाले ऐल्कोहॉलों से तुल्य होती हैं। ईथरों के $\mathrm{C}-\mathrm{O}$ आबंध को हाइड्रोजन हैलाइडों द्वारा विदलित किया जा सकता है। इलेक्ट्रॉनरागी प्रतिस्थापन में, ऐल्कॉक्सी समूह ऐरोमैटिक वलय को सक्रिय बनाता है तथा प्रवेश करने वाले समूह को ऑर्थो एवं पैरा स्थितियों की ओर निर्दिष्ट करता है।
अभ्यास
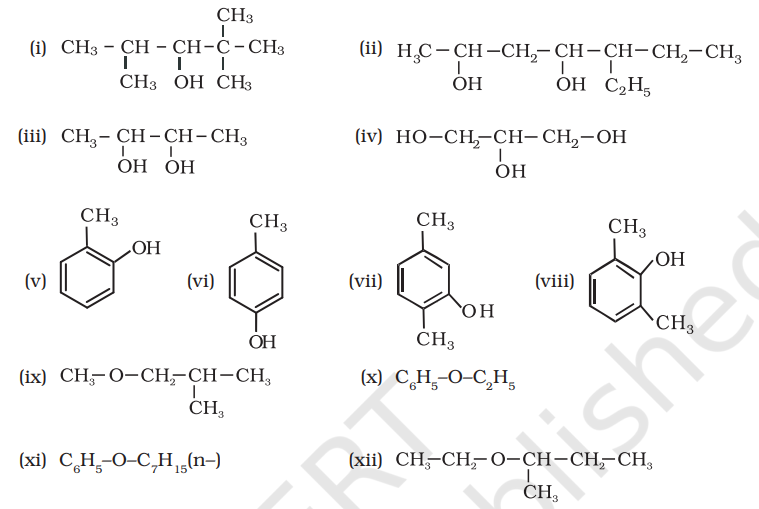
7.1 निम्नलिखित यौगिकों के आईयूपीएसी (IUPAC) नाम लिखिए।
Show Answer
#missing7.2 निम्नलिखित आईयूपीएसी (IUPAC) नाम वाले यौगिकों की संरचनाएं लिखिए-
(i) 2-मेथिलब्यूटेन-2-ऑल
(ii ) 1-फ़ेनिलप्रोपेन-2-ऑल
(iii) 3,5 -डाइमेथिलहैक्सेन- $1,3,5$,-ट्राइऑल
(iv) 2,3-डाइएथिलफ़ीनॉल
(v) 1-एथॉक्सीप्रोपेन
(vi) 2-एथॉक्सी-3-मेथिलपेन्टेन
(vii) साइक्लोहैक्सिलमेथेनॉल
(viii) 3-साइक्लोहैक्सिलपेन्टेन-3-ऑल
(ix) साइक्लोपेन्टेन-3-ईन-1-ऑल
(x) 4-क्लोरो-3-एथिलब्यूटेन-1-ऑल
Show Answer
#missing7.3 (i) $\mathrm{C} _{5} \mathrm{H} _{12} \mathrm{O}$ आण्विक सूत्र वाले ऐल्कोहॉलों के सभी समावयवों की संरचना लिखिए एवं उनके आईयूपीएसी (IUPAC) नाम दीजिए।
(i) के समावयवी ऐल्कोहॉलों को प्राथमिक, द्वितीयक एवं तृतीयक ऐल्कोहॉलों में वर्गीकृत कीजिए।
(ii) प्रश्न 11.3
Show Answer
#missing7.4 समझाइए कि प्रोपेनॉल का क्वथनांक, हाइड्रोकार्बन ब्यूटेन से अधिक क्यों होता है?
Show Answer
#missing7.5 समतुल्य आण्विक भार वाले हाइड्रोकार्बनों की अपेक्षा ऐल्कोहॉल जल में अधिक विलेय होते हैं इस तथ्य को समझाइए।
Show Answer
#missing7.6 हाइड्रोबोरॉनन-ऑक्सीकरण अभिक्रिया से आप क्या समझते हैं? इसे उदाहरण सहित समझाइए।
Show Answer
#missing7.7 आण्विक सूत्र $\mathrm{C} _{7} \mathrm{H} _{8} \mathrm{O}$ वाले मोनोहाइड्रिक फ़ीनॉलों की संरचनाएं तथा आईयूपीएसी (IUPAC) नाम लिखिए।
Show Answer
#missing7.8 ऑर्थो तथा पैरा-नाइट्रोफ़ीनॉलों के मिश्रण को भाप-आसवन द्वारा पृथक् करने में भाप-वाष्पशील समावयवी का नाम बताइए। इसका कारण दीजिए।
Show Answer
#missing7.9 क्यूमीन से फ़ीनॉल बनाने की अभिक्रिया का समीकरण दीजिए।
Show Answer
#missing7.10 क्लोरोबेन्जीन से फ़ीनॉल बनाने की रासायनिक अभिक्रिया लिखिए।
Show Answer
#missing7.11 एथीन के जलयोजन से एथेनॉल प्राप्त करने की क्रियाविधि लिखिए।
Show Answer
#missing7.12 आपको बेन्जीन, सांद्र $\mathrm{H} _{2} \mathrm{SO} _{4}$ और $\mathrm{NaOH}$ दिए गए हैं। इन अभिकर्मकों के उपयोग द्वारा फ़ीनॉल के विरचन की समीकरण लिखिए।
Show Answer
#missing7.13 आप निम्नलिखित को कैसे संश्लेषित करेंगे? दर्शाइए।
(i) एक उपयुक्त ऐल्कीन से 1-फ़ेनिलएथेनॉल
(ii) $\mathrm{S} _{\mathrm{N}} 2$ अभिक्रिया द्वारा ऐल्किल हैलाइड के उपयोग से साइक्लोहेक्सिलमेथेनॉल
(iii) एक उपयुक्त ऐल्किल हैलाइड के उपयोग से पेन्टेन-1-ऑल
Show Answer
#missing7.14 ऐसी दो अभिक्रियाएं दीजिए जिनसे फ़ीनॉल की अम्लीय प्रकृति प्रदर्शित होती हो, फ़ीनाल की अम्लता की तुलना एथेनॉल से कीजिए।
Show Answer
#missing7.15 समझाइए कि ऑर्थो-नाइट्रोफ़ीनॉल, ऑर्थो-मेथॉक्सीफ़ीनॉल से अधिक अम्लीय क्यों होती है?
Show Answer
#missing7.16 समझाइए कि बेन्जीन वलय से जुड़ा $-\mathrm{OH}$ समूह उसे इलेक्ट्रॉनरागी प्रतिस्थापन के प्रति कैसे सक्रियित करता है?
Show Answer
#missing7.17 निम्नलिखित अभिक्रियाओं के लिए समीकरण दीजिए-
(i) प्रोपेन-1-ऑल का क्षारीय $\mathrm{KMnO} _{4}$ के साथ ऑक्सीकरण
(ii) ब्रोमीन की $\mathrm{CS} _{2}$ में फ़ीनॉल के साथ अभिक्रिया
(iii) तनु $\mathrm{HNO} _{3}$ की फ़ीनॉल से अभिक्रिया
(iv) फ़ीनॉल की जलीय $\mathrm{NaOH}$ की उपस्थिति में क्लोरोफार्म के साथ अभिक्रिया
Show Answer
#missing7.18 निम्नलिखित को उदाहरण सहित समझाइए-
(i) कोल्बे अभिक्रिया
(ii) राइमर-टीमन अभिक्रिया
(iii) विलियम्सन ईथर संश्लेषण
(iv) असममित ईथर।
Show Answer
#missing7.19 एथेनॉल के अम्लीय निर्जलन से एथीन प्राप्त करने की क्रियाविधि लिखिए।
Show Answer
#missing7.20 निम्नलिखित परिवर्तनों को किस प्रकार किया जा सकता है?
(i) प्रोपीन $\rightarrow$ प्रापेन-2-ऑल
(ii) बेन्जिल क्लोराइड $\rightarrow$ बेन्जिल ऐल्कोहॉल
(iii) एथिल मैग्नीशियम क्लोराइड $\rightarrow$ प्रापेन-1-ऑल
(iv) मेथिल मैग्नीशियम ब्रोमाइड $\rightarrow 2$-मेथिलप्रोपेन-2-ऑल
Show Answer
#missing7.21 निम्नलिखित अभिक्रियाओं में प्रयुक्त अभिकर्मकों के नाम बताइए-
(i) प्राथमिक ऐल्कोहॉल का कार्बोक्सिलिक अम्ल में आक्सीकरण अम्ल
(ii) प्राथमिक ऐल्कोहॉल का ऐल्डिहाइड में आक्सीकरण
(iii) फ़ीनॉल का $2,4,6$-ट्राइब्रोमोफीनॉल में ब्रोमीनन
(iv) बेन्जिल ऐल्कोहॉल से बेन्ज़ोइक
(v) प्रोपेन-2-ऑल का प्रोपीन में निर्जलन
(vi) ब्यूटेन-2-ऑन से ब्यूटेन-2-ऑल
Show Answer
#missing7.22 कारण बताइए कि मेथॉक्सीमेथेन की तुलना में एथेनॉल का क्वथनांक उच्च क्यों होता है?
Show Answer
#missing7.23 निम्नलिखित ईथरों के आईयूपीससी (IUPAC) नाम दीजिए-
(i) $\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OCH} _{2}-\underset{\underset{\mathrm{CH_3}}{\text { | }}}{\mathrm{CH} _{3}} \mathrm{CH}-\mathrm{CH} _{3}$
(ii) $\mathrm{CH} _{3} \mathrm{OCH} _{2} \mathrm{CH} _{2} \mathrm{Cl}$
(iii) $\mathrm{O} _{2} \mathrm{~N}-\mathrm{C} _{6} \mathrm{H} _{4}-\mathrm{OCH} _{3}(p)$
(iv) $\mathrm{CH} _{3} \mathrm{CH} _{2} \mathrm{CH} _{2} \mathrm{OCH} _{3}$

Show Answer
#missing7.24 निम्नलिखित ईथरों को विलियम्सन संश्लेषण द्वारा बनाने के लिए अभिकर्मकों के नाम एवं समीकरण लिखिए-
(i) 1-प्रोपॉक्सीप्रोपेन
(ii) एथॉक्सीबेन्जीन
(iii) 2-मेथॉक्सी-2-मेथिलप्रोपेन
(iv) 1 -मेथॉक्सीएथेन
Show Answer
#missing7.25 कुछ विशेष प्रकार के ईथरों को विलियम्सन संश्लेषण द्वारा बनाने की सीमाओं को उदाहरणों से समझाइए।
Show Answer
#missing7.26 प्रोपेन-1-ऑल से 1-प्रोपाक्सीप्रोपेन को किस प्रकार बनाया जाता है? इस अभिक्रिया की क्रियाविधि लिखिए।
Show Answer
#missing7.27 द्वितीयक अथवा तृतीयक ऐल्कोहॉलों के अम्लीय निर्जलन द्वारा ईथरों को बनाने की विधि उपयुक्त नहीं है। कारण बताइए।
Show Answer
#missing7.28 हाइड्रोजन आयोडाइड की निम्नलिखित के साथ अभिक्रिया के लिए समीकरण लिखिए-
(i) 1 -प्रोपॉक्सीप्रोपेन
(ii) मेथॉक्सीबेन्जीन तथा
(iii) बेन्ज़िल एथिल ईथर
Show Answer
#missing7.29 ऐरिल ऐल्किल ईथरों में निम्न तथ्यों की व्याख्या कीजिए-
(i) ऐल्कॉक्सी समूह बेन्जीन वलय को इलेक्ट्रॉनरागी प्रतिस्थापन के प्रति सक्रियित करता है, तथा
(ii) यह प्रवेश करने वाले प्रतिस्थापियों को बेन्जीन वलय की ऑर्थो एवं पैरा स्थितियों की ओर निर्दिष्ट करता है।
Show Answer
#missing7.30 मेथॉक्सीमेथेन की HI के साथ अभिक्रिया की क्रियाविधि लिखिए।
Show Answer
#missing7.31 निम्नलिखित अभिक्रियाओं के लिए समीकरण लिखिए-
(i) फ्रीडेल-क्राफ्ट अभिक्रिया-ऐनिसोल का ऐल्किलन
(iii) एथेनॉइक अम्ल माध्यम में ऐनिसोल का ब्रोमीनन
(ii) ऐनिसोल का नाइट्रोकरण
(iv) ऐनिसोल का फ्रीडेल-क्राफ्ट ऐसीटिलन।
Show Answer
#missing7.32 उपयुक्त ऐल्कीनों से आप निम्नलिखित ऐल्कोहॉलों का संश्लेषण कैसे करेंगे?

Show Answer
#missing7.33 3-मेथिलब्यूटेन-2-ऑल को $\mathrm{HBr}$ से अभिकृत कराने पर निम्नलिखित अभिक्रिया होती है-

इस अभिक्रिया की क्रियाविधि दीजिए। (संकेत- चरण II में प्राप्त द्वितीयक कार्बोकैटायन हाइड्राइड आयन विचलन के कारण पुनर्विन्यासित होकर स्थायी तृतीयक कार्बोकैटायन बनाते हैं।)










