ऐमीनों का मुख्य व्यावसायिक उपयोग औषधियों और तंतुओं के संश्लेषण में मध्यवर्तियों के रूप में होता है।
ऐमीन, अमोनिया अणु से एक अथवा अधिक हाइड्रोजन परमाणुओं के ऐल्किल अथवा ऐरिल समूहों द्वारा विस्थापन से प्राप्त कार्बनिक यौगिकों का एक महत्वपूर्ण वर्ग बनाती हैं। प्रकृति में ये प्रोटीन, विटामिन, ऐल्केलॉइड तथा हॉर्मोनों में पाए जाती हैं। संश्लेषित उदाहरणों में बहुलक, रंजक और औषध सम्मिलित हैं। दो जैव-सक्रिय यौगिक, मुख्यतया - ऐड्रीनलिन और इफेड्रिन, का उपयोग रक्त-चाप बढ़ाने के लिए किया जाता है दोनों में ही द्वितीयक ऐमीनों समूह होता है। एक संश्लेषित यौगिक ‘नोवोकेन’ का उपयोग दंतचिकित्सा में निश्चेतक के रूप में किया जाता है। प्रसिद्ध प्रतिहिस्टैमिन ‘बैनैड्रिल’ में भी तृतीयक ऐमीनो समूह उपस्थित है। चतुष्क अमोनियम लवणों का प्रयोग पृष्ठसक्रियक के रूप में होता है। डाइऐज़ोनियम लवण, रंजकों सहित विभिन्न ऐरोमैटिक यौगिकों को बनाने में मध्यवर्ती होते हैं। इस एकक में आप ऐमीन एवं डाइऐज़ोनियम लवणों के विषय में विस्तृत जानकारी प्राप्त करेंगे।
I. ऐमीन
ऐमीन को अमोनिया के एक, दो अथवा तीनों हाइड्रोजन परमाणुओं को ऐल्किल और/अथवा ऐरिल समूहों द्वारा विस्थापित कर प्राप्त हुए व्युत्पन्न के रूप में माना जा सकता है।
उदाहरणार्थ-
9.1 डेमीनों की संरचना
अमोनिया की भाँति, ऐमीन का नाइट्रोजन परमाणु त्रिसंयोजी है एवं इस पर एक असहभाजित इलेक्ट्रॉन युगल है। ऐमीन में नाइट्रोजन के कक्षक
की उपस्थिति के कारण

चित्र 9.1-ट्राईमेथिलऐमीन की पिरैमिडी आकृति
9.2 वर्गीकरण
अमोनिया अणु में ऐल्किल अथवा ऐरिल समूहों द्वारा प्रतिस्थापित हाइड्रोजन परमाणुओं की संख्या के आधार पर ऐमीनों का वर्गीकरण, प्राथमिक
9.3 नामपद्धति
सामान्य पद्धति में ऐलिफैटिक ऐमीन का नामकरण ऐमीन शब्द में पूर्वलग्न ऐल्किल लगाकर एक शब्द में, यानी ऐल्किलऐमीन के रूप में किया जाता है, जैसे- मेथिलऐमीन। द्वितीयक एवं तृतीयक ऐमीनों में जब दो अथवा अधिक समूह समान होते हैं तब ऐल्किल समूह के नाम से पहले पूर्वलग्न डाइ अथवा ट्राइ का प्रयोग किया जाता है। आईयूपीएसी पद्धति में ऐमीनों का नामकरण ऐल्केनेमीन के रूप में होता है। उदाहरणार्थ
द्वितीयक तथा तृतीयक ऐमीन में
ऐरिल ऐमीनों में
सारणी 9.1-कुछ ऐल्किल एवं ऐरिल ऐमीनों की नामपद्धति

9.4 ऐमीनों का विरचन
ऐमीनों का विरचन निम्नलिखित विधियों से किया जाता है।
1. नाइट्रो यौगिकों का अपचयन
नाइट्रो यौगिक सूक्ष्म विभाजित निकैल, पैलेडियम अथवा प्लैटिनम की उपस्थिति में हाइड्रोजन गैस प्रवाहित करने से ऐमीनों में अपचित हो जाते हैं। अम्लीय माध्यम में धातुओं द्वारा भी इनका अपचयन हो सकता है। इसी प्रकार से नाइट्रोऐल्कीन भी संगत ऐल्केनेमीनों में अपचित की जा सकती हैं।
(i)

(ii)

रद्दी लोहे एवं हाइड्रोक्लोरिक अम्ल द्वारा अपचयन को वरीयता दी जाती है, क्योंकि अभिक्रिया में जनित
2. ऐल्किल हैलाइडों का ऐमोनीअपघटन
आपने एकक 6 में पढ़ा है कि ऐल्किल अथवा बेन्जिल हैलाइडों में कार्बन-हैलोजन आबंध नाभिकरागी द्वारा सरलता से विदलित हो जाता है। अतः ऐल्किल अथवा बेन्जिल हैलाइड अमोनिया के ऐथेनॉलिक विलयन से नाभिकरागी प्रतिस्थापन अभिक्रिया करते हैं जिसमें हैलोजन परमाणु ऐमीनो


इस अभिक्रिया में हैलाइडों की ऐमीनों से अभिक्रियाशीलता का क्रम
अमोनीअपघटन में यह असुविधा है कि इससे प्राथमिक, द्वितीयक एवं तृतीयक ऐमीन तथा चतुष्क अमोनियम लवण का मिश्रण प्राप्त होता है। यद्यपि अमोनिया आधिक्य में लेने पर प्राप्त मुख्य उत्पाद प्राथमिक ऐमीन हो सकता है।
3. नाइट्राइलों का अपचयन
नाइट्राइल लीथियम ऐलुमिनियम हाइड्राइड
4. ऐमाइडों का अपचयन
ऐमाइड लीथियम ऐलुमिनियम हाइड्राइड द्वारा अपचित होकर ऐमीन देते हैं।

5. गैब्रिएल थैलिमाइड संश्लेषण
गैब्रिएल संश्लेषण का प्रयोग प्राथमिक ऐमीनों के विरचन के लिए किया जाता है। थैलिमाइड ऐथेनॉलिक पोटैशियम हाइड्रॉक्साइड से अभिक्रिया द्वारा थैलिमाइड का पोटैशियम लवण बनाता है जो ऐल्किल हैलाइड के साथ गरम करने के पश्चात् क्षारीय जलअपघटन द्वारा संगत प्राथमिक ऐमीन उत्पन्न करता है। ऐरोमैटिक प्राथमिक ऐमीन इस विधि से नहीं बनाई जा सकतीं क्योंकि ऐरिल हैलाइड थैलिमाइड से प्राप्त ऋणायन के साथ नाभिकरागी प्रतिस्थापन; अभिक्रिया नहीं कर सकते।
थैलिमाइड
(
6. हॉफमान ब्रोमामाइड निम्नीकरण अभिक्रिया
हॉफमान ने प्राथमिक ऐमीनों के विरचन के लिए एक विधि विकसित की जिसमें किसी ऐमाइड की

9.5 औतिक गुणधर्म
निम्नतर ऐलिफैटिक ऐमीन मत्स्य गंध वाली गैसें हैं। तीन अथवा अधिक कार्बन परमाणु वाली प्राथमिक ऐमीन द्रव तथा इससे उच्चतर ऐमीन ठोस हैं। ऐनिलीन तथा अन्य ऐरिलऐमीन प्राय: रंगहीन होती हैं। परंतु भंडारण के दौरान वातावरण द्वारा ऑक्सीकरण होने से रंगीन हो जाती हैं।
निम्नतर ऐलिफैटिक ऐमीन जल में विलेय होती हैं, क्योंकि यह जल के अणुओं के साथ हाइड्रोजन आबंध बना सकती हैं। हालाँकि, अणुभार में वृद्धि के साथ जलविरागी (Hydrophlic) ऐल्किल भाग बढ़ जाता है अतः जल में विलेयता घटती है। उच्चतर ऐमीन जल में आवश्यक रूप से अविलेय होती हैं। ऐमीन की नाइट्रोजन एवं ऐल्कोहॉल की ऑक्सीजन की विद्युतऋणात्मकता क्रमशः 3.0 एवं 3.5 मानने पर आप ऐमीनों एवं ऐल्कोहलों की जल में विलेयता के पैटर्न की प्रागुक्ति कर सकते हैं। ब्यूटेन-1-ऑल एवं ब्यूटेन-1-ऐमीन में से कौन जल में अधिक विलेय होगा और क्यों? ऐमीन कार्बनिक विलायकों जैसे ऐल्कोहॉल, ईथर एवं बेन्जीन में विलेय होती है। आपको याद होगा कि एल्कोहॉल ऐमीन की तुलना में अधिक ध्रुवित होती हैं तथा ऐमीन की तुलना में प्रबल अंतराआण्विक हाइड्रोजन आबंध बनाती हैं।
प्राथमिक एवं द्वितीयक ऐमीनों में एक अणु का नाइट्रोजन परमाणु दूसरे अणु के हाइड्रोजन परमाणु से आबंधित होने के कारण इनमें अंतराआण्विक संघटन होता है। यह अंतराआण्विक संघटन प्राथमिक ऐमीनों में द्वितीयक एमीनों की तुलना में हाइड्रोजन आबंधन के लिए दो हाइड्रोजन परमाणुओं की उपलब्धता के कारण अधिक होता है। तृतीयक ऐमीन में नाइट्रोजन
पर हाइड्रोजन अणुओं के अभाव के कारण अंतराआण्विक संघटन नहीं होता। अतः समावयवी ऐमीनों के क्वथनांकों का क्रम निम्नलिखित होगा-
प्राथमिक > द्वितीयक > तृतीयक
प्राथमिक ऐमीन में उपस्थित अंतराआण्विक हाइड्रोजन आबंधन को चित्र 9.2 में दर्शाया गया है।
चित्र 9.2 - प्राथमिक ऐमीन में अंतराआण्विक हाइड्रोजन आबंधन
लगभग समान आण्विक द्रव्यमान वाली ऐमीनों, ऐल्कोहॉलों एवं एल्केनों के क्वथनांक सारणी 9.2 में दर्शाए गए हैं।
सारणी 9.2-लगभग समान आण्विक द्रव्यमान वाली ऐमीनों, ऐल्कोहॉलों एवं एल्केनों के क्वथनांकों की तुलना
| क्र. सं. | अौगिक | अणुव्यमान | क्वथनांक (K) |
|---|---|---|---|
| 1. | 73 | 350.8 | |
| 2. | 73 | 329.3 | |
| 3. | 73 | 310.5 | |
| 4. | 72 | 300.8 | |
| 5. | 74 | 390.3 |
9.6 राभायनिक अभिक्रिर्याडँ
नाइट्रोजन एवं हाइड्रोजन परमाणुओं की विद्युतऋणात्मकता में अंतर तथा नाइट्रोजन परमाणु पर असहभाजित इलेक्ट्रॉन युगल की उपस्थिति ऐमीन को सक्रिय बना देती है। नाइट्रोजन परमाणुओं से जुड़ी हाइड्रोजन परमाणुओं की संख्या भी ऐमीन की अभिक्रिया का पथ निर्धारित करती है। इसलिए प्राथमिक
1. ऐमीनों का क्षारकीय गुण
क्षारकीय प्रकृति होने के कारण ऐमीन अम्लों से अभिक्रिया कर लवण बनाती हैं।

ऐमीन लवण
ऐमीन लवण जल में विलेय किंतु ईथर जैसे कार्बनिक विलायकों में अविलेय होते हैं। यह अभिक्रिया जल में अविलेय अक्षारकीय कार्बनिक यौगिकों को ऐमीन से पृथक् करने का आधार है।
ऐमीन की खनिज अम्लों से अभिक्रिया द्वारा लवणों का बनना इनकी क्षारकीय प्रकृति को दर्शाता है। ऐमीनों में एक असहभाजित इलेक्ट्रॉन युगल उपस्थित होने के कारण यह लूईस क्षारक की भाँति व्यवहार करती है । ऐमीनों के क्षारकीय गुण को उनके
अमोनिया का
सारणी 9.3-जलीय प्रावस्था में कुछ ऐमीनों के
| ऐमीन का नाम | |
|---|---|
| मेथेनेमीन | 3.38 |
| 3.27 | |
| 4.22 | |
| एथेनेमीन | 3.29 |
| 3.00 | |
| 3.25 | |
| बेन्जीनऐमीन | 9.38 |
| फ़ेनिलमेथेनेमीन | 4.70 |
| 9.30 | |
| 8.92 |
प्रतिस्थापियों के
ऐमीनों की संरचना तथा क्षारकता में संबंध
ऐमीनों की क्षारकता इनकी संरचना से संबंधित होती है। ऐमीनों का क्षारकीय गुण अम्ल से प्रोटॉन ग्रहण कर धनायन बनाने की सहजता पर निर्भर करता है, ऐमीन की तुलना में धनायन जितना अधिक स्थायी होता है ऐमीन उतनी ही अधिक क्षारकीय होती है।
( क) ऐल्केनेमीन बनाम अमोनिया
आइए हम ऐल्केनेमीन और अमोनिया की क्षारकता की तुलना करने के लिए इनकी प्रोटॉन से अभिक्रिया की तुलना करें।
इलेक्ट्रॉन मुक्त करने की प्रकृति के कारण ऐल्किल
जल में हाइड्रोजन आबंधन तथा विलायकन द्वारा स्थायित्व के कम होने का क्रम
प्रतिस्थापित अमोनियम धनायन का स्थायित्व जितना अधिक होता है, संगत ऐमीन का क्षारकीय प्राबल्य उतना ही अधिक होना चाहिए। अतः ऐलिफैटिक एमीनों की क्षारकता का क्रम, प्राथमिक
( ख) ऐरिलऐमीन बनाम अमोनिया
ऐनिलीन के

ऐनिलीनियम धनायन की अनुनादी संरचनाएं
हम जानते हैं कि जितनी अधिक अनुनादी संरचनाएं होती हैं स्थायित्व उतना ही अधिक होता है। अतः आप निष्कर्ष निकाल सकते हैं कि ऐनिलीन (पाँच अनुनादी संरचनाएं) ऐनिलीनियम आयन से अधिक स्थायी होती हैं। अतः एनिलीन अथवा अन्य ऐरोमैटिक ऐमीनों की प्रोटोन स्वीकार्यता अथवा क्षारक गुण कम होगा। प्रतिस्थापित ऐनिलीन में यह देखा गया है कि इलेक्ट्रॉन मुक्त करने वाले समूह जैसे
2. ऐल्किलन
ऐमीन ऐल्किल हैलाइडों के साथ ऐल्किलन अभिक्रिया देती हैं। (देखें कक्षा 12 , एकक 6)
3. ऐसिलन
ऐलीफैटिक तथा ऐरोमैटिक प्राथमिक एवं द्वितीयक ऐमीन ऐसिड क्लोराइड, ऐनहाइड्राइड और ऐस्टर से नाभिकरागी प्रतिस्थापन अभिक्रिया करते हैं। यह अभिक्रिया ऐसिलन कहलाती है। आप इस अभिक्रिया को
ऐसिलन अभिक्रिया से प्राप्त उत्पादों को ऐमाइड कहते हैं। यह अभिक्रिया ऐमीन से अधिक प्रबल क्षारक, जैसे पिरीडीन की उपस्थिति में कराई जाती है जो अभिक्रिया में बने 
ऐमीन बेन्जॉयल क्लोराइड
मेथेनेमीन बेन्जॉयल क्लोराइड
क्या आप जानते हैं कि ऐमीन तथा कार्बोक्सिलिक अम्ल की अभिक्रिया से प्राप्त उत्पाद क्या होगा? ये कमरे के ताप पर ऐमीन से अभिक्रिया द्वारा लवण बनाते हैं।
4. कार्बिलऐमीन अभिक्रिया
ऐलिफैटिक तथा ऐरोमैटिक प्राथमिक ऐमीन, क्लोरोफ़ार्म और एथेनॉलिक पोटैशियम हाइड्रॉक्साइड के साथ गर्म करने पर दुर्गंधयुक्त पदार्थ आइसोसायनाइड अथवा कर्बिलऐमीन का विरचन करती हैं। द्वितीयक एवं तृतीयक ऐमीन यह अभिक्रिया नहीं दर्शातीं। इस अभिक्रिया को कार्बिलऐमीन अभिक्रिया अथवा आइसोसायनाइड परीक्षण कहते हैं तथा यह प्राथमिक ऐमीनों के परीक्षण में प्रयुक्त होती है।

5. नाइट्रस अम्ल से अभिक्रिया
खनिज अम्ल एवं सोडियम नाइट्राइट की अभिक्रिया से स्वस्थान (in situ) बनायी गई तीनों वर्गों की ऐमीन नाइट्रस अम्ल से अलग-अलग तरह से अभिक्रिया करती हैं।
( क) प्राथमिक ऐलीफैटिक ऐमीन नाइट्रस अम्ल से अभिक्रिया द्वारा ऐलीफैटिक डाइऐज़ोनीयम लवण बनाती हैं जो अस्थायी होने के कारण मात्रात्मकतः नाइट्रोजन निर्मुक्त करती हैं और एल्कोहॉल बनाती हैं। नाइट्रोजन की मात्रात्मकतः निकासी का उपयोग ऐमीनो अम्लों एवं प्रोटीनों के आकलन में किया जाता है।
( ख) ऐरोमैटिक ऐमीन नाइट्रस अम्ल से कम ताप (273-268 K) पर अभिक्रिया कर डाइऐज़ोनियम लवण बनाती हैं। यह यौगिकों का एक महत्वपूर्ण वर्ग है जिसका उपयोग विभिन्न प्रकार के ऐरोमैटिक यौगिकों के संश्लेषण में होता है। जिनका वर्णन खंड 9.7 में किया गया है।
द्वितीयक और तृतीयक ऐमीन नाइट्रस अम्ल से भिन्न प्रकार से अभिक्रिया करती हैं।
6. ऐरिलसल्फोनिल क्लोराइड से अभिक्रिया
बेन्जीन सल्फोनिल क्लोराइड
(क) बेन्जीनसल्फोनिल क्लोराइड और प्राथमिक ऐमीन की अभिक्रिया से

सल्फोनैमाइड की नाइट्रोजन से जुड़ी हाइड्रोजन प्रबल इलेक्ट्रॉन खीचने वाले सल्फोनिल समूह की उपस्थिति के कारण प्रबल अम्लीय होती है। अतः यह क्षार में विलेय होते हैं।
(ख) द्वितीयक ऐमीन की अभिक्रिया से
( ग) तृतीयक ऐमीन बेन्जीनसल्फोनिल क्लोराइड से अभिक्रिया नहीं करतीं। विभिन्न वर्गों के ऐमीनों का यह गुण जिसमें वे बेन्जीनसल्फोनिल क्लोराइड से भिन्न-भिन्न प्रकार से अभिक्रिया करती हैं, प्राथमिक, द्वितीयक एवं तृतीयक ऐमीनों में विभेद करने एवं इन्हें मिश्रण से पृथक करने में प्रयुक्त होता है। यद्यपि आजकल बेन्जीनसल्फ़ोनिल क्लोराइड के स्थान पर
7. इलेक्ट्रॉनरागी प्रतिस्थापन
आपने पहले पढ़ा है कि ऐनिलीन पाँच अनुनादी संरचनाओं का संकर होती है। आप इन संरचनाओं में कौन से स्थान पर सर्वाधिक इलेक्ट्रॉन घनत्व पाते हैं?
( क ) ब्रोमीनन
ऐनिलीन कक्ष ताप पर ब्रोमीन जल से अभिक्रिया करके 2, 4, 6 -ट्राईब्रोमोऐनिलीन का सफेद अवक्षेप देती है।

ऐरोमैटिक ऐमीन की इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाओं में मुख्य समस्या इनकी उच्च अभिक्रियाशीलता है। प्रतिस्थापन आर्थो तथा पैरा दोनों स्थानों पर हो सकता है। यदि हमें ऐनिलिन का एकल प्रतिस्थापी व्युत्पन्न बनाना हो तो

ऐसिटेनिलाइड की नाइट्रोजन पर उपस्थित एकाकी इलेक्ट्रॉन युगल ऑक्सीजन परमाणु से अनुनाद द्वारा अन्योन्यक्रिया करता है। इसे नीचे दर्शाया गया है-

अतः नाइट्रोजन पर उपस्थित एकाकी इलेक्ट्रॉन युगल अनुनाद द्वारा बेन्जीन वलय को प्रदान करने के लिए कम उपलब्ध होता है। इसलिए
( ख) नाइट्रोकरण
ऐनिलीन के सीधे नाइट्रोकरण से नाइट्रो व्युत्पन्नों के अतिरिक्त अन्य कोलतारी ऑक्सीकरण उत्पाद भी बनते हैं। इसके अलावा प्रबल अम्लीय माध्यम में ऐनिलीन प्रोटॉन ग्रहण कर ऐनिलीनियम आयन बनाती है जो मेटा निर्देशक है। इसी कारण आर्थो एवं पैरा व्युत्पन्न के अलावा मेटा व्युत्पन्न की भी महत्वपूर्ण मात्रा बनती है।

ऐसीटिलन अभिक्रिया द्वारा
ऐसिटेनिलाइड
( ग ) सल्फोनेशन
ऐनिलीन सांद्र सल्फ्युरिक अम्ल से अभिक्रिया द्वारा ऐनिलीनियम हाइड्रोजनसल्फेट बनाती है जो सल्फ्यूरिक अम्ल के साथ

ऐलुमिनियम क्लोराइड के साथ लवण बनाने के कारण ऐनीलीन फ्रीडेल-क्राफ्ट्स अभिक्रिया (ऐल्किलन एवं ऐसीटिलन) नहीं करती। ऐलुमिनियम क्लोराइड एक लूईस अम्ल है जो इस अभिक्रिया में उत्प्रेरक का कार्य करता है। लवण बनने से एनिलीन की नाइट्रोजन धन आवेश प्राप्त कर लेती है और फिर आगे की अभिक्रिया में प्रबल निष्क्रियक समूह की तरह व्यवहार करती है।
II. डाइऐज़ोनियम लवण
डाइऐंज़ोनियम लवणों का सामान्य सूत्र
ऐलिफैटिक प्राथमिक ऐमीन अति अस्थायी ऐल्किल डाइऐज़ोनयम लवण बनाती हैं (खंड 9.6)। ऐरोमैटिक प्राथमिक ऐमीन ऐरीनडाइऐज़ोनियम लवण बनाती हैं जो विलयन में निम्न ताप पर (273-278 K) अल्प समय के लिए स्थायी होते हैं। ऐरीनडाइऐज़ोनियम आयन के स्थायितत्व को अनुनाद के आधार पर समझा जा सकता है।

9.7 डाइड्डोनियम लवणों के विरचन की विधि
बेन्जीनडाइऐज़ोनियम क्लोराइड को ऐनिलीन एवं नाइट्रस अम्ल की अभिक्रिया द्वारा 273-278K ताप पर बनाया जाता है। नाइट्रस अम्ल को अभिक्रिया मिश्रण में ही सोडियम नाइट्राइट तथा हाइड्रोक्लोरिक अम्ल की अभिक्रिया से उत्पन्न करते हैं। प्राथमिक ऐरोमैटिक ऐमीन के डाइऐज़ोनियम में परिवर्तन को डाइऐज़ोकरण कहते हैं। अस्थायी प्रकृति के कारण डाइऐंज़ोनियम लवण का भंडारण नहीं करते और बनते ही तुरंत प्रयोग कर लेते हैं।
9.8 भौतिक शुण
बेन्जीनडाइऐज़ोनियम क्लोराइड एक रंगहीन क्रिस्टलीय ठोस है। यह जल में विलेय तथा ठंडे में स्थायी है किंतु गरम करने पर जल से अभिक्रिया करता है यह ठोस अवस्था में आसानी से विघटित हो जाता है। बेन्जीन डाइऐज़ोनियमफ्लुओबोरेट जल में अविलेय तथा कक्ष ताप पर स्थायी होता है।
9.9 राभायनिक अभिक्रियाएँ
डाइऐज़ोनियम लवणों की अभिक्रियाओं को मुख्य रूप से दो संवर्गों में बाँटा जा सकता है।
(क) नाइट्रोजन प्रतिस्थायन अभिक्रियाएं तथा (ख) अभिक्रियाएं जिनमें डाइऐज़ोसमूह सुरक्षित (Retention) रहता है।
( क) नाइट्रोजन प्रतिस्थापन अभिक्रियाएँ
डाइऐज़ोनियम समूह एक उत्तम अवशिष्ट समूह (Leaving group) होने के कारण
1. हैलाइड अथवा सायनाइड आयन द्वारा प्रतिस्थापन
बेन्जीन वलय में
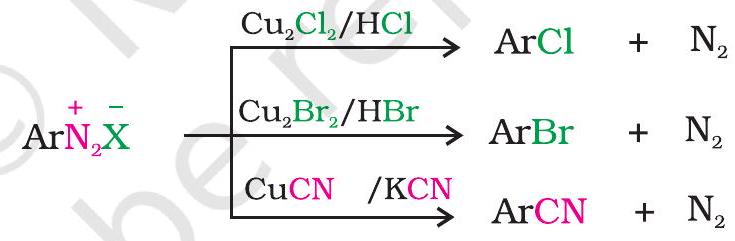
दूसरी ओर ताम्रचूर्ण की उपस्थिति में डाइऐज़ोनियम लवण के विलयन की संगत हैलोजन अम्ल से अभिक्रिया द्वारा क्लोरीन अथवा ब्रोमीन को भी बेन्जीन वलय में जोड़ा जा सकता है। इस अभिक्रिया को गाटरमान अभिक्रिया कहते हैं।

गाटरमान अभिक्रिया की तुलना में सैन्डमायर अभिक्रिया की लब्धि अधिक होती है।
2. आयोडाइड आयन द्वारा प्रतिस्थापन
आयोडीन को सीधे बेन्जीन वलय में सरलता से नहीं जोड़ा जा सकता; किंतु जब डाइऐज़ोनियम लवण के विलयन की अभिक्रिया पोटैशियम आयोडाइड से कराते हैं तो आयोडोबेन्जीन बनती है।
3. फ्लुओराइड आयन द्वारा प्रतिस्थापन
जब ऐरीनडाइऐज़ोनियम क्लोराइड की अभिक्रिया फ्लुओरोबोरिक अम्ल से कराते हैं तो ऐरीन डाइऐज़ोनियम फ्लुओरोबोरेट अवक्षेपित हो जाता है, जो गरम करने पर विघटित होकर ऐरिल फ्लुओराइड देता है।
4.
हाइपोफ़ास्फ़ोरस अम्ल (फ़ॉस्फ़िनिक अम्ल) अथवा एथेनॉल जैसे दुर्बल अपचयन कर्मक डाइऐज़ोनियम लवणों को ऐरीनों में अपचित कर देते हैं और स्वयं क्रमशः फ़ोस्फ़ोरस अम्ल अथवा एथेनैल में ऑक्सीकृत हो जाते हैं।
5. हाइड्रॉक्सिल समूह द्वारा प्रतिस्थापन
यदि डाइऐज़ोनियम लवण विलयन का ताप
6.
जब डाइऐज़ोनियम फलुओरोबोरेट को कॉपर की उपस्थिति में सोडियम नाइट्राइट के जलीय विलयन में गरम किया जाता है, तब डाइऐज़ोनियम समूह,

(ख) अभिक्रियाएँ जिनमें डाइएज़ो समूह सुरक्षित रहता है
युग्मन अभिक्रियाएँ
युग्मन अभिक्रिया से प्राप्त ऐज़ो उत्पादों में दोनों ऐरोमैटिक वलयों एवं इन्हें जोड़ने वाले 
9.10 इरोमेटिक यौगिकों के संश्लेषण में डाइडेजोलवणों का महत्व
उपरोक्त अभिक्रियाओं से यह स्पष्ट है कि डाइऐज़ोनियम लवण बेन्जीन वलय में
ऐरिल फ्लुओराइड एवं आयोडाइड को सीधे हैलोजनन द्वारा नहीं बनाया जा सकता। क्लोरोबेन्जीन में क्लोरीन के नाभिकरागी प्रतिस्थापन द्वारा सायनाइड समूह का प्रवेश नहीं कराया जा सकता, किंतु डाइऐज़ोनियम लवण से सायनोबेन्जीन को सरलता से बनाया जा सकता है।
अतः डाइऐज़ो समूह का अन्य समूहों द्वारा प्रतिस्थापन ऐसे ऐरोमैटिक प्रतिस्थापित यौगिकों को बनाने में सहायक है, जो सीधे बेन्जीन अथवा प्रतिस्थापित बेन्जीन से नहीं बनते।










