कार्बनिक रसायन में कार्बोनिल यौगिकों का अत्यधिक महत्व है। यह वस्त्रों, सुगन्धों, प्लास्टिकों तथा औषधों के संघटक होते हैं।
पिछले एकक में आपने ऐसे कार्बनिक यौगिकों का अध्ययन किया है, जिनमें प्रकार्यात्मक समूह में कार्बन तथा ऑक्सीजन परमाणु के मध्य एकल आबंध पाया जाता है। इस एकक में आप ऐसे कार्बनिक यौगिकों के बारे में अध्ययन करेंगे जिनमें प्रकार्यात्मक समूह में कार्बन तथा ऑक्सीजन के मध्य द्विआबंध $(>\mathrm{C}=\mathrm{O})$ होता है जिसे कार्बोनिल समूह कहते हैं। यह कार्बनिक रसायन का एक महत्वपूर्ण प्रकार्यात्मक समूह है।
ऐल्डिहाइडों में कार्बोनिल समूह कार्बन व हाइड्रोजन से, जबकि कीटोनों में यह दो कार्बन परमाणुओं से आबंधित रहता है। कार्बोनिल यौगिक जिनमें कार्बोनिल समूह का कार्बन, हाइड्रोजन या कार्बन तथा हाइड्राक्सी माइटी $(-\mathrm{OH})$ की ऑक्सीजन से आबंधित रहता है, कार्बोक्सिलिक अम्ल कहलाते हैं जबकि वे यौगिक जिनमें कार्बोनिल समूह का कार्बन, हाइड्रोजन या कार्बन तथा $-\mathrm{NH} _{2}$ माइटी के नाइट्रोजन अथवा किसी हैलोजन से जुड़ा रहता है, क्रमशः एमाइड व ऐसिल हैलाइड कहलाते हैं। एस्टर और एनहाइड्राइड कार्बोक्सिलिक अम्लों के व्युत्पन्न होते हैं। इन वर्गो के यौगिकों के सामान्य सूत्र नीचे दिए गए हैं-
ऐल्डिहाइड
कीटोन
कार्बोक्सिलिक अम्ल
ऐसिल हैलाइड; $\mathrm{X}=$ ( हैलोजन $)$
एस्टर
ऐसिड ऐनहाइड्राइड
ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल पौधों और जीवों में विस्तृत रूप से पाए जाते हैं। ये जीवों की जैव रासायनिक प्रक्रिया में महत्वपूर्ण योगदान देते हैं। ये प्रकृति में सुगंध व स्वाद प्रदान करते हैं। उदाहरणार्थ, वेनेलिन (बेनीला सेम से प्राप्त) सौलिसिल ऐल्डिहाइड (मेडोस्वीट से प्राप्त) तथा सिनेमैल्डिहाइड (दाल चीनी से प्राप्त) रुचिकर सुगंध देते हैं।

$\mathrm{OH}$
वेनेलिन
सैलिसिल ऐल्डिहाइड
सिनैमैल्डिहाइड
ये अनेक खाद्य उत्पादों व औषधों में सुगंध प्रदान करने के लिए प्रयुक्त होते हैं। इस वर्ग के कुछ यौगिकों का उत्पादन विलायक (ऐसीटोन) और आसंजी (चिपकने वाले) पदार्थ, पेंट, रेज़िन, सुगंध, प्लास्टिक, वस्त्र आदि बनाने के लिए किया जाता है।
8.1 कार्बोनिल यौधिकों का जामकरण डवं शंरचना
8.1.1 नामपद्धति
( I ) ऐल्डिहाइड एवं कीटोन
ऐल्डिहाइड एवं कीटोन सरलतम और अत्यंत महत्वपूर्ण कार्बोनिल यौगिक हैं। ऐल्डिहाइडों एवं कीटोनों के नामकरण की दो पद्धतियाँ हैं-
( क ) सामान्य नाम- ऐल्डिहाइड एवं कीटोन प्रायः IUPAC नामपद्धति की अपेक्षा अपने सामान्य नामों से जाने जाते हैं। ऐल्डिहाइड के सामान्य नाम संगत कार्बोक्सिलिक अम्लों (खंड 8.6.1) के अंग्रेज़ी में लिखे सामान्य नामों के अंत में स्थित अनुलग्न इक के स्थान पर ऐल्डिहाइड अनुलग्न लगाकर प्राप्त करते हैं। साथ ही कार्बोक्सिलिक अम्ल या ऐल्डिहाइड के नाम में वास्तविक स्रोत का नाम लेटिन या ग्रीक में प्रतिबिंबित होता है। कार्बन शृंखला में प्रतिस्थापियों की स्थिति को ग्रीक अक्षरों $\alpha, \beta, \gamma, \delta$, आदि से प्रदर्शित करते हैं। $\alpha$ उस कार्बन परमाणु को कहते हैं जो सीधे ऐल्डिहाइड समूह के कार्बन परमाणु से संलग्न होता है। तत्पश्चात् $\beta$ कार्बन तथा अन्य इसी क्रम में आगे चलते हैं। उदाहरणार्थ-
$\mathrm{CH} _{3} \mathrm{CHO}$
ऐसीटैल्डिहाइड
बेन्जैल्डिहाइड
$\beta$-ब्रोमोब्यूटिरैल्डिहाइड
कीटोनों के सामान्य नाम व्युत्पन्न करने के लिए कार्बोनिल समूह से जुड़े दो ऐल्किल या ऐरिल समूहों का नामकरण किया जाता है। प्रतिस्थापियों की स्थिति को ग्रीक अक्षरों $\alpha \alpha^{\prime}$, $\beta \beta^{\prime}$ आदि द्वारा प्रदर्शित करते हैं। $\alpha \alpha^{\prime}$ कार्बन परमाणु वे होते हैं जो सीधे कार्बोनिल समूह $(>\mathrm{C}=\mathrm{O})$ से संलग्न होते हैं। कुछ कीटोनों के ऐतिहासिक सामान्य नाम होते हैं जैसे सरलतम डाइमेथिल कीटोन को ऐसीटोन कहते हैं। ऐल्किल फेनिल कीटोन का नाम लिखने के लिए ऐसिल समूह के नाम को फ़ीनॉन शब्द के साथ पूर्वलग्न की तरह जोड़कर लिखा जाता है; उदाहरणार्थ-
ऐसीटोन ऐसीटोफ़ीनॉन
प्रोपिओफ़ीनॉन
बेन्जोफ़ीनॉन
( ख) आईयूपीएसी (IUPAC ) नाम— खुली श्रृंखला वाले एलिफैटिक ऐल्डिहाइडों एवं कीटोनों के IUPAC नाम प्राप्त करने के लिए संगत ऐल्केन के अंग्रेज़ी में लिखे नाम के अंत में स्थित इ $(-\mathrm{e})$ के स्थान पर क्रमशः अल $(-\mathrm{al})$ एवं ओन (-one) अनुलग्न लगाते हैं। ऐल्डिहाइडों में कार्बन की सबसे लंबी भृंखला का अंकन उस सिरे से शुरू किया जाता है जहाँ ऐल्डिहाइड समूह स्थित होता है जबकि कीटोनों में उस सिरे से अंकन करते हैं, जो कार्बोनिल समूह के निकट होता है। प्रतिस्थापियों को पूर्वलग्न के रूप में अंग्रेज़ी वर्णमाला के क्रमानुसार, कार्बन शृंखला में अंकों द्वारा स्थिति प्रदर्शित करते हुए लिखते हैं। चक्रीय कीटोनों पर भी यही नियम लागू होता है, जिनमें कार्बोनिल के कार्बन परमाणु की स्थिति की संख्या एक (1) होती है। जब ऐल्डिहाइड समूह वलय से संयुक्त होता है तो साइक्लोऐल्केन (चक्रीय ऐल्केन) का नाम लिखने के पश्चात् अनुलग्न कार्बैल्डिहाइड (Carbaldehyde) जोड़ देते हैं। वलय के कार्बन परमाणुओं का संख्यांकन उस कार्बन परमाणु से आरंभ करते हैं, जिससे ऐल्डिहाइड समूह संयुक्त होता है। सरलतम ऐरोमेटिक ऐल्डिहाइड, जिसमें ऐल्डिहाइड समूह बेन्जीन वलय पर स्थित होता है, का नाम बेन्ज़ीनकार्बैल्डिहाइड है। यद्यपि, IUPAC पद्धति द्वारा सामान्य नाम बेन्जैल्डिहाइड भी स्वीकृत है। अन्य प्रतिस्थापित ऐरोमैटिक ऐल्डिहाइडों के नाम बेन्जैल्डिहाइड के व्युत्पन्न के रूप में दिए जाते हैं।
साइक्लोहेक्सेनकार्बैल्डिहाइड
4-ब्रोमो-3-मेथिलहेप्टेनैल
पेन्ट-2-ईैैल

3-मेथिलसाइक्लोपेन्टेनॉन
1 -फ़ेनिलप्रोपेन-1-ऑन
4-नाइट्रोबेन्जैलडिहाइड अथवा 4-नाइट्रोबेन्जीनकार्बैल्डिहाइड
2,4 -डाईमेथिलपेन्टेन- 3 -ऑन
$$ \mathrm{OHC}-\mathrm{CH} _{2}-\underset{\mathrm{l}}{\mathrm{CHO}}-\mathrm{CH} _{2}-\mathrm{CHO} $$
प्रोपेन- $1,2,4$-ट्राइकार्बैल्डिहाइड
नोट - सभी ऐल्डिहाइड समूहों के समान निरूपण हेतु यौगिक का नाम उक्त रूप से दिया जाता है।
ऐल्डिहाइडों एवं कीटोनों के कुछ सामान्य एवं आईयूपीएसी (IUPAC) नामों को सारणी 8.1 में दिया गया हैसारणी 8.1- ऐल्डिहाइडों व कीटोनों के सामान्य और IUPAC नाम

8.1.2 कार्बोनिल समूह की संरचना
कार्बोनिल समूह में कार्बन परमाणु $s p^{2}$ संकरित अवस्था में होता है तथा तीन सिग्मा $(\sigma)$ आबंध निर्मित करता है। कार्बन का चौथा संयोजकता इलेक्ट्रॉन कार्बन के असंकरित $p$-कक्षक में होता है तथा ऑक्सीजन के $p$-कक्षक के साथ अतिव्यापन करके एक $\pi$ आबंध बनाता है। इसके अतिरिक्त ऑक्सीजन परमाणु पर दो अनाबंधी इलेक्ट्रॉन युगल उपस्थित होते हैं। इस प्रकार कार्बोनिल समूह का कार्बन तथा इससे आबंधित तीन परमाणु एक ही तल में होते हैं एवं $\pi$ इलेक्ट्रॉन अभ्र इस तल के ऊपर एवं नीचे होता है। बंधक कोण लगभग $120^{\circ}$ का होता है जैसा कि समतलीय त्रिकोणीय संरचना में अपेक्षित है (चित्र 8.1)।

चित्र 8.1- कार्बोनिल समूह निर्माण का कक्षीय आरेख

(क)
कार्बन की अपेक्षा ऑक्सीजन की विद्युतत्रणात्मकता उच्च होने के कारण कार्बन-ऑक्सीजन द्विक् आबंध ध्रुवित हो जाता है। अतः कार्बोनिल समूह का कार्बन एक इलेक्ट्रॉनरागी (लूइस अम्ल) केंद्र और कार्बोनिल ऑक्सीजन एक नाभिकरागी (लूइस क्षारक) केंद्र होता है। कार्बोनिल यौगिकों में पर्याप्त द्विध्रुव आघूर्ण होता है और ये ईथर से अधिक ध्रुवीय होते हैं। कार्बोनिल समूह की उच्च ध्रुवता, अनुनाद के आधार पर समझाई जा सकती है, जिसमें एक उदासीन संरचना (क) एवं एक द्विध्रुव संरचना (ख) है जैसा कि चित्र में प्रदर्शित किया गया है।
8.2.1 ऐल्डिहाइडों एवं कीटोनों का विरचन
1. ऐल्कोहॉलों के ऑक्सीकरण से
सामान्यतः ऐल्डिहाइड एवं कीटोन क्रमशः प्राथमिक व द्वितीयक ऐल्कोहॉलों के ऑक्सीकरण से बनाए जाते हैं (एकक 7, कक्षा 12)।
2. ऐल्कोहॉलों के विहाइड्रोजनन से
यह विधि वाष्पशील ऐल्कोहॉलों के लिए उचित होती है तथा यह एक औद्योगिक अनुप्रयोग की विधि है। इस विधि में ऐल्कोहॉल के वाष्प को तप्त भारी-धातु उत्प्रेरक (सिल्वर अथवा कॉपर) के ऊपर से प्रवाहित करते हैं, जिसके फलस्वरूप प्राथमिक व द्वितीयक ऐल्कोहॉल क्रमशः ऐल्डिहाइड व कीटोन देते हैं (एकक 7 कक्षा 12)।
3. हाइड्रोकार्बन से
(i) ऐल्कीनों के ओज़ोनी अपघटन से- जैसा कि हम जानते हैं ऐल्कीनों के ओज़ोनी अपघटन के पश्चात् प्राप्त उत्पाद की ज़िंक धूल व जल के साथ अभिक्रिया के द्वारा ऐल्डिहाइड या कीटोन अथवा दोनों का मिश्रण प्राप्त होता है, जो ऐल्कीन में उपस्थित प्रतिस्थापन के प्रकार पर निर्भर करता है। (एकक-9, कक्षा-11)
(ii) ऐल्काइनों के जलयोजन से- $\mathrm{H} _{2} \mathrm{SO} _{4}$ एवं $\mathrm{HgSO} _{4}$ की उपस्थिति में एथाइन में जलयोजन द्वारा ऐसीटैल्डिहाइड प्राप्त होता है। अन्य सभी ऐल्काइनें इस अभिक्रिया द्वारा कीटोन प्रदान करती हैं। (एकक-9, कक्षा-11)
8.2.2 ऐल्डिहाइडों का विरचन
1. ऐसिल क्लोराइड से (अम्ल क्लोराइड )
ऐसिल क्लोराइड (अम्ल क्लोराइड) के बेरियम सल्फेट पर अवलंबित पैलेडियम उत्प्रेरक पर हाइड्रोजनन से ऐल्डिहाइड प्राप्त होते हैं। इस अभिक्रिया को रोज़ेनमुंड अपचयन (Rosenmund Reduction) कहते हैं।
बेन्जॉयल क्लोराइड
बेन्जैल्डिहाइड
2. नाइट्राइल एवं एस्टर से
हाइड्रोक्लोरिक अम्ल की उपस्थिति में नाइट्राइल स्टैनस क्लोराइड द्वारा संगत इमीन में अपचित हो जाते हैं। जो जलअपघटन करने पर संगत ऐल्डिहाइड देते हैं।

यह अभिक्रिया स्टीफैन अभिक्रिया (Stephen Reaction) कहलाती है।
वैकल्पिक अभिक्रिया में नाइट्राइल को डाइआइसोब्यूटिलऐलुमिनियम हाइड्राइड (DIBAL-H) द्वारा चयनित अपचयन से इमीन में बदल लेते हैं एवं तत्पश्चात् इसके जलअपघटन से ऐल्डिहाइड प्राप्त हो जाता है।
$\mathrm{RCN} \xrightarrow[\text { 2. } \mathrm{H} _{2} \mathrm{O}]{\text { 1. } \mathrm{AlH}(\mathrm{i}-\mathrm{Bu}) _{2}} \mathrm{R}-\mathrm{CHO}$

इसी प्रकार से एस्टर भी DIBAL-H द्वारा ऐल्डिहाइड में अपचित हो जाते हैं।

3. हाइड्रोकार्बन से
ऐरोमैटिक ऐल्डिहाइड (बेन्जैल्डिहाइड व इसके व्युत्पन्न) ऐरोमैटिक हाइड्रोकार्बन द्वारा निम्न प्रकार से बनाए जाते हैं-
(i) मेथिल बेन्जीन के ऑक्सीकरण द्वारा- प्रबल ऑक्सीकरण कर्मक टॉलूईन व इसके व्युत्पन्नों को बेन्ज़ोइक अम्ल में ऑक्सीकृत कर देते हैं। इस ऑक्सीकरण
को उपयुक्त अभिकर्मकों द्वारा ऐल्डिहाइड चरण में ही रोकना संभव है। यह मेथिल समूह को एक मध्यवर्ती में परिवर्तित कर देते हैं जिसे पुनः ऑक्सीकृत करना कठिन होता है। इसके लिए निम्न विधियों का उपयोग किया जाता है-
(क) क्रोमिल क्लोराइड के उपयोग से— क्रोमिल क्लोराइड $\left(\mathrm{CrO} _{2} \mathrm{Cl} _{2}\right)$ मेथिल समूह को एक क्रोमियम संकुल में ऑक्सीकृत कर देता है जो जल अपघटन द्वारा संगत बेन्जैल्डिहाइड बनाता है।

यह अभिक्रिया ईटार्ड अभिक्रिया (Etard Reaction) कहलाती है।
( ख) क्रोमिक ऑक्साइड के उपयोग से $\left(\mathrm{CrO} _{3}\right)$-टॉलूईन या प्रतिस्थापित टॉलूईन को ऐसीटिक एनहाइड्राइड में क्रोमिक ऑक्साइड के साथ अभिकृत कराने पर बेन्जिलिडीन डाइऐसीटेट प्राप्त होता है। बेन्जिलिडीन डाइऐसीटेट जलीय अम्ल के साथ जल अपघटित होकर संगत बेन्जैल्डिहाइड बनाता है।

(ii) पार्श्व शृंखला के क्लोरीनन के पश्चात् जल अपघटन- टॉलूईन पार्श्व शृंखला क्लोरीनन द्वारा बेन्जल क्लोराइड देती है, जो जल अपघटन द्वारा बेन्जैल्डिहाइड बनाता है। यह बेन्जैल्डिहाइड के औद्योगिक उत्पादन की विधि है।

(iii) गाटरमान-कॉख अभिक्रिया से— जब बेन्जीन या इसके व्युत्पन्न निर्जल ऐलुमिनियम क्लोराइड या क्यूप्रस क्लोराइड की उपस्थिति में कार्बन मोनोऑक्साइड और हाइड्रोजन क्लोराइड के साथ क्रिया करते हैं, तो बेन्जैल्डिहाइड या प्रतिस्थापित बेन्जैल्डिहाइड प्राप्त होते हैं।

बेन्जीन
बेन्जैल्डिहाइड
यह अभिक्रिया गाटरमान-कॉख अभिक्रिया ( Gatterman-Koch Reaction ) कहलाती हैं।
8.2.3 कीटोनों का विरचन
1. ऐसिल क्लोराइड से
ग्रीन्यार अभिकर्मक तथा कैडमियम क्लोराइड की अभिक्रिया से प्राप्त डाइऐल्किलकैडमियम की ऐसिल क्लोराइड से अभिक्रिया कराने पर कीटोन प्राप्त होते हैं।

2. नाइट्राइल से
नाइट्राइल व ग्रीन्यार अभिकर्मक की क्रिया से प्राप्त उत्पाद का जल अपघटन कराने से कीटोन प्राप्त होते हैं।

3. बेन्जीन या प्रतिस्थापित बेन्जीन से- निर्जल ऐलुमिनियम क्लोराइड की उपस्थिति में बेन्जीन या प्रतिस्थापित बेन्जीन, अम्ल क्लोराइड के साथ अभिक्रिया कर संगत कीटोन देते हैं। यह अभिक्रिया फ्रीडेल-क्राफ्ट्स ऐसीटिलन अभिक्रिया (Friedal-Craft’s Acylation reaction) कहलाती हैं।

8.3 भरतिक गुणधर्म
कक्ष ताप पर मेथेनैल गैस के रूप में होती है, एथेनैल एक वाष्पशील द्रव है। अन्य ऐल्डिहाइड एवं कीटोन कक्ष तापक्रम पर द्रव या ठोस होते हैं। ऐल्डिहाइडों व कीटोनों के क्वथनांक समतुल्य आण्विक द्रव्यमान वाले हाइड्रोकार्बनों और ईथरों से अधिक होते हैं। यह ऐल्डिहाइडों एवं कीटोनों में द्विध्रुव - द्विध्रुव आकर्षण के फलस्वरूप उत्पन्न दुर्बल आण्विक संगुणन के कारण होते हैं। इनके क्वथनांक भी समतुल्य आण्विक द्रव्यमान वाले ऐल्कोहॉलों से अंतराआण्विक हाइड्रोजन आबंध अनुपस्थित होने के कारण कम होते हैं। निम्न यौगिकों को, जिनका आण्विक द्रव्यमान 58 और 60 है, क्वथनांकों के बढ़ते क्रम में रखा गया है।
| क्वथनांक | ||
|---|---|---|
| (K) | आण्विक द्रव्यमान | |
| n-ब्यूटेन | 273 | 58 |
| मेथॉक्सीएथेन | 281 | 60 |
| प्रोपेनैल | 322 | 58 |
| ऐसीटोन | 329 | 58 |
| प्रोपेन-1-ऑल | 370 | 60 |
ऐल्डिहाइडों व कीटोनों के निम्नतर सदस्य जैसे मेथेनैल, एथेनैल एवं प्रोपेनोन जल के साथ हाइड्रोजन आबंध बनाने के कारण प्रत्येक अनुपात में जल में मिश्रणीय होते हैं।
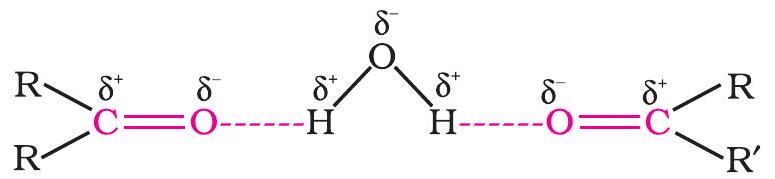
परंतु जैसे-जैसे ऐल्किल भृंखला की लंबाई बढ़ती है, इनकी घुलनशीलता तेज़ी से घटती जाती है। सभी ऐल्डिहाइड व कीटोन सभी कार्बनिक विलायकों जैसे— बेन्जीन, ईथर, मेथेनॉल, क्लोरोफॉर्म इत्यादि में सुगमतापूर्वक घुलनशील होते हैं। निम्नतर ऐल्डिहाइड में तीक्ष्ण गंध होती हैं। जैसे-जैसे अणुओं का आकार बढ़ता जाता है गंध कम तीक्ष्ण होती जाती है तथा सुगंध बढ़ती जाती है। वास्तव में प्रकृति में पाए जाने वाले अनेक ऐल्डिहाइडों व कीटोनों का उपयोग सुगंध व सुरुचि कर्मकों के सम्मिश्रण में किया जाता है।
8.4 रासायनिक अभिक्रियाएँ"
ऐल्डिहाइड एवं कीटोन, दोनों में कार्बोनिल क्रियात्मक समूह विद्यमान हैं अतः ये एक समान रासायनिक अभिक्रियाएँ प्रदर्शित करते हैं।
1. नाभिकरागी योगज अभिक्रिया
ऐल्कीनों में जैसी इलेक्ट्रॉनरागी योगज अभिक्रियाएँ देखी जाती हैं, (एकक-9, कक्षा-11) उसके विपरीत ऐल्डिहाइड व कीटोन नाभिकरागी योगज अभिक्रियाएँ प्रदर्शित करते हैं।
(i) नाभिकरागी योगज अभिक्रियाओं की क्रियाविधि— नाभिकरागी ध्रुवीय कार्बोनिल समूह के इलेक्ट्रॉनरागी कार्बन पर उस दिशा से आक्रमण करता है जो कार्बोनिल कार्बन के $s p^{2}$ संकरित कक्षकों के तल के लगभग लंब पर होती है (चित्र 8.2)। इस प्रक्रिया में कार्बन की संकरण अवस्था $s p^{2}$ से $s p^{3}$ हो जाती है तथा चतुष्फलकीय ऐल्कॉक्साइड मध्यवर्ती बनता है। यह मध्यवर्ती अभिक्रिया माध्यम से एक प्रोटॉन प्राप्त करके विद्युत् उदासीन उत्पाद देता है। कुल परिणाम कार्बन-ऑक्सीजन द्विक आबंध पर $\mathrm{Nu}^{-}$व $\mathrm{H}^{+}$ का योगाज होता है। जैसा चित्र 8.2 में दर्शाया गया है।

समतलीय
चित्र 8.2- कार्बोनिल कार्बन पर नाभिकरागी आक्रमण

(ii) अभिक्रियाशीलता— इलेक्ट्रॉनिक व त्रिविम प्रभावों के कारण नाभिकरागी योगज अभिक्रियाओं में ऐल्डिहाइड कीटोनों की अपेक्षा अधिक अभिक्रियाशील होते हैं। त्रिविम रूप से नाभिकरागी के कार्बोनिल कार्बन तक पहुँचने में कीटोनों में उपस्थित दो सापेक्षिक बड़े प्रतिस्थापी समूह ऐल्डिहाइडों की अपेक्षा अधिक बाधा उत्पन्न करते हैं, जिनमें केवल एक ही ऐसा प्रतिस्थापी उपस्थित होता है। इलेक्ट्रॉनिक रूप से ऐल्डिहाइड कीटोन से ज़्यादा क्रियाशील होते हैं, क्योंकि कीटोन में उपस्थित दो ऐल्किल समूह कार्बोनिल कार्बन की इलेक्ट्रॉनरागी प्रकृति को ऐल्डिहाइड की तुलना में कम कर देते हैं।
( iii ) नाभिकरागी योगज और नाभिकरागी योगज-विलोपन अभिक्रियाओं के कुछ महत्वपूर्ण उदाहरण-
(क) हाइड्रोजन सायनाइड ( $\mathbf{H C N}$ ) का संयोजन- ऐल्डिहाइड व कीटोन हाइड्रोजन सायनाइड से $(\mathrm{HCN})$ अभिकृत होकर संगत सायनोहाइड्रिन देते हैं। शुद्ध $\mathrm{HCN}$ के साथ यह अभिक्रिया बहुत धीमी होती है; अतः यह क्षार द्वारा उत्प्रेरित की जाती है और जनित सायनाइड आयन प्रबल नाभिकस्नेही $\left(\mathrm{CN}^{-}\right)$ कार्बोनिल यौगिकों पर संयोजित होकर संगत सायनोहाइड्रिन देते हैं। सायनोहाइड्निन उपयोगी संश्लेषित मध्यवर्ती होते हैं।

(ख) सोडियम बाइसल्फाइड का संयोजन- ऐल्डिहाइड एवं कीटोन सोडियम हाइड्रोजन सल्फाइट के साथ संयुक्त होकर योगज उत्पाद देते हैं। त्रिविमीय प्रभाव के कारण साम्यावस्था की स्थिति अधिकांश ऐल्डिहाइडों के लिए दाईं ओर तथा अधिकतर कीटोनों के लिए बाईं ओर होती है। हाइड्रोजन सल्फाइट योगज उत्पाद जल में अविलेय होता है, जो तनु खनिज अम्लों अथवा क्षार के साथ अभिक्रिया कर पुनः मूल कार्बोनिल यौगिकों में परिवर्तित किया जा सकता है। इसलिए यह ऐल्डिहाइडों के पृथक्करण व परिष्करण के लिए उपयोगी होते हैं।

( ग) ग्रिन्यार अभिकर्मकों का संयोजन (देखिए एकक 7, कक्षा 12)
(घ) ऐल्कोहॉलों का संयोजन- ऐल्डिहाइड, मोनोहाइड्रिक ऐल्कोहॉल की एक तुल्यांक मात्रा के साथ शुष्क हाइड्रोजन क्लोराइड की उपस्थिति में अभिक्रिया कर
 ऐसीटैल
ऐसीटैल
एथिलीन ग्लाइकॉल कीटेल
ऐल्कॉक्सी ऐल्कोहॉल मध्यवर्ती बनाते हैं, जिन्हें हेमीएसींटैल कहते हैं। यह पुन: एक मोल ऐल्कोहॉल से अभिक्रिया कर जैम-डाइऐल्कॉक्सी यौगिक बनाते हैं, जिन्हें ऐसीटैल कहते हैं, जैसा कि नीचे दर्शाया गया है।
कीटोन इन्हीं अभिक्रिया परिस्थितियों में एथिलीन ग्लाइकॉल के साथ अभिक्रिया करके चक्रीय उत्पाद बनाते हैं, जिसे एथिलीन ग्लाइकॉल कीटेल कहते हैं। शुष्क हाइड्रोजन क्लोराइड कार्बोनिल समूह की ऑक्सीजन को प्रोटॉनीकृत करती है, जिससे कार्बोनिल समूह की इलेक्ट्रॉनरागी प्रवृत्ति बढ़ती है जो एथिलीन ग्लाइकॉल पर नाभिकरागी आक्रमण को सरल बनाती है। ऐसीटैल व कीटेल जलीय खनिज अम्लों के साथ जलअपघटित होकर क्रमशः संगत ऐल्डिहाइड व कीटोन देते हैं।
$\mathrm{Z}=$ ऐल्किल, ऐरिल, $\mathrm{OH}, \mathrm{NH} _{2}$,
$\mathrm{C} _{6} \mathrm{H} _{5} \mathrm{NH}, \mathrm{NHCONH} _{2}$, आदि।
( च ) अमोनिया व इसके व्युत्पन्नों का संयोजन- अमोनिया व इसके व्युत्पन्न $\mathrm{H} _{2} \mathrm{~N}-\mathrm{Z}$ जैसे नाभिकरागी ऐल्डिहाइड व कीटोन के कार्बोनिल समूह पर जुड़ते हैं। यह अभिक्रिया उत्क्रमणीय होती है तथा अम्ल से उत्प्रेरित होती है। मध्यवर्ती के द्रुत निर्जलीकरण द्वारा $>\mathrm{C}=\mathrm{N}-\mathrm{Z}$ बनने के कारण साम्यावस्था उत्पाद को बनाने में सहायक होती है।
सारणी 8.2- ऐल्डिहाइडों व कीटोनों ( $>\mathrm{C}=\mathrm{N}-\mathrm{Z}$ )- के कुछ $\mathrm{N}$ - प्रतिस्थापित व्युत्पन्न

- 2,4-DNP व्युत्पन्न पीले, नारंगी या लाल ठोस होते हैं, जो ऐल्डिहाइड व कीटोन के अभिलक्षणन में उपयोगी हैं।
2. अपचयन
(i) ऐक्लोहॉलों में अपचयन- सोडियम बोरोहाइड्राइड $\left(\mathrm{NaBH} _{4}\right)$ अथवा लीथियम ऐलुमिनियम हाइड्राइड $\left(\mathrm{LiAlH} _{4}\right)$ या उत्प्रेरकी हाइड्रोजनन द्वारा ऐल्डिहाइड व कीटोन अपचित होकर क्रमशः प्राथमिक तथा द्वितीयक ऐल्कोहॉल देते हैं (एकक 7, कक्षा 12)।
(ii) हाइड्रोकार्बनों में अपचयन- ऐल्डिहाइड एवं कीटोनों का कार्बोनिल समूह अमलगमित जिंक एवं सांद्र हाइड्रॉक्लोरिक अम्ल द्वारा अभिक्रिया से, ( क्लीमेन्सन अपचयन ) या हाइड्रैज़ीन के साथ अभिक्रिया करने के बाद, ऐथिलीन ग्लाइकॉल जैसे उच्च क्वथनांक वाले विलायक में सोडियम या पोटैशियम हाइड्रॉक्साइड के साथ गरम करने पर $-\mathrm{CH} _{2}$ समूह में परिवर्तित हो जाता है ( वोल्फ-किश्नर अपचयन)।

(वोल्फ-किश्नर अपचयन)
बर्नार्ड टॉलेन्स (1841-1918) गौटिन्गेन विश्वविद्यालय, जर्मनी में रसायन विज्ञान के प्रोफ़ेसर थे।
3. ऑक्सीकरण
ऑक्सीकरण अभिक्रिया में ऐल्डिहाइड कीटोन से भिन्न व्यवहार करते हैं। ऐल्डिहाइड सामान्य ऑक्सीकारकों जैसे, नाइट्रिक अम्ल, पोटैशियम परमैंगनेट, पोटैशियम डाइक्रोमेट आदि के द्वारा ऑक्सीकृत होकर कार्बोक्सिलिक अम्ल देते हैं। यहाँ तक की मृदु ऑक्सीकरण कर्मक मुख्यतया टॉलेन अभिकर्मक और फेलिंग विलयन भी ऐल्डिहाइडों को ऑक्सीकृत कर देते हैं।
$$ \mathrm{R}-\mathrm{CHO} \xrightarrow{[\mathrm{O}]} \mathrm{R}-\mathrm{COOH} $$
कीटोनों का ऑक्सीकरण सामान्यतः प्रबल परिस्थितियों, जैसे— प्रबल ऑक्सीकरण कर्मकों और उच्च ताप पर होता है। इनके ऑक्सीकरण में कार्बन-कार्बन आबंध का विदलन होता है, जिससे अनेक कार्बोक्सिलिक अम्लों का मिश्रण प्राप्त होता है। जिनमें कार्बन परमाणुओं की संख्या, मूल कार्बोनिल यौगिक के कार्बन परमाणुओं से कम होती है।

नीचे दिए गए मृदु ऑक्सीकरण कर्मक ऐल्डिहाइडों और कीटोनों में विभेद करने के लिए प्रयुक्त होते हैं-
(i) टॉलेन-परीक्षण- ऐल्डिहाइड को ताज़ा बने अमोनियामय सिल्वर नाइट्रेट विलयन (टॉलेन अभिकर्मक) के साथ गर्म करने पर सिल्वर धातु बनने के कारण चमकदार सिल्वर दर्पण बन जाता है। ऐल्डिहाइड संगत कार्बोक्सिलेट ऋणायन में ऑक्सीकृत हो जाते हैं। यह अभिक्रिया क्षारीय माध्यम में संपन्न होती है।
$$ \mathrm{RCHO}+2\left[\mathrm{Ag}\left(\mathrm{NH} _{3}\right) _{2}\right]^{+}+3 \overline{\mathrm{O}} \mathrm{H} \longrightarrow \mathrm{RCO} \overline{\mathrm{O}}+2 \mathrm{Ag}+2 \mathrm{H} _{2} \mathrm{O}+4 \mathrm{NH} _{3} $$
(ii) फेलिंग-परीक्षण- फेलिंग अभिकर्मक में दो विलयन फेलिंग विलयन $A$ व फेलिंग विलयन $B$ होते हैं। फेलिंग विलयन $A$ जलीय कॉपर सल्फेट तथा फेलिंग विलयन $B$ सोडियम पोटैशियम टार्ट्रेट (रोशेल लवण) होता है। परीक्षण से पूर्व दोनों विलयन समान मात्रा में मिलाए जाते हैं। ऐल्डिहाइड को फेलिंग विलयन के साथ गर्म करने पर लालभूरा अवक्षेप प्राप्त होता है। ऐल्डिहाइड संगत कार्बोक्सिलेट ऋणायन में ऑक्सीकृत हो जाते हैं। ऐरोमैटिक ऐल्डिहाइड इस परीक्षण के प्रति प्रतिक्रिया नहीं दर्शाते।
$$ \mathrm{R}-\mathrm{CHO}+2 \mathrm{Cu}^{2+}+5 \overline{\mathrm{O}} \mathrm{H} \longrightarrow \underset{\text { लाल-भूरा अवक्षेप }}{\mathrm{RCO} \overline{\mathrm{O}}+\mathrm{Cu} _{2} \mathrm{O}+3 \mathrm{H} _{2} \mathrm{O}} $$
(iii) मेथिल कीटोन का हैलोफॉर्म अभिक्रिया द्वारा ऑक्सीकरण— ऐसे कीटोन जिसमें कम से कम एक मेथिल समूह कार्बोनिल कार्बन परमाणु से आबंधित होता है ( मेथिल कोटोन), सोडियम हाइपोहैलाइट द्वारा संगत कार्बोक्सिलिक अम्ल के सोडियम लवण में आक्सीकृत हो जाते हैं, जिसमें कार्बोनिल यौगिक की अपेक्षा एक कार्बन परमाणु कम होता है। मेथिल समूह हैलाफार्म में परिवर्तित हो जाता है। यदि अणु में कार्बन-कार्बन द्विकआबंध उपस्थित हो तो वह इस ऑक्सीकरण द्वारा अप्रभावित रहता है।

सोडियम हाइपोआयोडॉइट द्वारा आयोडोफॉर्म अभिक्रिया, भी $\mathrm{CH} _{3} \mathrm{CO}$ या $\mathrm{CH} _{3} \mathrm{CH}(\mathrm{OH})$ समूह की पहचान करने के लिए प्रयुक्त होती है, जो ऑक्सीकरण द्वारा $\mathrm{CH} _{3} \mathrm{CO}$ समूह बनाती हैं।
4. $\boldsymbol{\alpha}$-हाइड्रोजन के कारण होने वाली अभिक्रियाएँ
ऐल्डिहाइड व कीटोन के $\boldsymbol{\alpha}$ - हाइड्रोजन परमाणुओं की अम्लता-ऐल्डिहाइड व कीटोन $\alpha$-हाइड्रोजन की अम्लता के कारण कई अभिक्रियाएँ देते हैं।
कार्बोनिल यौगिकों के $\alpha$-हाइड्रोजन परमाणुओं की अम्लता कार्बोनिल समूह के इलेक्ट्रॉन अपनयन कर लेने (खींच लेने) के प्रबल प्रभाव तथा संयुग्मी क्षार के अनुनाद द्वारा स्थायित्व प्राप्त कर लेने के कारण होती है।
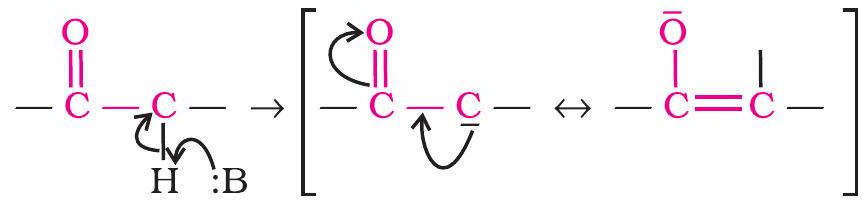
(i) ऐल्डोल संघनन- जिन ऐल्डिहाइडों व कीटोनों में कम से कम एक $\alpha$-हाइड्रोजन विद्यमान होती है, वे तनु क्षार के उत्प्रेरक की तरह उपस्थिति में एक अभिक्रिया द्वारा क्रमशः $\beta$-हाइड्रॉक्सी ऐल्डिहाइड (एल्डोल) अथवा $\beta$-हाइड्रॉक्सी कीटोन (कीटोल) प्रदान करते हैं। इस अभिक्रिया को ऐल्डोल अभिक्रिया कहते हैं।
 3-हाइड्रॉक्सीब्यूटनेल (एल्डोल) (ऐल्डोल संघनन उत्पाद)
3-हाइड्रॉक्सीब्यूटनेल (एल्डोल) (ऐल्डोल संघनन उत्पाद)

उत्पाद में विद्यमान दो प्रकार्यात्मक समूहों, ऐल्डिहाइड व ऐल्कोहॉल के नामों से ऐल्डोल का नाम व्युत्पन्न होता है। ऐल्डोल व कीटोल आसानी से जल निष्कासित करके $\alpha, \beta$-असंतृप्त कार्बोनिल यौगिक देते हैं, जो ऐल्डोल संघनन उत्पाद हैं और यह अभिक्रिया ऐल्डोल संघनन कहलाती है। यद्यपि कीटोन, कीटोल (कीटो व ऐल्कोहॉल समूह युक्त यौगिक) निर्मित करते हैं फिर भी उनकी ऐल्डिहाइडों के साथ समानता होने के कारण उनकी अभिक्रिया के लिए भी सामान्य नाम ऐल्डोल संघनन ही प्रयोग किया जाता है-
(ii) क्रॉस ऐल्डोल संघनन- जब दो भिन्न-भिन्न ऐल्डिहाइड और/या कीटोन के मध्य ऐल्डोल संघनन होता है तो उसे क्रॉस ऐल्डोल संघनन कहते हैं। यदि प्रत्येक में $\alpha$-हाइड्रोजन हो तो ये चार उत्पादों का मिश्रण देते हैं। इसे नीचे एथेनैल व प्रोपेनैल के मिश्रण की ऐल्डोल संघनन अभिक्रिया द्वारा समझाया गया है।

(सरल या स्वयं ऐल्डोल संघनन उत्पाद)
(क्रॉस ऐल्डोल उत्पाद)
क्रॉस ऐल्डोल संघनन में कीटोन भी एक घटक के रूप में प्रयुक्त हो सकते हैं।

1, 3-डाईफ़ेनिलप्रोप-2-ईन-1-ओन
(बेन्ज़ैलएसीटोफीनॉन), मुख्य उत्पाद
5. अन्य अभिक्रियाएँ
(i) कैनिज़ारो अभिक्रिया-ऐल्डिहाइड, जिनमें $\alpha$-हाइड्रोजन परमाणु नहीं होते सांद्र क्षार की उपस्थिति में गरम करने से स्वऑक्सीकरण व अपचयन (असमानुपातन) की अभिक्रियाएँ प्रदर्शित करते हैं। इस अभिक्रिया में ऐल्डिहाइड का एक अणु ऐल्कोहॉल में अपचित होता है जबकि दूसरा अणु कार्बोक्सिलिक अम्ल के लवण में आक्सीकृत हो जाता है।

(ii) इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रिया- ऐरोमेटिक ऐल्डिहाइड व कीटोन उस बेन्जीन वलय पर इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रिया प्रदर्शित करते हैं, जिसमें कार्बोनिल समूह निष्क्रियक तथा मेटा-निर्देशक होता है।

पाठ्निनिहित प्रश्न
8.4 निम्नलिखित यौगिकों को नाभिकरागी योगज अभिक्रियाओं में उनकी बढ़ती हुई अभिक्रियाशीलता के क्रम में व्यवस्थित कीजिए-
(क) एथेनैल, प्रोपेनैल, प्रोपेनोन, ब्यूटेनोन
(ख) बेन्जैल्डिहाइड, $\mathrm{p}$-टॉलूऐल्डिहाइड, $\mathrm{p}$-नाइट्रोबेन्जैल्डिहाइड, ऐसीटोफीनोन संकेत-त्रिविम प्रभाव व इलेक्ट्रॉनिक प्रभाव को ध्यान में रखें।
8.5 निम्नलिखित अभिक्रियाओं के उत्पादों को पहचानिए-
(i)

(ii)
(iii)

(iv)

8.5 डेल्डिहाइडों एवं कीटोनों के उपयोण
रासायनिक उद्योग में ऐल्डिहाइड एवं कीटोन अन्य उत्पादों के संश्लेषण के लिए विलायक, प्रारंभिक पदार्थ और अभिकर्मकों के रूप में प्रयोग किए जाते हैं। फार्मेल्डिहाइड का $40 \%$ जलीय विलयन फार्मोलिन के नाम से सुप्रसिद्ध है जो जैविक प्रतिदर्शों के परिरक्षण में तथा बैकालाइट के विरचन में (फ़ीनॉलफार्मेल्डिहाइड रेज़िन), यूरिया फार्मेल्डिहाइड सरेस तथा अनेक बहुलक उत्पादों में उपयोग होता है। ऐसीटैल्डिहाइड मुख्यतः ऐसीटिक अम्ल, एथिल ऐसीटेट, वाइनिल एसीटेट बहुलकों एवं औषधों के उत्पादन में प्रारंभिक पदार्थ के रूप में उपयोग किया जाता है। बेन्जैल्डिहाइड का उपयोग सुगंध तथा रंजक उद्योग में किया जाता है। ऐसीटोन और एथिलमेथिल कीटोन सामान्य औद्योगिक विलायक हैं। कई ऐल्डिहाइड एवं कीटोन, जैसे- ब्यूटैर्डिहाइड, वेनेलिन, ऐसीटोफ़ीनोन, कपूर आदि अपनी सुगंध और सुरुचिकर प्रभाव के लिए सुप्रसिद्ध हैं।
कार्बोक्सिलिक अम्ल
ऐसे कार्बनिक यौगिक जिनमें कार्बोक्सिलिक, $-\mathrm{COOH}$ प्रकार्यात्मक समूह उपस्थित होता है कार्बोक्सिलिक अम्ल कहलाते हैं। कार्बोक्सिलिक समूह में कार्बोनिल समूह एक हाइड्रॉक्सिल समूह के साथ जुड़ा रहता है, अतः इसका नाम कार्बोक्सिल है। कार्बोक्सिलिक समूह से संयुक्त ऐल्किल या ऐरिल समूह के आधार पर कार्बोक्सिलिक अम्ल ऐलिफैटिक $(\mathrm{RCOOH})$ अथवा ऐरोमैटिक अम्ल $(\mathrm{ArCOOH})$ होते हैं। प्रकृति में कार्बोक्सिलिक अम्ल अत्यधिक संख्या में पाए जाते हैं। कुछ ऐलिफैटिक कार्बोक्सिलिक अम्लों के उच्च सदस्य $\left(\mathrm{C} _{12}-\mathrm{C} _{18}\right)$, जिन्हें वसा अम्ल कहते हैं। प्राकृतिक वसाओं में ग्लिसरॉल के एस्टर के रूप में पाए जाते हैं; अतः कार्बोक्सिलिक अम्ल अन्य महत्वपूर्ण यौगिकों, जैसे- एनहाइड्राइड, एस्टर, एसिड क्लोराइड और ऐमाइडों के संश्लेषण में प्रारंभिक पदार्थ के रूप में प्रयुक्त होते हैं।
8.6 कार्बोक्सिलिक समूह की नामपत्धति व शंरचना
8.6.1 नामपद्धति
कार्बोक्सिलिक अम्ल प्रकृति से प्रारंभिक दौर में विलगित किए गए यौगिकों में से हैं, अतः इनमें से बहुत से सामान्य नामों से जाने जाते हैं। सामान्य नाम प्राकृतिक स्रोतों के लेटिन अथवा ग्रीक नामों से व्युत्पन्न होते हैं। और अंग्रेज़ी में लिखे नाम के अंत में अनुलग्न (ic) इक ऐसिड लगाते हैं, उदाहरणार्थ- फार्मिक ऐसिड या अम्ल, $(\mathrm{HCOOH})$ सर्वप्रथम लाल चीटियों से (लेटिन-फार्मिका का अर्थ चीटियाँ), ऐसीटिक अम्ल सिरके से (लेटिन-ऐसीटम का अर्थ सिरका), ब्यूटेरिक अम्ल $\left(\mathrm{CH} _{3}-\mathrm{CH} _{2}-\mathrm{CH} _{2}-\mathrm{COOH}\right)$ विकृतगंधी मक्खन से (लैटिन-ब्यूटिरम का अर्थ मक्खन ) प्राप्त किया गया।
आईयूपीएसी (IUPAC) पद्धति में ऐलिफैटिक कार्बोक्सिलिक अम्लों का नामकरण करने के लिए संगत ऐल्केन के अंग्रेज़ी में लिखे नाम के अंत में स्थित (-e) के स्थान पर ओइक (-oic) अनुलग्न लगाया जाता है। कार्बन श्रृंखला का अंकन करते समय कार्बोक्सिलिक समूह के कार्बन परमाणु को प्रथम संख्या (संख्या 1) प्रदान की जाती है। एक से अधिक कार्बोक्सिलिक समूह युक्त यौगिकों का नाम लिखने के लिए कार्बोक्सिलिक समूह हटाकर बची संगत ऐल्केन की कार्बन शृंखला के कार्बनों का अंकन करते हैं और कार्बोक्सिल समूहों की स्थिति सहित उनकी संख्या गुणात्मक पूर्वलग्न डाइकार्बोक्सिलिक अम्ल, ट्राइकार्बोक्सिलिक अम्ल इत्यादि को मूल एल्किल श्रृंखला के नाम के आगे जोड़ दिया जाता है। $-\mathrm{COOH}$ समूह की स्थिति गुणात्मक पूर्वलग्न से पहले अरेबिक संख्या में लिख कर दर्शाई जाती है। कुछ कार्बोक्सिलिक अम्लों के सामान्य और आईयूपीएसी नाम सारणी 8.3 में दर्शाए गए हैं।
सारणी 8.3- कुछ कार्बोंक्सिलिक अम्लों के नाम एवं संरचना
| संरंचना | सामान्य नाम | आईयूपीएसी नाम |
|---|---|---|
| $\mathrm{HCOOH}$ $\mathrm{CH} _{3} \mathrm{COOH}$ $\mathrm{CH} _{3} \mathrm{CH} _{2} \mathrm{COOH}$ $\mathrm{CH} _{3}-\mathrm{CH} _{2}-\mathrm{CH} _{2}-\mathrm{COOH}$ $\left(\mathrm{CH} _{3}\right) _{2} \mathrm{CHCOOH}$ $\mathrm{HOOC}-\mathrm{COOH}$ $\mathrm{HOOC}-\mathrm{CH} _{2}-\mathrm{COOH}$ $\mathrm{HOOC}-\left(\mathrm{CH} _{2}\right) _{2}-\mathrm{COOH}$ $\mathrm{HOOC}-\left(\mathrm{CH} _{2}\right) _{3}-\mathrm{COOH}$ $\mathrm{HOOC}-\left(\mathrm{CH} _{2}\right) _{4}-\mathrm{COOH}$ $\mathrm{HOOC}-\mathrm{CH} _{2}-\mathrm{CH}(\mathrm{COOH})-\mathrm{CH} _{2}-\mathrm{COOH}$ $-\mathrm{COOH}$ | फ़ार्मिक अम्ल ऐसीटिक अम्ल प्रोपिओनिक अम्ल ब्यूटाइरिक अम्ल आइसोब्यूटाइरिक अम्ल ऑक्सैलिक अम्ल मेलोनिक अम्ल सक्सीनिक अम्ल ग्लूटरिक अम्ल एडिपिक अम्ल ट्राइकार्बैलिक अम्ल या कार्बैलिक अम्ल बेन्ज़ोइक अम्ल फ़ेनिलऐसीटिक अम्ल थैलिक अम्ल | मेथेनॉइक अम्ल एथेनॉइक अम्ल प्रोपेनॉइक अम्ल ब्यूटेनॉइक अम्ल 2-मेथिलप्रोपेनॉइक अम्ल एथेनडाईओइक अम्ल प्रोपेनडाईओइक अम्ल ब्यूटेनडाइओइक अम्ल पेन्टेनडाईओइक अम्ल हेक्सेनडाईओइक अम्ल प्रोपेन-1,2,3-ट्राइकार्बोक्सिलिक अम्ल बेन्ज़ीनकार्बोक्सिलिक अम्ल ( बेन्ज़ोइक अम्ल) 2-फ़ेनिलएथेनोइक अम्ल |
8.6.2 कार्बोक्सिल समूह की संरचना
कार्बोक्सिलिक समूह में कार्बोक्सिल कार्बन से संयुक्त सभी आबंध एक ही तल में होते हैं तथा एक-दूसरे से $120^{\circ}$ के कोण द्वारा विलगित रहते हैं। कार्बोक्सिल कार्बन, कार्बोनिल कार्बन से निम्नलिखित अनुनादी संरचनाओं के कारण कम इलेक्ट्रानरागी होता है-

8.7 कार्बोक्सिलिक अम्ल बनाने की विधियाँ
कार्बोक्सिलिक अम्ल बनाने की कुछ महत्वपूर्ण विधियाँ निम्नलिखित हैं-
1. प्राथमिक ऐल्कोहॉल व ऐल्डिहाइड से
प्राथमिक ऐल्कोहल सामान्य ऑक्सीकरण कर्मकों, जैसे- उदासीन, अम्लीय या क्षारीय माध्यम में पोटैशियम परमैंगनेट अथवा अम्लीय माध्यम में पोटैशियम डाइक्रोमेट और क्रोमियम ट्राइऑक्साइड द्वारा आसानी से कार्बोक्सिल्कि अम्लों में ऑक्सीकृत हो जाते हैं।
$\mathrm{RCH} _{2} \mathrm{OH} \xrightarrow[\text { 2. } \mathrm{H} _{3} \stackrel{+}{\mathrm{O}}]{\text { 1. क्षारी } \mathrm{KMnO} _{4}} \mathrm{RCOOH}$
$\mathrm{CH} _{3}\left(\mathrm{CH} _{2}\right) _{8} \mathrm{CH} _{2} \mathrm{OH} \xrightarrow{\mathrm{CrO} _{3}-\mathrm{H} _{2} \mathrm{SO} _{4}} \mathrm{CH} _{3}\left(\mathrm{CH} _{2}\right) _{8} \mathrm{COOH}$
1 -डेकेनॉल
डेकेनॉइक अम्ल
मृदु आक्सीकरण कर्मकों के उपयोग से ऐल्डिहाइड द्वारा भी कार्बोक्सिलिक अम्ल प्राप्त किए जाते हैं (खंड 8.4)।
2. ऐल्किल बेन्जीनों से
ऐरोमैटिक कार्बोक्सिलिक अम्ल ऐल्किल बेन्ज़ीनों के क्रोमिक अम्ल अथवा क्षारीय $\mathrm{KMnO} _{4}$ द्वारा प्रबल ऑक्सीकरण से विरचित किए जा सकते हैं। संपूर्ण पार्श्व शृंखला चाहें किसी भी लंबाई की हो, ऑक्सीकृत होकर कार्बोक्सिल समूह निर्मित करती है। प्राथमिक व द्वितीयक ऐल्किल समूह भी इसी प्रकार से ऑक्सीकृत होते हैं जबकि तृतीयक समूह प्रभावित नहीं होता। उपयुक्त रूप से प्रतिस्थापित ऐल्कीन भी इन ऑक्सीकारकों द्वारा ऑक्सीकृत होकर कार्बोक्सिलिक अम्ल उत्पन्न करती हैं। (एकक-9, कक्षा-11)
 बेन्ज़ोइक अम्ल
बेन्ज़ोइक अम्ल

3. नाइट्राइल और ऐमाइड से
उत्प्रेरक के रूप में $\mathrm{H}^{+}$या $\mathrm{OH}^{-}$आयनों की उपस्थिति में नाइट्राइल पहले ऐमाइड और फिर अम्लों में जल अपघटित हो जाते हैं। अभिक्रिया को ऐमाइड पद पर रोकने के लिए मृदु अभिक्रिया परिस्थितियाँ प्रयुक्त की जाती है।

4. ग्रीन्यार अभिकर्मक से
ग्रीन्यार अभिकर्मक कार्बन डाइऑक्साइड (शुष्क बर्फ़) के साथ अभिक्रिया से कार्बोक्सिलिक अम्ल के लवण निर्मित करते हैं, जो खनिज अम्ल द्वारा अम्लन से संगत कार्बोक्सिलिक अम्ल देते हैं।
 जैसा कि हम जानते हैं; ग्रीन्यार अभिकर्मक एवं ऐल्किल नाइट्राइल ऐल्किल हैलाएडों से विरचित किए जा सकते हैं। (देखिए एकक 6 , कक्षा 12)। उपरोक्त विधियाँ (3 तथा 4) ऐल्किल हैलाइडों को संगत कार्बोक्सिलिक अम्लों में परिवर्तित करने में उपयोगी हैं जिसमें ऐल्किल हैलाइड में उपस्थित कार्बन परमाणुओं से एक कार्बन परमाणु अधिक विद्यमान होता है (श्रेणी का अवरोहण)।
जैसा कि हम जानते हैं; ग्रीन्यार अभिकर्मक एवं ऐल्किल नाइट्राइल ऐल्किल हैलाएडों से विरचित किए जा सकते हैं। (देखिए एकक 6 , कक्षा 12)। उपरोक्त विधियाँ (3 तथा 4) ऐल्किल हैलाइडों को संगत कार्बोक्सिलिक अम्लों में परिवर्तित करने में उपयोगी हैं जिसमें ऐल्किल हैलाइड में उपस्थित कार्बन परमाणुओं से एक कार्बन परमाणु अधिक विद्यमान होता है (श्रेणी का अवरोहण)।
5. ऐसिल हैलाइड और एनहाइड्राइड से
ऐसिड क्लोराइड जल द्वारा जलअपघटित होकर कार्बोक्सिलिक अम्ल या जलीय क्षारीय माध्यम में अधिक आसानी से जलअपघटित होकर कार्बोक्सिलेट आयन देते हैं, जो अम्लन द्वारा संगत कार्बोक्सिलिक अम्ल देते हैं। दूसरी ओर ऐसिल एनहाइड्राइड जल द्वारा जलअपघटित होकर संगत अम्ल देते हैं।
 ऐनहाइड्राइड
ऐनहाइड्राइड
6. एस्टर से
एस्टरों के अम्लीय जल अपघटन से सीधे ही कार्बोक्सिलिक अम्ल प्राप्त होते हैं। जबकि क्षारीय जल अपघटन द्वारा कार्बोक्सिलेट प्राप्त होते हैं, जो अम्लन द्वारा संगत कार्बोक्सिलिक अम्ल देते हैं।
एथिल बेन्ज़ोएट

$\mathrm{CH} _{3} \mathrm{CH} _{2} \mathrm{CH} _{2} \mathrm{COOC} _{2} \mathrm{H} _{5}$ एथिल ब्यूटेनोएट
बेन्ज़ोइक अम्ल $\mathrm{CH} _{3} \mathrm{CH} _{2} \mathrm{CH} _{2} \mathrm{COONa}+\mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OH}$ $\downarrow \mathrm{H} _{3} \mathrm{O}^{+}$
$\mathrm{CH} _{3} \mathrm{CH} _{2} \mathrm{CH} _{2} \mathrm{COOH}$
ब्यूटॉनॉइक अम्ल
8.8 भतिक बुण
$\mathrm{RCOOH}$ व $\mathrm{H} _{2} \mathrm{O}$ में हाइड्रोजन आबंधन
ऐलिफैटिक कार्बोक्सिलिक अम्ल की श्रेणी में नौ कार्बन परमाणुओं तक की शृंखला वाले सदस्य सामान्य ताप पर अरुचिकर गंध वाले रंगहीन द्रव होते हैं। इस श्रेणी के उच्च सदस्य मोम जैसे ठोस होते हैं तथा अल्प वाष्पशील एवं व्यावहारिक रूप से गंधहीन होते हैं। कार्बोक्सिलिक अम्लों के क्वथनांक समतुल्य आण्विक द्रव्यमानों वाले ऐल्डिहाइडों, कीटोनों यहाँ तक कि ऐल्कोहॉलों से भी उच्च होते हैं। कार्बोक्सिलिक अम्लों का यह गुणधर्म उनके अणुओं में परस्पर अधिक व्यापक अंतराआण्विक हाइड्रोजन आबंधन द्वारा संगुणन के कारण उत्पन्न होता है। ये हाइड्रोजन आबंध वाष्प अवस्था में भी पूर्ण रूप से नहीं टूटते। वास्तव में अधिकांश कार्बोक्सिलिक अम्ल वाष्प प्रावस्था एवं ऐप्रोटिक विलायकों में हाइड्रोजन आबंधित द्वितय के रूप में उपस्थित होते हैं।
चार कार्बन परमाणु तक सरल ऐलिफैटिक कार्बोक्सिलिक अम्ल हाइड्रोजन आबंध निर्मित कर सकने के कारण जल में मिश्रणीय होते हैं। कार्बन परमाणुओं की संख्या बढ़ने के साथ विलेयता घटती जाती है। उच्चतर कार्बोक्सिलिक अम्ल हाइड्रोकार्बन शृंखला की जलविरागी अन्योन्यक्रिया बढ़ने के कारण विशेषकर जल में अविलेय होते हैं। बेन्ज़ोइक अम्ल, जो कि सरलतम ऐरोमैटिक कार्बोक्सिक अम्ल है; ठंडे जल में लगभग अविलेय होता है। कार्बोक्सिलिक अम्ल बेन्ज़ीन, ईथर, ऐल्कोहॉल, इत्याद, जैसे क्रम ध्रुवीय विलायकों में भी विलेय होते हैं।
8.9 रासायनिक अभिक्रियाडएँ
8.9.1 अभिक्रियाएँ जिनमें $\mathrm{O}-\mathrm{H}$ आबंध का विदलन होता है
कार्बोक्सिलिक अम्लों की रासायनिक अभिक्रियाएँ निम्न प्रकार से वर्गीकृत हैं-
अम्लता
धातु व क्षारों के साथ अभिक्रिया- ऐल्कोहॉलों की तरह कार्बोक्सिलिक अम्ल विद्युत धनी धातुओं के साथ क्रिया करके हाइड्रोजन मुक्त करते हैं तथा फ़ीनॉलों की तरह क्षारों के साथ लवण बनाते हैं। यह दुर्बल क्षारक जैसे कार्बोनेट, हाइड्रोजनकार्बोनेट के साथ अभिक्रिया करके कार्बन डाइऑक्साइड उत्पन्न करते हैं। यह अभिक्रियाएँ यौगिक में उपस्थित कार्बोक्सिलिक समूह को पहचानने के लिए प्रयुक्त की जाती हैं।
$$ \begin{aligned} & 2 \mathrm{R}-\mathrm{COOH}+2 \mathrm{Na} \longrightarrow 2 \mathrm{R}-\mathrm{CO} \overline{\mathrm{O}} \mathrm{Na}+\mathrm{H} _{2} \\ & \text { सोडियम कार्बोक्सिलेट } \end{aligned} $$
$$ \begin{aligned} & \mathrm{R}-\mathrm{COOH}+\mathrm{NaOH} \longrightarrow \mathrm{R}-\mathrm{COO} \mathrm{N}^{+}+\mathrm{H} _{2} \mathrm{O} \\ & \mathrm{R}-\mathrm{COOH}+\mathrm{NaHCO} _{3} \longrightarrow \mathrm{R}-\mathrm{CO} \overline{\mathrm{O} N} \mathrm{Na}^{+}+\mathrm{H} _{2} \mathrm{O}+\mathrm{CO} _{2} \end{aligned} $$
कार्बोक्सिलिक अम्ल जल में वियोजित होकर कार्बोक्सिलेट ऋणायन तथा हाइड्रोनियम आयन देते हैं जो अनुनाद द्वारा स्थायित्व प्राप्त करते हैं।
इलेक्ट्रॉन दाता समूह (EDG) कार्बोक्सिलेट आयन को अस्थायी बना देते हैं। और अम्ल को दुर्बल कर देते हैं।
 उपरोक्त अभिक्रिया के लिए-
उपरोक्त अभिक्रिया के लिए-
$$ K _{e q}=\frac{\left[\mathrm{H} _{3} \mathrm{O}^{+}\right]\left[\mathrm{RCOO}^{-}\right]}{\left[\mathrm{H} _{2} \mathrm{O}\right][\mathrm{RCOOH}]} \quad K _{a}=K _{e q}\left[\mathrm{H} _{2} \mathrm{O}\right]=\frac{\left[\mathrm{H} _{3} \mathrm{O}^{+}\right]\left[\mathrm{RCOO}^{-}\right]}{[\mathrm{RCOOH}]} $$
यहाँ $K _{e q}$ साम्यावस्था स्थिरांक तथा $K _{a}$ अम्ल वियोजन स्थिरांक है। सुविधा के लिए अम्लों की सामर्थ्य सामान्यतः $K _{a}$ मान की बजाय $p K _{a}$ के मान से इंगित करते हैं।
$$ \mathrm{p} K _{a}=-\log K _{a} $$
हाइड्रोक्लोरिक अम्ल के $\mathrm{p} K _{a}$ का मान -7.0 है, जबकि ट्राइफ्लुओरोऐसीटिक अम्ल (प्रबलतम कार्बोक्सिलिक अम्ल), बेन्जोइक अम्ल तथा ऐसीटिक अम्ल के $\mathrm{pK} _{\mathrm{a}}$ के मान क्रमशः $0.23,4.19$ एवं 4.76 होते हैं।
अम्ल का $\mathrm{p} K _{a}$ मान जितना कम होगा अम्ल उतना ही प्रबल होगा (एक उत्तम प्रोटॉन दाता)। प्रबल अम्लों का $\mathrm{pK} _{\mathrm{a}}$ मान 1 से कम होता है। मध्यम प्रबल अम्लों के $\mathrm{p} K _{a}$ मान 1 से 5 के मध्य होते हैं। दुर्बल अम्लों के $\mathrm{p} K _{a}$ के मान 5 से 15 के मध्य तथा अधिक दुर्बल अम्लों के $\mathrm{pK}$ मान 15 से अधिक होते हैं।

इलेक्ट्रॉन अपनयन करने वाले समूह (EWG) कार्बोक्सिलिक आयन को स्थायीकृत करते हैं जिससे अम्ल की सामर्थ्य बढ़ जाती है।

कार्बोक्सिलिक अम्ल खनिज अम्लों से दुर्बल होते हैं परंतु ऐल्कोहॉलों एवं अनेक सरल फ़ीनॉलों से (एथेनॉल के $\mathrm{p} K _{a}$ का मान $\sim 16$ है तथा फ़ीनॉल का $p K _{a}$ मान 10 होता है।) प्रबल होते हैं। वास्तव में आपने अब तक जिन कार्बनिक यौगिकों का अध्ययन किया है उनमें कार्बोक्सिलिक अम्ल सर्वाधिक अम्लीय हैं। आपको पहले से ही ज्ञात है कि फ़ीनॉल ऐल्कोहॉल की अपेक्षा क्यों अधिक अम्लीय होते हैं। इसी प्रकार से कार्बोक्सिलिक अम्लों की फ़ीनॉलों की अपेक्षा उच्च अम्लता को समझा जा सकता है। कार्बोक्सिलिक अम्ल का संयुग्मी क्षारक, कार्बोक्सिलेट आयन, दो समान अनुनादी संरचनाओं द्वारा स्थायित्व प्राप्त करता है एवं इसमें ऋणावेश अधिक विद्युत ऋणी ऑक्सीजन परमाणु पर स्थित होते हैं। फ़ीनॉल का संयुग्मी क्षारक एक फीनॉक्साइड आयन होता है, जिसकी अनुनादी संरचनाएं असमान होती हैं तथा इनमें ॠणावेश अल्प विद्युतनऋणी कार्बन परमाणु पर स्थित होता है। इसलिए फीनॉक्साइड आयन में अनुनाद उतना महत्वपूर्ण नहीं है जितना कार्बोक्सिलेट आयन में। कार्बोक्सिलेट आयन का ऋणावेश दो विद्युतऋणी ऑक्सीजन परमाणुओं पर विस्थानित होता है, जबकि फीनॉक्साइड आयन में यह ऋणावेश एक ऑक्सीजन परमाणु तथा कम विद्युतऋणी कार्बन परमाणु पर कम प्रभावशाली ढंग से विस्थानित होता है (एकक 7, कक्षा 12)। फलस्वरूप कार्बोक्सिलेट आयन, फ़ीनॉक्साइड आयन की तुलना में अधिक स्थायित्व प्राप्त होता है। अतः कार्बोक्सिलिक अम्ल फ़ीनॉलों की अपेक्षा अधिक अम्लीय होते हैं।
कार्बोक्सिलिक अम्लों की अम्लता पर प्रतिस्थापियों का प्रभाव-प्रतिस्थापी संयुग्मी क्षारक के स्थायित्व को प्रभावित कर सकते हैं, अतः कार्बोक्सिलिक अम्लों की अम्लता को भी प्रभावित करते हैं। इलेक्ट्रॉन अपनयन करने वाले समूह प्रेरणिक और/या अनुनादी प्रभाव द्वारा ॠणावेश को विस्थानित करके संयुग्मी क्षारक को स्थायित्व प्रदान करते हैं और कार्बोक्सिलिक अम्ल की अम्लता बढ़ा देते हैं। इसके विपरीत इलेक्ट्रॉन दाता समूह संयुग्मी क्षारक को अस्थायित्व प्रदान करके अम्लता घटा देते हैं।
निम्नलिखित समूहों का प्रभाव अम्लता बढ़ाने के क्रम में हैं।
$\mathrm{Ph}<\mathrm{I}<\mathrm{Br}<\mathrm{Cl}<\mathrm{F}<\mathrm{CN}<\mathrm{NO} _{2}<\mathrm{CF} _{3}$
अतः निम्नलिखित अम्लों को उनकी घटती हुई अम्लता के आधार पर व्यवस्थित किया गया है ( $\mathrm{pK} _{a}$ मान क्रम पर आधारित)-

कार्बोक्सिल समूह पर फ़ेनिल अथवा वाइनिल समूह के सीधे संयुक्त होने से संगत कार्बोक्सिलिक अम्लों की अम्लता बढ़ जाती है, जो नीचे दर्शाए गए अनुनाद प्रभाव के कारण अपेक्षित कमी के विपरीत है।

ऐसा कार्बोनिल समूह से संलग्नित $s p^{2}$ संकरित कार्बन की उच्च विद्युतऋणात्मकता के कारण होता है। ऐरोमैटिक कार्बोक्सिलिक अम्ल की फ़ेनिल वलय पर इलेक्ट्रॉन अपनयन करने वाले समूह की उपस्थिति अम्लता को बढ़ाती है जबकि इलेक्ट्रॉन दाता समूह की उपस्थिति अम्लता को घटाती है।
4-मेथॉक्सीबेन्ज़ोइक अम्ल $\left(\mathrm{p} K _{a}=4.46\right)$
बन्ज़ोइक अम्ल $\left(\mathrm{p} K _{a}=4.19\right)$
4-नाइट्रोबेन्ज़ोइक अम्ल $\left(\mathrm{p} K _{a}=3.41\right)$
8.9.2 $\mathbf{C}-\mathbf{O H}$ आबंध विदलन संबंधी अभिक्रियाएँ
1. एनहाइड्राइड का विरचन
कार्बोक्सिलिक अम्लों खनिज अम्लों जैसे $\mathrm{H} _{2} \mathrm{SO} _{4}$ अथवा $\mathrm{P} _{2} \mathrm{O} _{5}$ के साथ गर्म करने पर संगत एनहाइड्राइड बनते हैं।

2. एस्टरीकरण
कार्बोक्सिलिक अम्ल ऐल्कोहॉलों अथवा फीनॉलों द्वारा सांद्र सल्फ्यूरिक अम्ल अथवा हाइड्रोजन क्लोराइड गैस जैसे खनिज अम्ल उत्प्रेरकों की उपस्थिति में एस्टर बनाते हैं।
$$ \mathrm{RCOOH}+\mathrm{R}^{\prime} \mathrm{OH} \rightleftharpoons \mathrm{H}^{+} \rightleftharpoons \mathrm{RCOOR}^{\prime}+\mathrm{H} _{2} \mathrm{O} $$
कार्बोंक्सिलिक अम्लों के डस्टरीकरण की क्रियाविधि
कार्बोक्सिलिक अम्लों का ऐल्कोहॉलों के साथ एस्टरीकरण एक प्रकार की नाभिकरागी ऐसिल प्रतिस्थापन अभिक्रिया है। कार्बोनिल की ऑक्सीजन का प्रोटॉनन कार्बोनिल समूह को ऐलकोहॉल के नाभिकरागी योगज के लिए सक्रिय कर देता है। चतुष्फलकीय मध्यवर्ती में एक प्रोटॉन का स्थानांतरण हाइड्राक्सिल समूह को $-\stackrel{+}{\mathrm{O}} \mathrm{H} _{2}$ समूह में परिवर्तित कर देता है जो एक अधिक अच्छा अवशिष्ट समूह होने के कारण, उदासीन जल अणु के रूप में विलोपित हो जाता है। अंततः इस प्रकार निर्मित प्रोटॉनित एस्टर प्रोटॉन को त्यागकर एक एस्टर दे देती है।
कार्बोक्सिलिक अम्ल
एस्टर
प्रोटॉनित एस्टर
चतुष्फलकीय मध्यवर्ती
$$
\mid \uparrow \text { प्रोटॉन }
$$
3. $\mathrm{PCl} _{5}, \mathrm{PCl} _{3}$ एवं $\mathrm{SOCl} _{2}$ के साथ अभिक्रिया
कार्बोक्सिलिक अम्लों का हाइड्रॉक्सिल समूह, ऐल्कोहॉलों के हाइड्रॉक्सिल समूह की भाँति व्यवहार करता है और फॉस्फोरस पेन्टाक्लोराइड $\left(\mathrm{PCl} _{5}\right)$, फॉस्फोरस ट्राइक्लोराइड $\left(\mathrm{PCl} _{3}\right)$ अथवा थायोनिल क्लोराइड $\left(\mathrm{SOCl} _{2}\right)$ के साथ अभिक्रिया द्वारा क्लोरीन परमाणु से प्रतिस्थापित हो जाता है। थायोनिल क्लोराइड को वरीयता दी जाती है, क्योंकि इस अभिक्रिया के दो अन्य उत्पाद गैसीय होते हैं, जो अभिक्रिया मिश्रण से बाहर निकल जाते हैं। इसलिए प्राप्त उत्पाद का परिशोधन सुगम हो जाता है।
$$ \begin{aligned} & \mathrm{RCOOH}+\mathrm{PCl} _{5} \longrightarrow \mathrm{RCOCl}+\mathrm{PCl} _{3}+\mathrm{HCl} \\ & 3 \mathrm{RCOOH}+\mathrm{PCl} _{3} \longrightarrow 3 \mathrm{RCOCl}+\mathrm{H} _{3} \mathrm{PO} _{3} \\ & \mathrm{RCOOH}+\mathrm{SOCl} _{2} \longrightarrow \mathrm{RCOCl}+\mathrm{SO} _{2}+\mathrm{HCl} \end{aligned} $$
4. अमोनिया के साथ अभिक्रिया
कार्बोक्सिलिक अम्ल अमोनिया के साथ अभिक्रिया द्वारा अमोनियम लवण बनते हैं जो अधिक उच्च ताप पर गर्म करने से ऐमाइड बनाते हैं। उदाहरणार्थ-

अमोनियम बेन्ज़ोएट

8.9.3 कार्बोक्सिलिक समूह $(-\mathrm{COOH})$ संबंधी अभिक्रियाएँ
1. अपचयन
कार्बोक्सिलिक अम्ल लीथियम ऐलुमिनियम हाइड्राइड अथवा डाइबोरेन द्वारा प्राथमिक ऐल्कोहॉलों में अपचित हो जाते हैं। डाइबोरेन, एस्टर, नाइट्रो, हैलो इत्यादि जैसे प्रकार्यात्मक समूहों को सरलतापूर्वक अपचित नहीं करता। सोडियम बोरोहाइड्राइड कार्बोक्सिल समूह को अपचित नहीं करता।
R-COOH $\xrightarrow[\text { (ii) } \mathrm{H} _{3} \mathrm{O}^{+}]{\text {(i) } \mathrm{LiAlH} _{4} / \text { ईथर } \quad \text { अथवा } \mathrm{B} _{2} \mathrm{H} _{6}} \mathrm{R}-\mathrm{CH} _{2} \mathrm{OH}$
2. विकार्बोक्सिलन
कार्बोक्सिलिक अम्लों के सोडियम लवणों को सोडालाइम $(\mathrm{NaOH}$ तथा $\mathrm{CaO}, 3: 1$ के अनुपात में) के साथ गरम करने पर कार्बन डाइऑक्साइड निकल जाती है एवं हाइड्रोकार्बन प्राप्त होते हैं। यह अभिक्रिया विकार्बोक्सिलन (Decarboxylation) कहलाती है।
$$ \mathrm{R}-\mathrm{COONa} \xrightarrow[\text { ताप }]{\mathrm{NaOH} & \mathrm{CaO}} \mathrm{R}-\mathrm{H}+\mathrm{Na} _{2} \mathrm{CO} _{3} $$
कार्बोक्सिलिक अम्लों के क्षार धातु लवणों के जलीय विलयन का वैद्युतअपघटन द्वारा विकार्बोक्सिलन हो जाता है तथा ऐसे हाइड्रोकार्बन निर्मित होते हैं जिसमें कार्बन परमाणुओं की संख्या, अम्ल के ऐल्किल समूह में उपस्थित कार्बन परमाणुओं की संख्या से दुगुनी होती है। इस अभिक्रिया को कोल्बे वैद्युत्-अपघटन (Kolbe Electrolysis ) कहते हैं। (एकक-9, कक्षा-11)
8.9.4 हाइड्रोकार्बन भाग में प्रतिस्थापन अभिक्रियाएँ
1. हैलोजनन
ऐसे कार्बोक्सिलिक अम्ल जिनमें $\alpha$-हाइड्रोजन विद्यमान होता है, लाल फ़ॉस्फ़ोरस की अल्प मात्रा की उपस्थिति में क्लोरीन अथवा ब्रोमीन के साथ अभिक्रिया द्वारा $\alpha$-हैलोकार्बोक्सिलिक अम्ल देते हैं। इस अभिक्रिया को हेलफोलार्ड जेलिंस्की अभिक्रिया ( Hell-Volhard-Zelinsky Reaction ) कहते हैं।

2. वलय प्रतिस्थापन
ऐरोमेटिक कार्बोक्सिलिक अम्ल इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाएं प्रदर्शित करते हैं, जिनमें कार्बोक्सिल समूह एक निष्क्रियक एवं मेटा-निर्देशी समूह की भाँति व्यवहार करता है। ऐरोमेटिक कार्बोक्सिलिक अम्ल फ्रीडेल-क्राफ्ट्स (Friedel Crafts) अभिक्रिया प्रदर्शित नहीं करते। (चूँकि कार्बोक्सिल समूह निष्क्रियक समूह है एवं उत्प्रेरक ऐलुमिनियम क्लोराइड (लूईस अम्ल) कार्बोक्सिल समूह से आबंधित हो जाता है।
$m$-नाइट्रोबेन्ज़ोइक अम्ल
$m$-ब्रोमोबेन्ज़ोइक अम्ल
8.10 कार्बोक्सिलिक अम्लों के उपयोग
मेथेनॉइक अम्ल रबर, वस्त्र, रँगाई, चमड़ा एवं इलेक्ट्रोप्लेटिंग उद्योगों में उपयोग में आता है। एथेनॉइक अम्ल विलायक के रूप में तथा खाद्य उद्योगों में सिरके के रूप में उपयोग किया जाता है। हैक्सेनडाइओइक अम्ल का उपयोग नाइलोन- 6,6 के निर्माण में होता है। बेन्ज़ोइक अम्ल की एस्टरों का उपयोग सुगंध द्रव्यों में होता है। सोडियम बेन्ज़ोएट का उपयोग खाद्य परिरक्षण में होता है। उच्चतर वसीय अम्लों का उपयोग साबुन एवं अपमार्जकों के उत्पादन में किया जाता है।
सारांश
ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल, कार्बनिक यौगिकों के कुछ महत्वपूर्ण वर्ग हैं जिनमें कार्बोनिल समूह उपस्थित हैं। ये अत्यधिक ध्रुवीय अणु होते हैं। अतः ये हाइड्रोकार्बनों एवं तुलनीय आण्विक द्रव्यमानों वाले ईथरों जैसे कम ध्रुवीय यौगिकों की तुलना में अधिक ताप पर उबलते हैं। इनके निम्नतर सदस्य जल में अत्यधिक विलेय होते हैं, क्योंकि ये जल के साथ हाइड्रोजन आबंध बना सकते हैं। उच्चतर सदस्य अत्यधिक लंबी जल विरागी कार्बन शृंखला की उपस्थिति के कारण जल में अविलेय होते हैं किंतु सामान्य कार्बनिक विलायकों में विलेय होते हैं। ऐल्डिहाइडों को प्राथमिक ऐल्कोहॉलों के विहाइड्रोजनन या नियंत्रित ऑक्सीकरण अथवा ऐसिल हैलाइडों के नियंत्रित अपचयन द्वारा विरचित किया जा सकता है। ऐरोमेटिक ऐल्डीहाइड भी ऑक्सीकरण द्वारा निम्न प्रकार से बनाए जा सकते हैं।
- ऐसीटिक ऐनहाइड्राइड की उपस्थिति में मेथिल बेन्ज़ीनों के क्रोमिलक्लोराइड अथवा $\mathrm{CrO} _{3}$ द्वारा ऑक्सीकरण से।
- निर्जल ऐलुमिनियम क्लोराइड या क्यूप्रस क्लोराइड की उपस्थिति में ऐरीनो के कार्बनमोनोक्साइड एवं हाइड्रोक्लोरिक अम्ल द्वारा फार्मिलन।
- बैन्जल क्लोराइड के जलअपघटन द्वारा।
कीटोनों को द्वितीयक ऐल्कोहॉलों के ऑक्सीकरण और ऐल्काइनों के जलयोजन (Hydration) से विरचित किया जाता है। कीटोनों को ऐसिल क्लोराइड की डाइऐल्किल कैडमियम के साथ अभिक्रिया द्वारा भी बनाया जा सकता है। ऐरोमैटिक कीटोनों को विरचित करने की एक अच्छी विधि ऐरोमैटिक हाइड्रोकार्बनों का ऐसिल क्लोराइडों तथा ऐनहाइड्राइडों द्वारा फीडेल क्राफ्ट्स ऐसिलीनन है। ऐल्डिहाइड एवं कीटोन दोनों ही ऐल्कीनों के ओजोनन द्वारा विरचित किए जा सकते हैं। ऐल्डिहाइड एवं कीटोन $\mathrm{HCN}, \mathrm{NaHSO} _{3}$ ऐल्कोहालों (या डाइऑलों), अमोनिया व्युत्पन्नों और ग्रीन्यार अभिकर्मकों जैसे अनेक नाभिकरागियों (Nucleophiles) के साथ कार्बोनिल समूह पर नाभिकरागी योगज अभिक्रियाएं देते हैं। ऐल्डिहाइड एवं कीटोनों में उपस्थित $\alpha$-हाइड्रोजन अम्लीय होते हैं। अतः कम से कम एक $\alpha$-हाइड्रोजन युक्त ऐल्डिहाइड एवं कीटोन क्षार की उपस्थिति में ऐल्डोल संघनन द्वारा क्रमश; $\alpha$-हाइड्रॉक्सीऐल्डिहाइड (ऐल्डोल) एवं $\beta$-हाइड्रॉक्सीकीटोन (कीटोल) बनाते हैं। ऐसे ऐल्डिहाइड जिनमें $\alpha$-हाइड्रोजन नहीं होता है सांद्र क्षार की उपस्थिति में कैनिज़ारो अभिक्रिया देते हैं। $\mathrm{LiAlH} _{4} \mathrm{NaBH} _{4}$ या उत्प्रेरित हाइड्रोजनन से ऐल्डिहाइड एवं कीटोन अपचित होकर ऐल्कोहॉल बनाते हैं। ऐल्डिहाइडों एवं कीटोनों का कार्बोनिल समूह क्लीमेन्सन अपचयन या वोल्फ किश्नर अपचयन द्वारा मेथेलीन समूह में अपचयित हो जाता है। टॉलेन अभिकर्मक एवं फ्रेलिंग विलयन के समान मृदु ऑक्सीकरण अभिकर्मक ऐल्डिहाइडों को आसानी से कार्बोक्सिलिक अम्लों में ऑक्सीकृत कर देते हैं। इन ऑक्सीकरण अभिक्रियाओं का उपयोग ऐल्डिहाइडों एवं कीटोनों में विभेद करने में किया जाता है। कार्बोक्सिलिक अम्लों का विरचन प्राथमिक ऐल्कोहॉलों, ऐल्डिहाइडों एवं ऐल्कीनों के ऑक्सीकरण, नाइट्राइलों के जलअपघटन और ग्रीन्यार अभिकर्मकों की कार्बन डाइऑक्साइड द्वारा किया जाता है। ऐरोमैटिक कार्बोक्सिलिक अम्लों को भी पार्श्व शृंखला वाले ऐल्किलबेन्ज़ीन के ऑक्सीकरण से विरचित किया जा सकता है। यद्यपि कार्बोक्सिलिक अम्ल खनिज अम्लों की तुलना में बहुत दुर्बल होते हैं, किंतु ऐल्कोहॉलों एवं अधिकतर अतिसरल फ़ीनॉलों से काफी अधिक अम्लीय होते हैं। कार्बोक्सिलिक अम्लों को $\mathrm{LiAlH} _{4}$ या इससे बेहतर ईथर विलयन में डाइबोरेन द्वारा प्राथमिक ऐल्कोहॉलों में अपचित किया जा सकता है। कार्बोक्सिलिक अम्लों का लाल फॉस्फोरस की उपस्थिति में $\mathrm{Cl} _{2}$ या $\mathrm{Br} _{2}$ के साथ $\alpha$-हैलोजनन होता है (हेलफोलार्ड जेलिंसकी अभिक्रिया )। मेथेनैल, ऐथेनैल, प्रोपेनोन, बेन्ज़ैल्डिहाइड, फॉर्मिक अम्ल, ऐसीटिक अम्ल, बेन्ज़ोइक अम्ल आदि अनेक कार्बोनिल यौगिक उद्योगों में महत्वपूर्ण हैं।










