ऐल्कोहॉल, फ्रीनॉल और ईथर क्रमशः अपमार्जक, पूतिरोधी एवं सुगंधि बनाने के मूल यौगिक हैं।
आपने पढ़ा है कि किसी हाइड्रोकार्बन के एक या उससे अधिक हाइड्रोजन परमाणुओं के दूसरे परमाणु या परमाणुओं के समूहों द्वारा प्रतिस्थापन से पूर्णतः नए यौगिकों का निर्माण होता है, जिनके गुणधर्म और अनुप्रयोग बिलकुल भिन्न होते हैं। जब ऐलिफ़ैटिक और ऐरोमैटिक हाइड्रोकार्बन का कोई हाइड्रोजन परमाणु हाइड्रॉक्सिल समूह द्वारा प्रतिस्थापित होता है तो क्रमशः ऐल्कोहॉल तथा फ़ीनॉल बनते हैं। इन वर्गों के यौगिकों के, उद्योगों और हमारे दैनिक जीवन में अनेक अनुप्रयोग हैं। उदाहरणार्थ, क्या आपने कभी ध्यान दिया है कि लकड़ी के फ़र्नीचर की पॉलिश में प्रयुक्त होने वाली सामान्य स्प्रिट मुख्य रूप से हाइड्रॉक्सिल समूह युक्त यौगिक एथेनॉल है। खाद्य शर्करा, वस्त्रों में प्रयुक्त कपास, लिखने के लिए कागज़, सभी
ऐल्कोहॉल में एक अथवा अधिक हाइड्रॉक्सिल
ऐल्कॉक्सी अथवा ऐरिलॉक्सी (
इस एकक में, हम तीन वर्गों के यौगिकों के बारे में पढ़ेंगे; यह हैं- ऐल्कोहॉल, फ़ीनॉल एवं ईथर।
7.1 वर्गीकरण
यौगिकों के वर्गीकरण से उनका अध्ययन क्रमबद्ध एवं सरल हो जाता है। इसलिए आइए, हम पहले यह सीखें कि ऐल्कोहॉलों, फ़ीनॉलों एवं ईथरों को किस प्रकार वर्गीकृत किया जाता है?
7.1.1 एल्कोहॉल मोनो, डाइ, ट्राइ एवं पॉलीहाइड्रिक एल्कोहॉल
ऐल्कोहॉलों और फ़ीनॉलों को उनके यौगिकों में उपस्थित एक (मोनो-), दो (डाइ-), तीन (ट्राइ-) अथवा अधिक हाइड्रॉक्सिल
| I | ||
| मोनोहाइड्रिक | डाइहाइड्रिक | ट्राइहाइड्रिक |
मोनोहाइड्रिक ऐल्कोहॉलों को हाइड्रॉक्सिल समूह से जुड़े कार्बन परमाणु की संकरण अवस्था के अनुसार पुन: वर्गीकृत किया जा सकता है।
(i) यौगिक जिनमें
ऐल्कोहॉलों के इस वर्ग में हाइड्रॉक्सिल
प्राथमिक, द्वितीयक तथा तृतीयक ऐल्कोहॉल- इन तीन प्रकार के ऐल्कोहॉलों में हाइड्रॉक्सिल
प्राथमिक
द्वितीयक
तृतीयक
ऐलिलिक ऐल्कोहॉल- इस प्रकार के ऐल्कोहॉल में -
उदाहरणार्थ-
प्राथमिक
द्वितीयक
तृतीयक
बेन्ज़िलिक ऐल्कोहॉल- इस प्रकार के ऐल्कोहॉल में -

प्राथमिक
द्वितीयक
तृतीयक
ऐलिलिक एवं बेंज़िलिक ऐल्कोहॉल भी प्राथमिक, द्वितीयक अथवा तृतीयक हो सकती हैं।
(ii) यौगिक जिनमें
इन ऐल्कोहॉलों में -OH समूह कार्बन-कार्बन द्विक्आबंध जैसे वाइनिलिक कार्बन या ऐरिल कार्बन से जुड़ा होता है इन्हें वाइनिलिक ऐल्कोहॉल भी कहते हैं।
वाइनिलिक ऐल्कोहॉल-
7.1.2 फ़ीनॉल मोनो, डाइ एवं ट्राई हाइड्रिक फ़ीनोलों
फ़ीनोलों को भी हाइड्रॉक्सिल समूह की संख्या के अुनसार मोनो, डाई एवं ट्राई हाइड्रिक में वर्गीकृत किया जाता है। फ़ीनॉल
फ़ीनॉल-
मोनोहाइड्रिक
मोनोहाइड्रिक
डाइहाइड्रिक
ट्राइहाइड्रिक
7.1.3 ईथर
ईथरों में यदि ऑक्सीजन परमाणु से जुड़े दोनों ऐल्किल अथवा ऐरिल समूह एक समान हों तो उन्हें सरल अथवा सममित ईथर और यदि ये दोनों समूह भिन्न-भिन्न हों तो इन्हें मिश्रित अथवा असममित ईथर में वर्गीकृत करते हैं।
7.2 नामपद्धति
(क) ऐल्कोहॉल
ऐल्कोहॉल के सामान्य नाम को व्युत्पन्न करने के लिए, हाइड्रॉक्सिल समूह से जुड़े ऐल्किल समूह के सामान्य नाम के साथ ऐल्कोहॉल शब्द जोड़ा जाता है। उदाहरणार्थ,
पॉलिहाइड्रिक ऐल्कोहॉलों का नामकरण करने के लिए ऐल्केन के अंग्रेज़ी के नाम का अंतिम
सारणी 7.1 - कुछ ऐल्कोहॉलों के सामान्य तथा आईयूपीएसी नाम
| यौगिक | सामान्य नाम | आईयूपीएसी (IUPAC) नाम |
|---|---|---|
| मेथिल | मेथेनॉल | |
| प्रोपेन - 1- ऑल | ||
| आइसोप्रोपिल ऐल | प्रोपेन -2- ऑल | |
| ब्यूटेन -1- ऑल | ||
| द्वितीयक-ब्यूटिल ऐल्कोहॉल | ब्यूटेन -2- ऑल | |
| आइसोब्यूटिल ऐल्कोहॉल | 2- मेथिलप्रोपेन-1-ऑल | |
| तृतीयक-ब्यूटिल ऐल्कोहॉल | 2- मेथिलप्रोपेन-2-ऑल | |
| इथलीन ग्लाईकाल | एथेन- 1,2 ,-डाइऑल | |
| ग्लिसरॉल | प्रोपेन |
चक्रीय ऐल्कोहॉलों का नामकरण पूर्वलग्न साइक्लो लगाकर तथा
साइक्लोहेक्सेनॉल
2-मेथिलसाइक्लोपेन्टेनॉल
( ख) फ़ीनॉल
बेन्जीन का सबसे सरलतम हाइड्रॉक्सिल व्युत्पन्न फ़ीनॉल है। यह इसका सामान्य नाम तथा आईयूपीएसी द्वारा अनुमत नाम भी है। चूँकि फ़ीनॉल की संरचना में बेन्जीन वलय होती है अतः इसके प्रतिस्थापित यौगिकों में ऑर्थो ( 1,2 द्विप्रतिस्थापित), मेटा ( 1,3 द्विप्रतिस्थापित) तथा पैरा ( 1,4 द्विप्रतिस्थापित) भी प्रायः सामान्य नाम में प्रयुक्त होते हैं।
सामान्य नाम आईयूपीएसी नाम
सामान्य नाम आईयूपीएसी नाम
फ़ीनॉल फ़ीनॉल
2-मेथिल फ़ीनॉल
3-मेथिल फ़ीनॉल
4-मेथिल फ़ीनॉल
बेन्जीन के डाइहाइड्रॉक्सी व्युत्पन्नों को बेन्जीन
कैटेकोल
बेन्जीन 1,2 - डाइऑल
रिसॉर्सिनॉल
बेन्जीन 1,3- डाइऑल
हाइड्रोक्विनोन अथवा क्विनॉल
बेन्जीन 1,4- डाइऑल
( ग ) ईथर
ईथरों के साधारण नाम की व्युत्पत्ति के लिए ऐल्किल अथवा ऐरिल समूहों के नामों को अग्रेज़ी वर्णमाला के वर्णात्मक (alphabatical) क्रम में अलग-अलग लिखकर अंत में ‘ईथर’ शब्द लिखा जाता है।
उदाहरण के लिए
आईयूपीएसी नामपद्धति में, ईथरों को हाइड्रोकार्बनों का व्युत्पन्न माना जाता है जिनके हाइड्रोजन परमाणु
सारणी 7.2 - कुछ ईथरों के साधारण तथा आईयूपीएसी नाम
| यौगिक | साधारण नाम | आईयूपीएसी नाम |
|---|---|---|
| डाइमेथिल ईथर | मेथॉक्सीमेथेन | |
| डाइएथिल ईथर | एथॉक्सीएथेन | |
| मेथिल n-प्रोपिल ईथर | 1-मेथॉक्सीप्रोपेन | |
| मेथिल फ़ेनिल ईथर ( ऐनिसोल) | मेथॉक्सीबेन्जीन ( ऐनिसोल ) | |
| एथिल फ़ेनिल ईथर (फ़ेनीटॉल) | एथॉक्सीबेन्जीन | |
| हेप्टिल फ़ेनिल ईथर | 1-फ़ीनॉक्सी हेप्टेन | |
| मेथिल आइसोप्रोपिल ईथर | 2-मेथॉक्सीप्रोपेन | |
| फ़ेनिल आइसोपेन्टिल ईथर | 3-मेथिल ब्यूटॉ | |
| - | 1,2 -ड | |
| - | 2 - एथॉक्सी-1,1-डाइमेथिल साइक्लोहेक्सेन |
7.3 प्रकार्यात्मक समूहों की संरचनाएँ
ऐल्कोहॉलों में -

चित्र 7.1 - मेथेनॉल, फ़ीनॉल तथा मेथॉक्सीमेथेन की संरचनाएँ

फ़ीनॉल

ऐल्कोहॉलों में आबंध कोण चतुष्फलकीय कोण
ईथरों में ऑक्सीजन पर उपस्थित चार इलेक्ट्रॉन युगल यानी कि दो आबंधी इलेक्ट्रॉन युगल और दो अनाबंधित इलेक्ट्रॉन युगल, लगभग चतुष्फलकीय रूप में व्यवस्थित होते हैं। दो स्थूल
7.4 डेल्कोहॉलों और फ़ीनॉलों का विरचन
ऐल्कोहॉलों को निम्नलिखित विधियों द्वारा विरचित किया जाता है-
1. ऐल्कीनो से
7.4.1 ऐल्कोहॉलों का विरचन
(i) अम्ल उत्प्रेरित जलयोजन द्वारा— ऐल्कीन तनु अम्ल की उत्प्रेरकों की तरह उपस्थिति में जल के साथ अभिक्रिया करके ऐल्कोहॉल बनाती हैं। असममित ऐल्कीनों में योगज अभिक्रिया मार्कोनीकॉफ नियम के अनुसार होती है। (एकक-9, कक्षा-11)

क्रियाविधि- अभिक्रिया की क्रियाविधि में निम्नलिखित तीन चरण सम्मिलित होते हैं-
चरण 1-


चरण 2- कार्बोकैटायन पर जल का नाभिकरागी आक्रमण

चरण 3- विप्रोटोनन जिससे ऐल्कोहॉल बनता है।

(ii) हाइड्रोबोरॉनन-ऑक्सीकरण के द्वारा- डाइबोरेन
द्विक्आबंध पर बोरेन का योजन इस प्रकार होता है कि बोरॉन परमाणु, उस
तीर के निशान पर, अभिकर्मकों के नाम से पहले लिखी हुई संख्या इंगित करती है कि दूसरा अभिकर्मक तभी प्रयुक्त किया जाता है जब पहले अभिकर्मक के साथ अभिक्रिया पूर्णत: संपन्न हो जाती है।
2. कार्बोनिल यौगिकों से
(i) ऐल्डिहाइड व कीटोन के अपचयन द्वारा— ऐल्डिहाइड एवं कीटोन उत्प्रेरक की उपस्थिति में हाइड्रोजन के योजन (उत्प्रेकी हाइड्रोजनन) द्वारा संगत ऐल्कोहॉलों में अपचित हो जाते हैं। सामान्यतः सूक्ष्म विभाजित धातु, जैसे-प्लैटिन, पैलेडियम या निकैल उत्प्रेरक का कार्य करती हैं। ये ऐल्डिहाइड और कीटोनों की सोडियम बोरोहाइड्राइड

(ii) कार्बोक्सिलिक अम्लों तथा एस्टरों के अपयचन द्वारा- कार्बोक्सिलिक अम्ल लीथियम ऐलुमिनियम हाइड्राइड जैसे प्रबल अपचायक द्वारा अपचित हो जाते हैं और प्राथमिक ऐल्कोहॉलों की उत्तम लब्धि देते हैं।

(ii)

3. ग्रीन्यार अभिकर्मकों से
ग्रीन्यार अभिकर्मकों की ऐल्डिहाइड और कीटोन के साथ अभिक्रिया कराने पर ऐल्कोहॉल प्राप्त होती हैं (एकक 6 , कक्षा 12 )।
अभिक्रिया के प्रथम चरण में कार्बोनिल समूह पर ग्रीन्यार अभिकर्मक का नाभिकरागी संयोजन योगोत्पाद बनता है। योगोत्पाद के जल अपघटन से ऐल्कोहॉल प्राप्त होती है।


विभिन्न ऐल्डिहाइडों एवं कीटोनों की समग्र अभिक्रियाएं निम्नलिखित हैं-
ग्रीन्यार अभिकर्मक की मेथेनैल द्वारा अभिक्रिया से प्राथमिक ऐल्कोहॉल प्राप्त होती है, अन्य ऐल्डिहाइड द्वितीयक ऐल्कोहॉल तथा कीटोन तृतीयक ऐल्कोहॉल देते हैं।

आप देख सकते हैं कि मेथेनैल के साथ प्राथमिक ऐल्कोहॉल, किसी अन्य ऐल्डिहाइड के साथ द्वितीयक ऐल्कोहॉल तथा कीटोन के साथ तृतीयक ऐल्कोहॉल प्राप्त होती हैं।
7.4 .2 फ़ीनॉलों का विरचन
फ़ीनॉल, जिसे कार्बोलिक अम्ल भी कहते हैं, का पथक्करण सर्वप्रथम उन्नीसवीं शताब्दी के प्रारंभ में कोलतार से किया गया था। आजकल फ़ीनॉल का औद्योगिक उत्पादन संश्लेषण द्वारा किया जाता है। प्रयोगशाला में फ़ीनॉल को बेन्जीन के व्युत्पन्नों से निम्नलिखित में से किसी भी विधि से प्राप्त किया जा सकता है-
1. हैलोऐरीनों से
क्लोरोबेन्जीन को

2. बेन्जीन सल्फोनिक अम्लों से
बेन्जीन का ओलियम द्वारा सल्फोनेशन किया जाता है तथा इससे प्राप्त सल्फोनिक अम्ल को गलित सोडियम हाइड्रॉक्साइड के साथ गरम करके सोडियम फ़ीनॉक्साइड में परिवर्तित कर लिया जाता है। सोडियम लवण के अम्लन से फ़ीनॉल प्राप्त हो जाती है।

3. डाइऐज़ोनियम लवणों से
प्राथमिक ऐरोमैटिक ऐमीन की

विश्व में फ़ीनॉल का अधिकतर उत्पादन क्यूमीन से किया जाता है।
4. क्यूमीन से
फ़ीनॉल का उत्पादन हाइड्रोकार्बन क्यूमीन से किया जाता है। क्यूमीन (आइसोप्रोपिल बेन्जीन) को वायु की उपस्थिति में क्यूमीन हाइड्रोपरऑक्साइड में ऑक्सीकृत कर लिया जाता है। तनु अम्ल के साथ क्रिया द्वारा इसे फ़ीनॉल तथा ऐसीटोन में परिवर्तित किया जाता है। इस विधि से उत्पादन में इस अभिक्रिया का उपोत्पाद ऐसीटोन भी अधिक मात्रा में प्राप्त होता है।

7.4.3 भौतिक गुणधर्म
ऐल्कोहॉलों एवं फ़ीनॉलों के दो भाग होते हैं- एक ऐल्किल/ऐरिल समूह तथा दूसरा हाइड्रॉक्सिल समूह। ऐल्कोहॉलों एवं फ़ीनॉलों के गुणधर्म मुख्यतः
क्वथनांक
ऐल्कोहॉलों और फ़ीनॉलों के क्वथनांक कार्बन परमाणुओं की संख्या में वृद्धि के साथ (वांडरवाल्स बलों में वृद्धि) बढ़ते हैं। ऐल्कोहॉलों में, शाखन के बढ़ने के साथ-साथ (पृष्ठ क्षेत्रफल घटने से वांडरवाल बलों में कमी के कारण) क्वथनांक कम हो जाते हैं।
ऐल्कोहॉलों और फ़ीनॉलों में -
यह रोचक तथ्य है कि लगभग समान आण्विक द्रव्यमान वाले अन्य वर्गों के यौगिकों यानी कि हाइड्रोकार्बनों, ईथरों और हैलोऐल्केनों हैलोऐरीनो के यौगिकों की तुलना में ऐल्कोहॉलों तथा फ़ीनॉलों के क्वथनांक उच्चतर होते हैं। उदाहरणार्थ, एथेनॉल तथा प्रोपेन के आण्विक द्रव्यमान समतुल्य हैं किंतु इनके क्वथनांकों में काफ़ी अंतर है, मेथॉक्सीमेथेन का क्वथनांक इन दोनों के क्वथनांकों के मध्यवर्ती होता है।

आण्विक द्रव्यमान/क्वथनांक
आण्विक द्रव्यमान/क्वथनांक

आण्विक द्रव्यमान/क्वथनांक
ऐल्कोहॉलों के उच्च क्वथनांक मुख्यतः अंतराआण्विक हाइड्रोजन आबंध की उपस्थिति के कारण होते हैं जिसका ईथरों एवं हाइड्रोकार्बनों में अभाव है।
विलेयता
ऐल्कोहॉलों और फ़ीनॉलों की जल में विलेयता उनकी जल के अणुओं के साथ हाइड्रोजन आबंध बनाने की क्षमता के कारण होती है, जैसा कि चित्र में दिखाया गया है। यह विलेयता ऐल्किल/ऐरिल (जलविरागी) समूहों के आकार बढ़ने के साथ घटती है। अधिकांश निम्न आण्विक द्रव्यमान वाले ऐल्कोहॉल जल में सभी अनुपातों में मिश्रणीय होते हैं।
7.4.4 रासायनिक अभिक्रियाएँ
( ऐल्कोहॉल नाभिकरागी के रूप में) ऐल्कोहॉल सर्वतोमुखी यौगिक हैं। ये नाभिकरागी (nucleophile) एवं इलेक्ट्रॉनरागी (electrophiles) दोनों के रूप में अभिक्रिया करती हैं।
(i) जब ऐल्कोहॉल नाभिकरागी के रूप में अभिक्रिया करती हैं तो

(ii) जब ऐल्कोहॉल इलेक्टॉनरागी के रूप में अभिक्रिया करती है तो
( प्रोटॉनित ऐल्कोहॉल इलेक्ट्रानरागी के रूप में)

(क) अभिक्रियाएँ जिनमें
1. ऐल्कोहॉलों एवं फ़ीनॉलों की अम्लता
(i) धातुओं के साथ अभिक्रियाएँ- ऐल्कोहॉल और फ़ीनॉल सक्रिय धातुओं, जैसे- सोडियम, पोटैशियम तथा ऐलुमिनियम के साथ अभिक्रिया करके संगत ऐल्कॉक्साइड/फ़ीनॉक्साइड एवं हाइड्रोजन देती हैं।

इसके अतिरिक्त फ़ीनॉल जलीय सोडियम हाइड्रॉक्साइड के साथ अभिक्रिया द्वारा सोडियम फ़ीनॉक्साइड बनाती हैं।
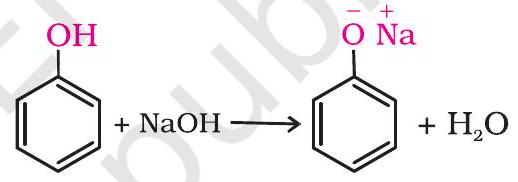
उपरोक्त अभिक्रियाएं दर्शाती हैं कि ऐल्कोहॉल एवं फ़ीनॉल अम्लीय प्रकृति की होती हैं। वास्तव में, ऐल्कोहॉल एवं फ़ीनॉल ब्रंसटेद अम्ल है अर्थात् वे किसी प्रबल क्षारक (B:) को प्रोटॉन प्रदान कर सकती हैं।

(ii) ऐल्कोहॉलों की अम्लता- ऐल्कोहॉलों की अम्लीय प्रकृति ध्रुवीय

ऐल्कोहॉल जल की अपेक्षा दुर्बल अम्ल होती हैं। जल की ऐल्कॉक्साइड से अभिक्रिया कराने पर यह स्पष्ट हो जाता है।

यह अभिक्रिया प्रदर्शित करती है कि ऐल्कोहॉल की अपेक्षा जल एक बेहतर प्रोटॉन दाता है। (यानी कि प्रबलतर अम्ल), उपरोक्त अभिक्रिया में हम यह भी देख सकते हैं कि एक ऐल्कॉक्साइड आयन हाइड्रॉक्साइड आयन की अपेक्षा एक बेहतर प्रोटॉनग्राही होता है। जो यह संकेत देता है कि ऐल्कॉक्साइड प्रबलतर क्षारक होते हैं। (सोडियम एथॉक्साइड, सोडियम हाइड्रॉक्साइड से अधिक क्षारीय होता है।)
ऐल्कोहॉल भी ब्रंसटेद क्षारकों की भाँति कार्य करते हैं। ऐसा ऑक्सीजन पर उपस्थित असहभाजित इलेक्ट्रॉन युगलों के कारण होता है जो इन्हें प्रोटॉनग्राही बनाते हैं।
(iii) फ़्रीनॉलों की अम्लता- फ़ीनॉल की धातुओं (उदाहरणार्थ; सोडियम तथा ऐलुमिनियम) तथा सोडियम हाइड्रॉक्साइड के साथ अभिक्रियाएं इसकी अम्लीय प्रकृति को दर्शाती हैं। फ़ीनॉल में हाइड्रॉक्सिल समूह बेन्जीन वलय के

फ़ीनॉल की जलीय सोडियम हाइड्रॉक्साइड के साथ अभिक्रिया यह इंगित करती है कि फ़ीनॉल, ऐल्कोहॉलों तथा जल की अपेक्षा अधिक प्रबल अम्ल होती हैं। आइए, यह जाँचें कि ऐरोमैटिक वलय से जुड़ा हाइड्रॉक्सिल समूह, ऐल्किल समूह से जुड़े हाइड्रॉक्सिल समूह की अपेक्षा अधिक अम्लीय कैसे हो जाता है।
किसी ऐल्कोहॉल तथा फ़ीनॉल का आयनन निम्नलिखित प्रकार से होता है।
फ़ीनॉल में -

प्रतिस्थापित फ़ीनॉलों में नाइट्रो समूह जैसे इलेक्ट्रॉन अपनयक (प्रत्याहार्य) समूह, फ़ीनॉल की अम्लीय सामर्थ्य को बढ़ा देते हैं। जब ऐसे समूह ऑर्थो एवं पैरा स्थितियों पर उपस्थित होते हैं तो यह प्रभाव अधिक प्रबल हो जाता है। इसका कारण फ़ीनॉक्साइड आयन के आर्थो एवं पैरा स्थान पर के ऋणावेश का प्रभावी विस्थानन होता है। दूसरी ओर ऐल्किल समूह जैसे इलेक्ट्रॉन विमोचक (दाता) समूह सामान्य रूप से फ़ीनॉक्साइड आयन के बनने में सहायक नहीं होते, परिणामस्वरूप अम्ल सामर्थ्य में कमी आ जाती है। उदाहरणार्थ; फ़ीनॉल की अपेक्षा क्रीसॉल कम अम्लीय होते हैं।
सारणी 7.3- कुछ फ़ीनॉलों और ऐथेनॉल के
| यौगिक | सूत्र | |
|---|---|---|
| 7.2 | ||
| 8.3 | ||
| 7.1 | ||
| फ़ीनॉल | 10.0 | |
| 10.2 | ||
| 10.1 | ||
| 10.2 | ||
| एथेनॉल | 15.9 |
उपरोक्त आँकड़ों के आधार पर आप देखेंगे कि फ़ीनॉल एथेनॉल की तुलना में दस लाख गुना अधिक अम्लीय है।
2. एस्टरीकरण
ऐल्कोहॉल एवं फ़ीनॉल कार्बाक्सिलिक अम्लों, अम्ल क्लोराइडों एवं अम्ल ऐनहाइड्राइडों के साथ अभिक्रिया द्वारा एस्टर बनाती हैं।
ऐस्पिरिन, पीड़ाहारी, शोथनाशी एवं ज्वरनाशी गुणधर्म वाली होती है।
कार्बाक्सिलिक अम्ल तथा अम्ल ऐनहाइड्राइड की अभिक्रिया सांद्र सल्फ्यूरिक अम्ल की कुछ मात्रा की उपस्थिति में संपन्न होती है। यह अभिक्रिया उत्क्रमणीय होती है, अतः इसमें बने जल को तुरंत निष्कासित कर दिया जाता है। अम्ल क्लोराइड के साथ अभिक्रिया क्षारक
(पिरिडीन) की उपस्थिति में की जाती है जिससे कि अभिक्रिया से बने

(ख) अभिक्रियाएँ जिनमें कार्बन-ऑक्सीजन (C-O) आबंध का विदलन (Cleavage) होता है
1. हाइड्रोजन हैलाइडों के साथ अभिक्रिया
ऐल्कोहॉल, हाइड्रोजन हैलाइडों के साथ अभिक्रिया करके ऐल्किल हैलाइड बनाती हैं (देखिए- एकक 6, कक्षा 12)
इन तीनों वर्गों की ऐल्कोहॉलों की
2. फॉस्फोरस ट्राइहैलाइडों के साथ अभिक्रिया
फ़ॉस्फ़ोरस ट्राइब्रोमाइड के साथ अभिक्रिया करने पर ऐल्कोहॉल, ऐल्किल ब्रोमाइड में परिवर्तित हो जाती है (देखिए- एकक 6 , कक्षा 12)।
3. निर्जलन
ऐल्कोहॉल के सांद्र

तृतीयक कार्बोकैटायन अधिक स्थायी होते हैं, अतः द्वितीयक एवं तृतीयक कार्बोकैटायनों की अपेक्षा आसानी से बनते हैं। तृतीयक ऐल्कोहॉलों का निर्जलन करना सबसे अधिक आसान है।
द्वितीयक तथा तृतीयक ऐल्कोहॉलों का निर्जलन अपेक्षाकृत मध्यम परिस्थितियों में किया जाता है। उदाहरणार्थ-
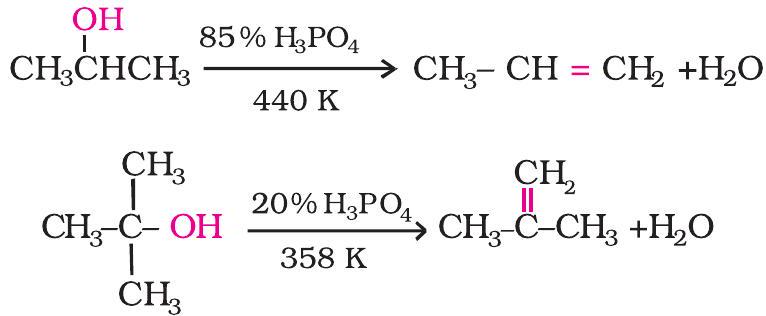
ऐल्कोहॉलों के सापेक्षिक निर्जलन की सुगमता का क्रम इस प्रकार होता हैतृतीयक > द्वितीयक > प्राथमिक
प्रोपेन-2-ऑल के निर्जलन की क्रियाविधि में निम्नलिखित चरण होते हैं-
क्रियाविधि
चरण 1- प्रोटॉनित ऐल्कोहॉल का बनना-

चरण 2- कार्बोकैटायन का बनना-
यह सबसे धीमा चरण है अतः यह अभिक्रिया का दर निर्धारक चरण होता है।
चरण 3- प्रोटॉन के निकल जाने से प्रोपीन का बनना-

चरण 1 में प्रयुक्त अम्ल, अभिक्रिया के चरण 3 में मुक्त हो जाता है। साम्य को दाईं ओर विस्थापित करने के लिए, प्रोपीन बनते ही निष्कासित कर ली जाती है।
4. ऑक्सीकरण- ऐल्कोहॉलों के ऑक्सीकरण में

आबंधों का ऐसा विदलन एवं निर्माण ऑक्सीकरण अभिक्रियाओं में होता है। इन्हें विहाइड्रोजनन अभिक्रियाएं भी कहते हैं क्योंकि इनमें ऐल्कोहॉल अणु में से डाइहाइड्रोजन अणु की कमी हो जाती है। प्रयुक्त ऑक्सीकरण कर्मक के आधार पर, प्राथमिक ऐल्कोहॉल, ऐल्डिहाइड में ऑक्सीकृत हो जाती हैं जो बाद में कार्बोक्सिलिक अम्ल में ऑक्सीकृत हो जाता है।

ऐल्कोहॉलों से सीधे कार्बोक्सिलिक अम्लों को प्राप्त करने के लिए प्रबल ऑक्सीकरण कर्मकों, जैसे अम्लीकृत पोंटैशियम परमैंगनेट का उपयोग किया जाता है। ऐल्डिहाइडों को पृथक् करने के लिए

प्राथमिक ऐल्कोहॉल के ऑक्सीकरण से ऐल्डिहाइड की अच्छी लब्धि प्राप्त करने के लिए पिरिडीनियम क्लोरोक्रोमेट (PCC) श्रेष्ठ अभिकर्मक है जो कि क्रोमियम ट्राइऑक्साइड का पिरिडीन व

द्वितीयक ऐल्कोहॉल क्रोमिक ऐनहाइड्राइड

तृतीयक ऐल्कोहॉल ऑक्सीकरण अभिक्रिया नहीं करते। प्रबल अभिक्रिया परिस्थितियों, जैसे- प्रबल आक्सीकरण कर्मकों
जब प्राथमिक अथवा द्वितीयक ऐल्कोहॉल के वाष्पों को
मेथेनॉल एवं एथेनॉल के जैविक ऑक्सीकरण से शरीर में संगत ऐल्डिहाइड बनते हैं, तत्पश्चात् अम्ल बनते हैं। कभी-कभी मद्यव्यसनी गलती से मेथेनॉल मिश्रित ऐथेनॉल जिसे विगुणित ऐल्कोहॉल भी कहते हैं, पी लेते हैं। शरीर में मेथेनॉल पहले मेथेनैल में ऑक्सीकृत होती है; तत्पश्चात् मेथेनॉइक अम्ल में, जो कि अन्धता एवं मृत्यु का कारण बन सकता है। मेथेनॉल की विषाक्तता के रोगी का उपचार तनुकृत ऐथेनॉल को अंतः शिरा द्वारा प्रदान करके किया जाता है। ऐल्डीहाइड (HCHO) को अम्ल में ऑक्सीकृत करने के लिए उत्तरदायी एन्जाइम जल ग्रहण कर लेता है जिससे वृक्क को मेथेनॉल उत्सर्जित करने के लिए समय प्राप्त हो जाता है।
( ग ) फ़ीनॉल की अभिक्रियाएँ
निम्नलिखित अभिक्रियाएँ केवल फ़ीनालों द्वारा दर्शायी जाती हैं-
1. ऐरोमैटिक इलेक्ट्रॉनरागी प्रतिस्थापन- फ़ीनॉलों में ऐरोमैटिक वलय पर होने वाली अभिक्रियाएँ इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाएँ होती हैं। (एकक-9, कक्षा-11) बेन्जीन वलय पर जुड़ा
2,4,6-ट्राइनाइट्रोफ़ीनॉल तीन इलेक्ट्रॉन अपनयक
(i) नाइट्रोकरण
निम्न ताप

ऑर्थो एवं पैरा समावयवों को वाष्पीय आसवन द्वारा पृथक् किया जा सकता है। आंतरआण्विक हाइड्रोजन आबंध के कारण ऑर्थो-नाइट्रोफ़ीनॉल भाप द्वारा वाष्पित होती है जबकि पैरा-नाइट्रोफ़ीनॉल कम वाष्पशील होती है क्योंकि इसमें अंतराआण्विक हाइड्रोजन आबंध विद्यमान होता है, जिससे अणु संगुणित हो जाते हैं।
(आंतरआण्विकहाइड्रोजन आबंध)
(अंतराआण्विकहाइड्रोजन आबंध)
सांद्र नाइट्रिक अम्ल के साथ फ़ीनॉल

आजकल पिक्रिक अम्ल को बनाने के लिए सर्वप्रथम फ़ीनॉल की अभिक्रिया सांद्र
क्या आप इसमें सम्मिलित अभिक्रियाओं का समीकरण लिख सकते हैं?
(ii) हैलोजनन
फ़ीनॉल की ब्रोमीन के साथ अभिक्रिया द्वारा अलग-अलग प्रायोगिक अवस्थाओं में अलग-अलग उत्पाद प्राप्त होते हैं।
(क) जब

बेन्जीन का सामान्य हैलोजनन
(ख) जब फ़ीनॉल की अभिक्रिया ब्रोमीन जल के साथ की जाती है तो

2,4,6- ट्राइब्रोमोफ़ीनॉल
2. कोल्बे अभिक्रिया
फ़ीनॉल को सोडियम हाइड्रॉक्साइड के साथ अभिकृत कराने से बना फ़ीनॉक्साइड आयन, फ़ीनॉल की अपेक्षा इलेक्ट्रॉनरागी ऐरोमैटिक प्रतिस्थापन अभिक्रिया के प्रति अधिक क्रियाशील होता है। अतः यह

3. राइमर-टीमन अभिक्रिया
फ़ीनॉल की सोडियम हाइड्रॉक्साइड की उपस्थिति में क्लोरोफ़ार्म के साथ अभिक्रिया से बेन्जीन में,
प्रतिस्थापित मध्यवर्ती बेन्ज़िल क्लोराइड क्षार की उपस्थिति में अपघटित होकर सैलिसैल्डिहाइड बनाता है।

सैलिसैल्डिहाइड
4. फ्रीनॉल की यशदरज के साथ अभिक्रिया
यशदरज के साथ गरम करने पर फ़ीनॉल बेन्जीन में परिवर्तित हो जाती है।

5. आक्सीकरण
फ़ीनॉल के क्रोमिक अम्ल द्वारा आक्सीकरण से संयुग्मित डाइकीटोन बनता है जिसे बेन्ज्रोक्विनोन कहते हैं। वायु की उपस्थिति में फ़ीनॉल धीरे-धीरे गहरे रंग के क्विनोनों के मिश्रण में ऑक्सीकृत हो जाते हैं।
महत्व के कुछ डेल्कोहॉल एथेनॉल के सेवन का प्रभाव केंद्रीय तंत्रिका तंत्र पर पड़ता है। मध्यम मात्रा में यह निर्णय क्षमता पर प्रभाव डालती है तथा अंतर्बाधा को कम करती है। अधिक सांद्रता मितली और बेहोशी लाती है। उच्च सांद्रताओं में यह स्वतः श्वसन क्रिया में भी बाधा डालती है और प्राणघातक हो सकती है।
7.5 औद्योगिक मेथेनॉल एवं एथेनॉल दो औद्योगिक महत्व की ऐल्कोहॉल हैं।
1. मेथेनॉल
मेथेनॉल,
मेथेनॉल एक रंगहीन द्रव है, जिसका क्वथनांक
2. एथेनॉल
ऐथेनॉल
शराब बनाने के लिए अंगूर शर्करा (द्राक्ष-शर्करा) तथा यीस्ट का स्रोत होते हैं। जब अंगूर पक जाते हैं तो उनमें शर्करा की मात्रा बढ़ जाती है तथा उनकी ऊपरी सतह पर यीस्ट उत्पन्न हो जाती है। जब अंगूरों को कुचला जाता है तो शर्करा एवं एन्जाइम संपर्क में आते हैं तथा किण्वन आरंभ हो जाता है। किण्वन अवायवीय स्थितियों यानी कि वायु की अनुपस्थिति में होता है। किण्वन में कार्बनडाइऑक्साइड निर्मुक्त होती है।
उत्पन्न ऐल्कोहॉल की मात्रा
एथेनॉल एक रंगहीन द्रव है, जिसका क्वथनांक
7.6 ईथर
7.6.1 ईथरों का विरचन
डाइएथिल ईथर का उपयोग अंतःश्वसन निश्चेतक के रूप में होता रहा है। परंतु इसके धीमे असर एवं अप्रिय स्वास्थ्यलाभ समय के कारण, इसका प्रतिस्थापन दूसरे यौगिकों द्वारा कर दिया गया है।
ऐलेक्ज़ेंडर विलियम विलियम्सन (1824-1904) का जन्म लंदन में स्कॉट परिवार में हुआ। वह 1849 में यूनिवर्सिटी कॉलेज, लंदन में प्रोफ़ेसर नियुक्त हुए।
1. ऐल्कोहॉलों के निर्जलन द्वारा
प्रोटिक अम्लों
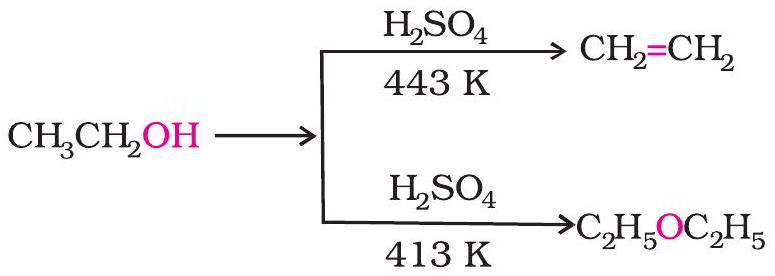
ईथर का विरचन एक द्विअणुक नाभिकरागी प्रतिस्थापन अभिक्रिया
(i)

(ii)

ऐल्कोहॉलों का अम्लीय निर्जलन, जिसमें ऐल्कीन बनती है, एक प्रतिस्थापन अभिक्रिया से भी संबंधित है जो ईथर देती है।
यह विधि केवल प्राथमिक ऐल्किल समूह युक्त ईथरों के विरचन के लिए ही उपयुक्त होती है। ऐल्किल समूह अबाधित तथा तापक्रम निम्न होना चाहिए अन्यथा अभिक्रिया ऐल्कीन के बनने में सहायक होगी। जब ऐल्कोहॉल द्वितीयक या तृतीयक होती है तो अभिक्रिया
क्या आप समझा सकते हैं कि द्विअणुक निर्जलन, एथिल मेथिल ईथर के विरचन के लिए उपयुक्त क्यों नहीं है?
2. विलियम्सन संश्लेषण
यह सममित और असममित ईथरों को बनाने की एक महत्वपूर्ण प्रयोगशाला विधि है। इस विधि में, ऐल्किल हैलाइड की सोडियम ऐल्कॉक्साइड के साथ अभिक्रिया कराई जाती है।
प्रतिस्थापित (द्वितीयक अथवा तृतीयक) ऐल्किल समूह युक्त ईथर भी इस विधि द्वारा बनाई जा सकती हैं। इस अभिक्रिया में प्राथमिक ऐल्किल हैलाइड पर ऐल्कॉक्साइड आयन का

अगर ऐल्किल हैलाइड प्राथमिक होता है तो अच्छे परिणाम प्राप्त होते हैं। द्वितीयक एवं तृतीयक ऐल्किल हैलाइडों की अभिक्रिया में विलोपन, प्रतिस्पर्धा में प्रतिस्थापन से आगे होता है। यदि तृतीयक ऐल्किल हैलाइड का उपयोग किया जाए तो उत्पाद के रूप में केवल ऐल्कीन प्राप्त होती है एवं कोई ईथर नहीं बनती। उदाहरणार्थ;
2-मेथिलप्रोपीन
ऐसा इसलिए होता है क्योंकि ऐल्कॉक्साइड न केवल नाभिकरागी होते हैं अपितु प्रबल
क्षारक भी होते हैं। वे ऐल्किल हैलाइडों के साथ विलोपन अभिक्रिया करते हैं। इस विधि से फ़ीनॉलों को भी ईथरों में परिवर्तित किया जाता है। इसमें फ़ीनॉल का उपयोग फ़ीनाक्सॉइड अर्धांश (Moiety) के रूप में होता है।

7.6.2 भौतिक गुणधर्म
ईथर में
| सूत्र | |||
|---|---|---|---|
| एथॉक्सीएथेन | ब्यूटेन-1-ऑल | ||
| क्वथनांक/ |
309.1 | 307.6 | 390 |
ऐल्कोहॉलों एवं ईथरों के क्वथनांकों में अधिक अंतर का कारण ऐल्कोहॉलों में हाइड्रोजन आबंधों की उपस्थिति है।
ईथरों की जल में मिश्रणीयता, समान आण्विक द्रव्यमान वाले ऐल्कोहॉलों से सदृश्य होती है। एथॉक्सीएथेन एवं ब्यूटेन-1-ऑल दोनों ही जल में लगभग समान रूप से मिश्रणीय होते हैं अर्थात्
1. ईथरों में
ईथर प्रकार्यात्मक समूहों में सबसे कम अभिक्रियाशील होती हैं। ईथरों के
7.6.3 रासायनिक अभिक्रियाएँ
ऐरिल-ऑक्सीजन आबंध के अधिक स्थायी होने के कारण ऐल्किल ऐरिल ईथर का ऐल्किल-ऑक्सीजन आबंध विदलित होता है। इस अभिक्रिया से फ़ीनॉल एवं ऐल्किल हैलाइड प्राप्त होते हैं।

दो विभिन्न ऐल्किल समूहों वाली ईथर भी इसी प्रकार से विदलित होती हैं।
हाइड्रोजन हैलाइडों की अभिक्रियाशीलता का क्रम इस प्रकार होता है-
क्रियाविधि
ईथर की सांद्र
चरण-1

अभिक्रिया
चरण-2
आयोडाइड एक अच्छा नाभिकरागी है। यह पद 1 से प्राप्त ऑक्सोनियम आयन के अल्पतम प्रतिस्थापित कार्बन पर आक्रमण करता है और
अतः दो भिन्न ऐल्किल समूह युक्त मिश्रित ईथर के विदलन से बनने वाली ऐल्कोहॉल तथा ऐल्किल आयोडाइड कौन से होंगे यह ऐल्किल समूहों की प्रकृति पर निर्भर करता है। जब प्राथमिक अथवा द्वितीयक ऐल्किल समूह उपस्थित होते हैं तो निम्नतर ऐल्किल समूह ऐल्किल आयोडाइड

जब
चरण-3

इसका कारण अभिक्रिया के चरण 2 में निष्कासित होने वाले 
ऐनिसोल में ईथर के प्रोटॉनन द्वारा मेथिलफेनिल ऑक्सोनियम आयन
2. इलेक्ट्रॉनरागी प्रतिस्थापन
ऐल्कॉक्सी समूह (-OR) ऑर्थो एवं पैरा निर्देशक होता है तथा यह फ़ीनॉल के
 (i) हैलोजनन- फ़ेनिलऐल्किल ईथर, बेन्जीन वलय में सामान्य हैलोजनन अभिक्रियाएं देता है। उदाहरणार्थ; ऐनिसोल का ब्रोमीनन, एथेनॉइक अम्ल में घुली ब्रोमीन द्वारा, आयरन (III) ब्रोमाइड उत्प्रेरक की अनुपस्थिति में भी होता है। ऐसा मेथॉक्सी समूह द्वारा बेन्जीन वलय के सक्रिमण के कारण होता है। इसमें पैरा समावयवी की लब्धि
(i) हैलोजनन- फ़ेनिलऐल्किल ईथर, बेन्जीन वलय में सामान्य हैलोजनन अभिक्रियाएं देता है। उदाहरणार्थ; ऐनिसोल का ब्रोमीनन, एथेनॉइक अम्ल में घुली ब्रोमीन द्वारा, आयरन (III) ब्रोमाइड उत्प्रेरक की अनुपस्थिति में भी होता है। ऐसा मेथॉक्सी समूह द्वारा बेन्जीन वलय के सक्रिमण के कारण होता है। इसमें पैरा समावयवी की लब्धि

(ii) फ्रीडेल क्राफ्ट अभिक्रिया- ऐनिसोल फ्रीडेल-क्राफ्ट अभिक्रिया देता है ऐलुमीनियम क्लोराइड (एक लुईस अम्ल) उत्प्रेरक की उपस्थिति में ऐल्किल हैलाइड तथा ऐसिल हैलाइड की अभिक्रिया द्वारा ऐल्किल तथा ऐसिल समूह ऑर्थो तथा पैरा स्थितियों पर प्रवेश करते हैं।
(अल्प)
4 -मेथॉक्सीटॉलूईन ( मुख्य)

(iii) नाइट्रोकरण— ऐनिसोल, सांद्र

सारांश
ऐल्कोहॉलों एवं फ़ीनॉलों का वर्गीकरण- (i) हाइड्रॉक्सिल समूहों की संख्या व (ii) कार्बन परमाणु के
ऐल्कोहॉलों को निम्नलिखित विधियों द्वारा बनाया जा सकता है-
(1) ऐल्कीनों के जलयोजन से- (i) अम्ल की उपस्थिति में तथा (ii) हाइड्रोबोरॉनन-आक्सीकरण अभिक्रिया द्वारा
(2) कार्बोनिल यौगिकों से- (i) उत्प्रेकी अपयचन तथा (ii) ग्रीन्यार अभिकर्मक की क्रिया द्वारा
फ़ीनॉलों को निम्नलिखित विधियों द्वारा बनाया जा सकता है-
(1)
(2) डाइऐज़ोनियम लवणों के जलअपघटन द्वारा।
(3) क्यूमीन से औद्योगिक उत्पादन द्वारा।
लगभग तुल्य द्रव्यमान वाले अन्य वर्गों, जैसे- हाइड्रोकार्बनों, ईथरों तथा हैलोऐल्केनों के यौगिकों की तुलना में ऐल्कोहॉलों के क्वथनांक अधिक होते हैं। ऐल्कोहॉलों, फ़ीनॉलों एवं ईथरों की जल के साथ अंतराआण्विक हाइड्रोजन आबंध बनाने की क्षमता के कारण यह जल में घुलनशील होती हैं।
ऐल्कोहॉल एवं फ़ीनॉल अम्लीय प्रकृति की होती हैं। फ़ीनॉलों में इलेक्ट्रॉन अपनयक समह इनकी अम्ल प्रबलता को बढ़ाते हैं तथा इलेक्ट्रॉन दाता ( विमोचक ) समूह अम्ल प्रबलता को कम करते हैं।
ऐल्कोहॉल हाइड्रोजन हैलाइडों के साथ नाभिकरागी प्रतिस्थापन द्वारा ऐल्किल हैलाइड प्रदान करते हैं। ऐल्कोहॉलों का निर्जलन
ऐल्कीन देता है। दुर्बल ऑक्सीकारकों द्वारा प्राथमिक ऐल्कोहॉल ऑक्सीकृत होकर ऐल्डिहाइड प्रदान करते हैं तथा प्रबल ऑक्सीकारकों द्वारा कार्बोक्सिलिक अम्ल प्राप्त होते हैं। जबकि द्वितीयक ऐल्कोहॉल कीटोन देते हैं। तृतीयक ऐल्कोहॉल ऑक्सीकरण प्रतिरोधी होते हैं।
फ़ीनॉलों में,
ईथरों को- (i) ऐल्कोहॉलों के निर्जलन तथा (ii) विलियम्सन संश्लेषण विधि द्वारा बनाया जाता है।
ईथरों के क्वथनांक ऐल्केनों से मिलते-जुलते होते हैं। जबकि इनकी विलेयता समान आण्विक द्रव्यमान वाले ऐल्कोहॉलों से तुल्य होती हैं। ईथरों के










