अध्याय 04 कार्बन एवं उसके यौगिक
पिछले अध्याय में हमने अनेक ऐसे यौगिकों का अध्ययन किया है, जो हमारे लिए महत्वपूर्ण हैं। इस अध्याय में हम कुछ अन्य रोचक यौगिकों एवं उनके गुणधर्मों के बारे में पढ़ेंगे। यहाँ हम एक तत्व के रूप में कार्बन का भी अध्ययन करेंगे, जिसका हमारे लिए तात्विक एवं संयुक्त दोनों रूपों में अत्यधिक महत्त्व होता है।
क्रियाकलाप 4.1
- सुबह से आपने जिन वस्तुओं का उपयोग अथवा उपभोग किया हो, उनमें से दस वस्तुओं की सूची बनाइए।
- इस सूची को अपने सहपाठियों द्वारा बनाई सूची के साथ मिलाइए तथा सभी वस्तुओं को साथ में दी गई सारणी में वर्गीकृत कीजिए।
- एक से अधिक सामग्रियों से बनी वस्तुओं को सारणी के उपयुक्त स्तम्भों में रखिए।
| धातु से बनी वस्तुएँ | काँच अथवा मिट्टी से बनी वस्तुएँ | अन्य |
|---|---|---|
आपके द्वारा भरी गई उपरोक्त सारणी के अंतिम स्तंभ में आने वाली वस्तुओं पर ध्यान दीजिए। आपके शिक्षक आपको बताएँगे कि इनमें से अधिकांश वस्तुएँ कार्बन के यौगिकों से बनी हैं। इसका परीक्षण करने के लिए क्या आप कोई विधि सोच सकते हैं? कार्बन से युक्त यौगिक को जलाने पर क्या उत्पाद मिलेगा? क्या आप इसकी पुष्टि करने वाले किसी परीक्षण को जानते हैं?
आपके द्वारा सूचीबद्ध की गई भोजन, कपड़े, दवाओं, पुस्तकों आदि अनेक वस्तुएँ इस सर्वतोमुखी तत्व कार्बन पर आधारित होती हैं। इनके अतिरिक्त, सभी सजीव संरचनाएँ कार्बन पर आधारित होती हैं। भूपर्पटी तथा वायुमंडल में अत्यंत अल्प मात्रा में कार्बन उपस्थित है। भूपर्पटी में खनिजों (जैसे- कार्बोनेट, हाइड्रोजनकार्बोनेट, कोयला एवं पेट्रोलियम) के रूप में केवल
4.1 कार्बन में आबंधन-सहसंयोजी आबंध
पिछले अध्याय में हमने आयनिक यौगिकों के गुणधर्मों का अध्ययन किया। हमने देखा कि आयनिक यौगिकों के गलनांक एवं क्वथनांक उच्च होते हैं तथा ये विलयन में अथवा गलित अवस्था में विद्युत चालन करते हैं। हमने देखा कि आयनिक यौगिकों में आबंधन की प्रकृति इन गुणधर्मों की व्याख्या करती है।
जैसा कि हमने अध्याय 2 में देखा, अधिकांश कार्बन यौगिक अच्छे विद्युत चालक नहीं होते हैं। उपरोक्त यौगिकों के क्वथनांक एवं गलनांकों जो कि आयनिक यौगिकों के क्वथनांक तथा गलनांक की तुलना में काफ़ी कम है। अध्याय 3 के आँकड़ों (सारणी 4.1) के आधार पर हम इस निष्कर्ष पर पहुँच सकते हैं कि इन परमाणुओं के बीच प्रबल आकर्षण बल नहीं है। चूँकि, ये यौगिक अधिकांशतः विद्युत के कुचालक होते हैं, अतः हम इस निष्कर्ष पर पहुँच सकते हैं कि इन यौगिकों के आबंधन से किसी आयन की उत्पत्ति नहीं होती है।
सारणी 4.1 कार्बन के कुछ यौगिकों कि गलनांक एवं क्वथनांक
| यौगिक | गलनांक |
क्वथनांक |
|---|---|---|
| एसीटिक एसिड |
290 | 391 |
| क्लोरोफॉर्म |
209 | 334 |
| एथेनॉल |
156 | 351 |
| मेथेन |
90 | 111 |
कक्षा 9 में हमने विभिन्न तत्वों की संयोजन क्षमता, संयोजकता तथा इलेक्ट्रॉनों की संख्या पर इनकी निर्भरता के बारे में अध्ययन किया। अब हम कार्बन के इलेक्ट्रॉनिक विन्यास के बारे में अध्ययन करेंगे। कार्बन की परमाणु संख्या 6 है। कार्बन के विभिन्न कक्षों में इलेक्ट्रॉनों का वितरण कैसे होगा? कार्बन में कितने संयोजकता इलेक्ट्रॉन होंगे?
हम जानते हैं कि बाहरी कोश को पूरी तरह से भर देने अर्थात उत्कृष्ट गैस विन्यास को प्राप्त करने की प्रवृत्ति के आधार पर तत्वों की अभिक्रियाशीलता समझाई जाती है। आयनिक यौगिक बनाने वाले तत्व सबसे बाहरी कोश से इलेक्ट्रॉन प्राप्त करके या उनका ह्रास करके इसे प्राप्त करते हैं। कार्बन के सबसे बाहरी कोश में चार इलेक्ट्रॉन होते हैं तथा उत्कृष्ट गैस विन्यास को प्राप्त करने के लिए इसको चार इलेक्ट्रॉन प्राप्त करने या खोने की आवश्यकता होती है। यदि इन्हें इलेक्ट्रॉनों को प्राप्त करना या खोना हो तो-
(i) ये चार इलेक्ट्रॉन प्राप्त कर
(ii) ये चार इलेक्ट्रॉन खो कर
कार्बन अपने अन्य परमाणुओं अथवा अन्य तत्वों के परमाणुओं के साथ संयोजकता इलेक्ट्रॉनों की साझेदारी करके इस समस्या को सुलझा लेता है। केवल कार्बन ही नहीं बल्कि अनेक अन्य तत्व भी इसी प्रकार इलेक्ट्रॉन की साझेदारी करके अणुओं का निर्माण करते हैं। जिन इलेक्ट्रॉनों की साझेदारी की जाती है, वे दोनों परमाणुओं के बाहरी कोश के ही होते हैं, तथा इनके फलस्वरूप दोनों ही परमाणु उत्कृष्ट गैस विन्यास की स्थिति को प्राप्त करते हैं। कार्बन के यौगिकों की चर्चा करने से पहले इलेक्ट्रॉनों की साझेदारी से बने कुछ सामान्य अणुओं को समझते हैं।
इस तरह से बने अणुओं में सबसे सामान्य अणु हाइड्रोजन का है। जैसा कि आपने पहले अध्ययन किया है, हाइड्रोजन की परमाणु संख्या 1 है। अतः इसके

चित्र 4.1 साझेदारी के हाइड्रोजन का एक अणु
इलेक्ट्रॉन के सहभागी युग्म हाइड्रोजन के दो परमाणुओं के बीच सहसंयोजी एक आबंध बनाते हैं। इस आबंध को दो परमाणुओं के बीच एक रेखा के द्वारा भी व्यक्त किया जाता है, जैसा कि चित्र 4.2 में दिखाया गया है।

चित्र 4.2 हाइड्रोजन के दो परमाणुओं के बीच एकल बंध
क्लोरीन की परमाणु संख्या 17 है। इसका इलेक्ट्रॉनिक विन्यास तथा संयोजकता क्या होगी? क्लोरीन द्विपरमाणुक अणु,
ऑक्सीजन के दो परमाणुओं के बीच द्विआबंध का बनना दिखाई देता है। ऐसा इसलिए होता है, क्योंकि ऑक्सीजन के परमाणु के

चित्र 4.3 ऑक्सीजन के दो परमाणुओं के बीच दोहरा बंध
क्या अब आप जल के अणु को चित्रित कर सकते हैं, जिसमें ऑक्सीजन के एक परमाणु एवं हाइड्रोजन के दो परमाणुओं के बीच आबंधन की प्रकृति को दर्शाया गया हो? इस अणु में एक आबंध है, अथवा द्विआबंध?
नाइट्रोजन के द्विपरमाणुक अणु में कैसा आबंध होगा? नाइट्रोजन की परमाणु संख्या 7 है। इसका इलेक्ट्रॉनिक विन्यास एवं संयोजन क्षमता क्या होगी? अष्टक प्राप्त करने के लिए नाइट्रोजन के एक अणु में नाइट्रोजन का प्रत्येक परमाणु तीन इलेक्ट्रॉन देता है, जिससे इलेक्ट्रॉन के तीन सहभागी युग्म प्राप्त होते हैं। इसे दो परमाणुओं के बीच त्रिआबंध का बनना कहा जाता है।

चित्र 4.4 नाइट्रोजन के दो परमाणुओं के बीच त्रिआबंध
अमोनिया के अणु का सूत्र
अब हम मेथेन को देखते हैं, जो कार्बन का यौगिक है। ईंधन के रूप में मेथेन का अधिकाधिक उपयोग होता है तथा यह बायोगैस एवं संपीडित प्राकृतिक गैस

चित्र 4.5 मेथेन की इलेक्ट्रॉन बिंदु संरचना
इस प्रकार दो परमाणुओं के बीच इलेक्ट्रॉन के एक युग्म की साझेदारी के द्वारा बनने वाले आबंध सहसंयोजी आबंध कहलाते हैं। सहसंयोजी आबंध वाले अणुओं में भीतर तो प्रबल आबंध होता है, लेकिन इनका अंतराअणुक बल दुर्वल होता है। फलस्वरूप इन यौगिकों के क्वथनांक एवं गलनांक कम होते हैं। चूँकि, परमाणुओं के बीच इलेक्ट्रॉनों की साझेदारी होती है और आवेशित कण बनते हैं; सामान्यतः ऐसे सहसंयोजी यौगिक विद्युत के कुचालक होते हैं।
क्या आप जानते हैं?
कार्बन के अपररूप
प्रकृति में कार्बन तत्व अनेक विभिन्न भौतिक गुणों के साथ विविध रूपों में पाया जाता है। हीरा एवं ग्रेफ़ाइट दोनों ही कार्बन के परमाणुओं से बने हैं, कार्बन के परमाणुओं के परस्पर आबंधन के >तरीकों के आधार पर ही इनमें अंतर होता है। हीरे में कार्बन का प्रत्येक परमाणु कार्बन के चार अन्य परमाणुओं के साथ आबंधित होता है, जिससे एक दृढ़ त्रिआयामी संरचना बनती है। ग्रेफ़ाइट में कार्बन >के प्रत्येक परमाणु का आबंधन कार्बन के तीन अन्य परमाणुओं के साथ एक ही तल पर होता है, जिससे षट्कोणीय व्यूह मिलता है। इनमें से एक आबंध द्विआबंधी होता है, जिसके कारण कार्बन की संयोजकता पूर्ण >होती है। ग्रेफ़ाइट की संरचना में षट्कोणीय तल एक-दूसरे के ऊपर व्यवस्थित होते हैं।

हीरे की संरचना

ग्रेफ़ाइट की संरचना

C-60 बकमिंसटफुलेरीन की संरचना
इन दो विभिन्न संरचनाओं के कारण हीरे एवं ग्रेफ़ाइट के भौतिक गुणधर्म अत्यँत भिन्न होते हैं, जबकि उनके रासायनिक गुणधर्म एकसमान होते हैं। हीरा अब तक का ज्ञात सर्वाधिक कठोर पदार्थ है, जबकि ग्रेफ़ाइट चिकना तथा फिसलनशील होता है। पिछले अध्याय में आपने जिन अधातुओं के बारे में अध्ययन किया, उनके विपरीत ग्रेफ़ाइट विद्युत का सुचालक होता है।
शुद्ध कार्बन को अत्यधिक उच्च दाब एवं ताप पर उपचारित (subjecting) करके हीरे को संश्लेषित किया जा सकता है। ये संश्लिष्ट हीरे आकार में छोटे होते हैं, लेकिन अन्यथा ये प्राकृतिक हीरों से अभेदनीय होते हैं।
फुलेरीन कार्बन अपररूप का अन्य वर्ग है। सबसे पहले C-60 की पहचान की गई, जिसमें कार्बन के परमाणु फुटबॉल के रूप में व्यवस्थित होते हैं। चूँकि, यह अमेरिकी आर्किटेक्ट बकमिंसटर फ़ुलर (Buckminster Fuller) द्वारा डिज़ाइन किए गए जियोडेसिक गुंबद के समान लगते हैं, इसीलिए, इस अणु को फुलेरीन नाम दिया गया।
प्रश्न
1.
Show Answer
#missing2. सल्फ़र के आठ परमाणुओं से बने सल्फ़र के अणु की इलेक्ट्रॉन बिंदु संरचना क्या होगी? (संकेतसल्फ़र के आठ परमाणु एक अँगूठी के रूप में आपस में जुड़े होते हैं।)
Show Answer
#missing4.2 कार्बन की सर्वतोमुखी प्रकृति
विभिन्न तत्वों एवं यौगिकों में हमने इलेक्ट्रॉनों की साझेदारी द्वारा सहसंयोजी आबंध का निर्माण देखा। हमने सरल कार्बन यौगिक, मेथेन की संरचना भी देखी। अध्याय के आरंभ में हमने देखा कि कितनी वस्तुओं में कार्बन पाया जाता है। वस्तुतः हम स्वयं भी कार्बन के यौगिकों से बने हुए हैं। हाल ही में रसायनशास्त्रियों द्वारा सूत्र सहित ज्ञात कार्बन यौगिकों की गणना की गई है, जो लगभग कई मिलियन आँकी गई है। अन्य सभी तत्वों के यौगिकों को एक साथ रखने पर भी इनकी संख्या उन सबसे कहीं अधिक है। ऐसा क्यों है कि यह गुणधर्म केवल कार्बन में ही मिलता है किसी और तत्व में नहीं? सहसंयोजी बंध की प्रकृति के कारण कार्बन में बड़ी संख्या में यौगिक बनाने की क्षमता होती है। कार्बन में दो कारक देखे गए हैं-
(i) कार्बन में कार्बन के ही अन्य परमाणुओं के साथ आबंध बनाने की अद्वितीय क्षमता होती है, जिससे बड़ी संख्या मे अणु बनते हैं। इस गुण को शृंखलन (catenation) कहते हैं। इन यौगिकों में कार्बन की लंबी शृंखला, कार्बन की विभिन्न शाखाओं वाली शृंखला अथवा वलय में व्यवस्थित कार्बन भी पाए जाते हैं। साथ ही कार्बन के परमाणु एक, द्वि अथवा त्रि आबंध से जुड़े हो सकते हैं। कार्बन परमाणुओं के बीच केवल एक आबंध से जुड़े कार्बन के यौगिक संतृप्त यौगिक कहलाते हैं। द्वि अथवा त्रि-आबंध वाले कार्बन के यौगिक असंतृप्त यौगिक कहलाते हैं। कार्बन यौगिकों में जिस सीमा तक शृंखलन का गुण पाया जाता है वह किसी और तत्व में नहीं मिलता है। सिलिकॉन हाइड्रोजन के साथ यौगिक बनाते हैं, जिनमें सात या आठ परमाणुओं तक की भृंखला हो सकती है, लेकिन यह यौगिक अति अभिक्रियाशील होते हैं। कार्बन-कार्बन आबंध अत्यधिक प्रबल होता है, अतः यह स्थायी होता है। फलस्वरूप अनेक कार्बन परमाणुओं के साथ आपस में जुड़े हुए अनेक यौगिक प्राप्त होते हैं।
(ii) चूँकि, कार्बन की संयोजकता चार होती है, अतः इसमें कार्बन के चार अन्य परमाणुओं अथवा कुछ अन्य एक संयोजक तत्वों के परमाणुओं के साथ आबंधन की क्षमता होती है। ऑक्सीजन, हाइड्रोजन, नाइट्रोजन, सल्फ़र, क्लोरीन तथा अनेक अन्य तत्वों के साथ कार्बन के यौगिक बनते हैं, फलस्वरूप ऐसे विशेष गुण वाले यौगिक बनते हैं, जो अणु में कार्बन के अतिरिक्त उपस्थित तत्व पर निर्भर करते हैं।
अधिकतर अन्य तत्वों के साथ कार्बन द्वारा बनाए गए आबंध अत्यंत प्रबल होते हैं, जिनके फलस्वरूप ये यौगिक अतिशय रूप में स्थायी होते हैं। कार्बन द्वारा प्रबल आबंधों के निर्माण का एक कारण, इसका छोटा आकार भी है। इसके कारण इलेक्ट्रॉन के सहभागी युग्मों को नाभिक मज़बूती से पकड़े रहता है। बड़े परमाणुओं वाले तत्वों से बने आबंध तुलना में अत्यंत दुर्बल होते हैं।
क्या आप जानते हैं?
कार्बनिक यौगिक
कार्बन में पाए जाने वाले दो विशिष्ट लक्षणों, चतु:संयोजकता और श्रंखलन से बड़ी संख्या में यौगिकों का निर्माण होता है। अनेक यौगिकों के अकार्बनिक परमाणु अथवा परमाणु के समूह विभिन्न कार्बन श्रंखलाओं से जुड़े होते हैं। मूल रूप से इन यौगिकों को प्राकृतिक पदार्थों से प्राप्त किया गया था तथा यह समझा गया था कि ये कार्बन यौगिक अथवा कार्बनिक यौगिक केवल सजीवों में ही निर्मित हो सकते हैं। अर्थात, यह माना गया कि उनके संश्लेषण के लिए एक ‘जीवन शक्ति’ आवश्यक थी। 1828 में फ्रेडरिक वोहलर (Friedrich Wöhler) ने अमोनियम सायनेट से यूरिया बनाकर इसे असत्य प्रमाणित किया, लेकिन कार्बाईड, कार्बोनेट तथा बाइकार्बोनेट लवणों के अतिरिक्त सभी कार्बन यौगिकों का अध्ययन अभी भी कार्बनिक रसायन के अंतर्गत होता है।
4.2.1 संतृप्त एवं असंतृप्त कार्बन यौगिक
मेथेन की संरचना हम पहले ही समझ चुके हैं। कार्बन एवं हाइड्रोजन से बनने वाला अन्य यौगिक एथेन है, जिसका सूत्र
चित्र 4.6 (a) एक आबंध के द्वारा जुड़े कार्बन परमाणु
प्रत्येक कार्बन परमाणु की तीन संयोजकता असंतुष्ट रहती है, अतः प्रत्येक का आबंध तीन हाइड्रोजन परमाणुओं के साथ किया जाता है, जिससे निम्नलिखित प्राप्त होता है-
चित्र 4.6 (b) तीन हाइड्रोजन परमाणुओं से जुड़े प्रत्येक कार्बन परमाणु
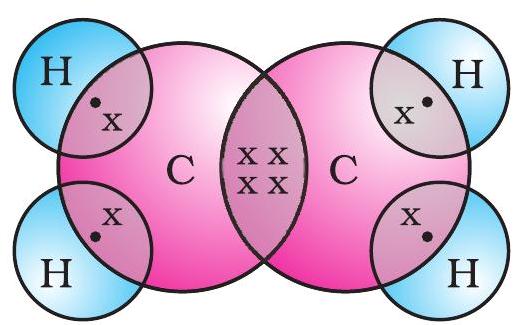
एथेन की इलेक्ट्रॉन बिंदु संरचना को चित्र 4.6 (c) में दर्शाया गया है।

चित्र 4.6 (c) एथेन की इलेक्ट्रॉन बिंदु संरचना
क्या आप इसी प्रकार प्रोपेन की संरचना चित्रित कर सकते हैं, जिसका आणविक सूत्र
किंतु कार्बन एवं हाइड्रोजन के एक अन्य यौगिक का सूत्र
एक आबंध के द्वारा जुड़े कार्बन परमाणु (चरण 1)
हम देखते हैं कि प्रति कार्बन परमाणु की एक संयोजकता (चरण 2) असंतुष्ट रहती है। इसको तभी संतुष्ट किया जा सकता है, जब दो कार्बनों के बीच द्विआबंध (चरण 3) हो जिससे हमें निम्नलिखित प्राप्त हो:
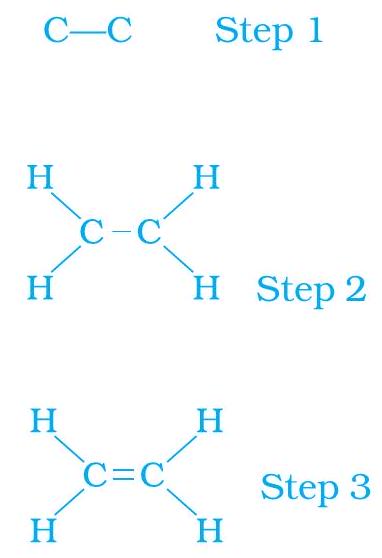
चित्र 4.7 में एथीन की इलेक्ट्रॉन बिंदु संरचना दी गई है।
चित्र 4.7 एथीन की संरचना
हाइड्रोजन एवं कार्बन के एक अन्य यौगिक का सूत्र
4.2.2 श्रंखलाएँ, शाखाएँ एवं वलय
पिछले खंड में हमने क्रमशः 1,2 तथा 3 कार्बन परमाणुओं वाले कार्बन यौगिकों मेथेन, एथेन तथा प्रोपेन की चर्चा की। कार्बन परमाणुओं की इस प्रकार की श्रंखलाओं में दसों कार्बन परमाणु हो सकते हैं। इनमें से छ: के नाम तथा संरचना सारणी 4.2 में दिए गए हैं।
सारणी 4.2 कार्बन तथा हाइड्रोजन के संतृप्त यौगिकों के सूत्र तथा संरचनाएँ

किंतु आइए, हम ब्यूटेन पर पुनर्विचार करें। यदि हम चार कार्बन परमाणुओं से कार्बन ‘कंकाल’ बनाएँ तो हमें पता चलता है कि दो विभिन्न ‘कंकाल’ बन सकते हैं-

चित्र 4.8 (a) दो संभावित कार्बन कंकाल
शेष संयोजकता के स्थान पर हाइड्रोजन भरने से हमें निम्नलिखित प्राप्त होता है-
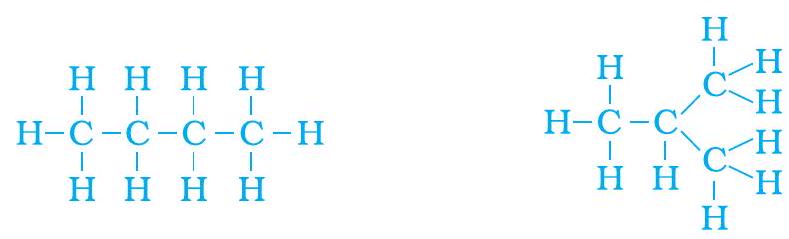
चित्र 4.8 (b)
हम देखते हैं कि इन दोनों संरचनाओं में एक ही सूत्र
सीधी तथा शाखाओं वाली कार्बन श्रंखलाओं के अतिरिक्त कुछ यौगिकों में कार्बन के परमाणु वलय के आकार में व्यवस्थित होते हैं, जैसे— साइक्लोहेक्सेन का सूत्र
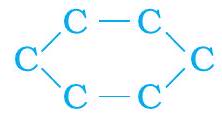
(a)
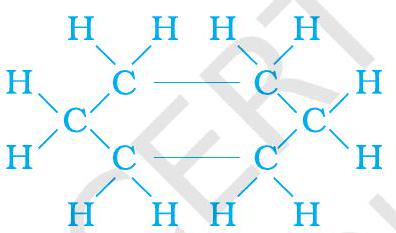
(b)
चित्र 4.9 साइक्लोहेक्सेन की संरचना (a) कार्बन कंकाल (b) संपूर्ण अणु
क्या आप साइक्लोहेक्सेन की इलेक्ट्रॉन बिंदु संरचना को चित्रित कर सकते हैं? सीधी श्रंखला, शाखित श्रंखला तथा चक्रीय कार्बन यौगिक सभी संतृप्त अथवा असंतृप्त यौगिक हो सकते हैं, जैसे- बेन्जीन

चित्र 4.10 बेन्जीन की संरचना
केवल कार्बन एवं हाइड्रोजन वाले ये सभी कार्बन यौगिक हाइड्रोकार्बन कहलाते हैं। इनमें से संतृप्त हाइड्रोकार्बन ‘ऐल्केन’ कहलाते हैं। ऐसे असंतृप्त हाइड्रोकार्बन, जिनमें एक या अधिक दोहरे आबंध होते हैं ‘ऐल्कीन’ कहलाते हैं। एक या अधिक त्रि-आबंध वाले ‘ऐल्काइन’ कहलाते हैं।
4.2.3 मुझसे दोस्ती करेंगे?
कार्बन अत्यंत मैत्रीपूर्ण तत्व है। अभी तक हमने कार्बन तथा हाइड्रोजन के यौगिकों की चर्चा की, लेकिन कार्बन अन्य तत्वों; जैसे- हैलोजेन, ऑक्सीजन, नाइट्रोजन तथा सल्फ़र के साथ भी आबंध बनाता है। हाइड्रोकार्बन श्रंखला में यह तत्व एक या अधिक हाइड्रोजन को इस प्रकार प्रतिस्थापित करते हैं कि कार्बन की संयोजकता संतुष्ट रहती है। ऐसे यौगिकों में हाइड्रोजन को प्रतिस्थापित करने वाले तत्वों को विषम परमाणु कहते हैं। यह विषम परमाणु कुछ प्रकार्यात्मक समूहों में भी उपस्थित होते हैं, जैसा कि सारणी 4.3 में दिया गया है।
सारणी 4.3 कार्बन यौगिकों में कुछ प्रकार्यात्मक समूह
| विषय परमाणु | योगिकों का प्रकार | प्रकार्यात्मक समूह का फार्मूला |
|---|---|---|
| Cl/Br | हैलो - (क्लोरो / ब्रोमो) ऐल्केन | |
| ऑक्सीजन | 1. एल्कोहल | |
| 2. ऐल्डिहाइड | ||
| 3. कीटोन | ||
| 4. कार्बोक्सिलिक अम्ल |
यह विषम परमाणु और वे प्रकार्यात्मक समूह जिनमें यह उपस्थित होते हैं, यौगिकों को विशिष्ट गुण प्रदान करते हैं। यह गुण कार्बन श्रंखला की लँबाई और प्रकृति पर निर्भर नहीं होते, फलस्वरूप यह प्रकार्यात्मक समूह (Functional group) कहलाते हैं। सारणी 4.3 में कुछ महत्वपूर्ण प्रकार्यात्मक समूह दिए गए हैं। एकल रेखा के द्वारा समूह की मुक्त संयोजकता अथवा संयोजकताएँ दर्शाई गई हैं। हाइड्रोजन के एक या अधिक अणुओं को प्रतिस्थापित करके इस संयोजकता के द्वारा प्रकार्यात्मक समूह कार्बन श्रंखला से जुड़े रहते हैं।
4.2.4 समजातीय श्रेणी
आपने देखा कि कार्बन परमाणुओं को आपस में जोड़कर विभिन्न लंबाई की श्रंखलाएँ बनाई जा सकती हैं। ये श्रंखलाएँ शाखित भी हो सकती हैं। साथ ही, इन कार्बन श्रंखलाओं में स्थित हाइड्रोजन तथा अन्य परमाणुओं को उपरोक्त किसी भी प्रकार्यात्मक समूहों से प्रतिस्थापित किया जा सकता है। एल्कोहल जैसे प्रकार्यात्मक समूह की उपस्थिति कार्बन यौगिक के गुणधर्मों को तय करती है, चाहे कार्बन श्रंखला की लंबाई कुछ भी हो, जैसे-
अब हम सारणी 4.2 में वर्णित समजातीय श्रेणी को देखेंगे। यदि हम उत्तरोत्तर यौगिकों के सूत्रों को देखें, जैसे-
अगले युग्म-प्रोपेन
क्या आप इन युग्मों के आणविक द्रव्यमानों में अंतर ज्ञात कर सकते हैं। (कार्बन का परमाणविक द्रव्यमान
इसी प्रकार, ऐल्कीनों की समजातीय श्रेणी को देखिए। श्रेणी का पहला सदस्य एथीन है, जिसके बारे में हम पहले ही अनुभाग 4.2.1 में अध्ययन कर चुके हैं। एथेन का सूत्र क्या है? उत्तरोत्तर सदस्यों के सूत्र
क्या आपको इन यौगिकों में कार्बन एवं हाइड्रोजन के परमाणुओं की संख्या के बीच कोई संबंध प्रतीत होता है? ऐल्कीनों का सामान्य सूत्र
जब किसी समजातीय श्रेणी में आणविक द्रव्यमान बढ़ता है तो भौतिक गुणधर्मों में क्रमबद्धता दिखाई देती है। ऐसा इसलिए होता है क्योंकि आणविक द्रव्यमान के बढ़ने के साथ गलनांक एवं क्वथनांक में वृद्धि होती है। किसी विशेष विलायक में विलेयता जैसे भौतिक गुणधर्म भी इसी प्रकार की क्रमबद्धता दर्शाते हैं, किंतु पूर्ण रूप से प्रकार्यात्मक समूह के द्वारा सुनिश्चित किए जाने वाले रासायनिक गुण समजातीय श्रेणी में एकसमान बने रहते हैं।
क्रियाकलाप 4.2
- सूत्रों तथा आणविक द्रव्यमानों में अंतर की गणना कीजिए- (a).
तथा (b) तथा एवं (c) तथा - क्या इन तीनों में कोई समानता है?
- एक परिवार तैयार करने के लिए इन एल्कोहलों को कार्बन परमाणुओं के बढ़ते हुए क्रम में व्यवस्थित कीजिए। क्या इनको एक समजातीय श्रेणी का परिवार कहा जा सकता है?
- सारणी 4.3 में दिए गए अन्य प्रकार्यात्मक समूहों के लिए चार कार्बनों तक के यौगिकों वाली समजातीय श्रेणी तैयार कीजिए।
4.2.5 कार्बन यौगिकों की नामपद्धति
किसी समजातीय श्रेणी में यौगिकों के नामों का आधार बेसिक कार्बन की उन मूल श्रंखलाओं पर आधारित होता है, जिनको प्रकार्यात्मक समूह की प्रकृति के अनुसार ‘पूर्वलग्न’ ‘उपसर्ग’ या ‘अनुलग्न’ ‘प्रत्यय’ के द्वारा संशोधित किया गया हो। जैसे क्रियाकलाप 4.2 में लिए गए एल्कोहलों के नाम हैं- मेथेनॉल, एथेनॉल, प्रोपेनॉल तथा ब्यूटनॉल।
निम्नलिखित विधि के द्वारा किसी कार्बन यौगिक का नामकरण किया जा सकता है-
(i) यौगिक में कार्बन परमाणुओं की संख्या ज्ञात कीजिए। तीन कार्बन परमाणु वाले यौगिक का नाम प्रोपेन होगा।
(ii) प्रकार्यात्मक समूह की उपस्थिति में इसको पूर्वलग्न अथवा अनुलग्न के साथ यौगिक के नाम में दर्शाया जाता है। (सारणी 4.4 के अनुसार)
(iii) यदि प्रकार्यात्मक सूमह का नाम अनुलग्न के आधार पर दिया जाना हो तथा यदि प्रकार्यात्मक समूह के अनुलग्न नाम स्वर
(iv) असंतृप्त कार्बन श्रंखला में कार्बन श्रंखला के नाम में दिए गए अंतिम ‘ane’ को सारणी 4.4 के अनुसार ’ene’ या ‘yne’ से प्रतिस्थापित करते हैं, जैसे- द्विआबंध वाली तीन कार्बन की श्रंखला प्रोपीन कहलाएगी तथा त्रि-आबंध होने पर यह प्रोपाइन (propyne) कहलाएगी।
सारणी 4.4 कार्बनिक यौगिकों की नामपद्धति

प्रश्न
1. पेन्टेन के लिए आप कितने संरचनात्मक समावयवों का चित्रण कर सकते हैं?
Show Answer
#missing2. कार्बन के दो गुणधर्म कौन से हैं, जिनके कारण हमारे चारों ओर कार्बन यौगिकों की विशाल संख्या दिखाई देती है?
Show Answer
#missing3. साइक्लोपेन्टेन का सूत्र तथा इलेक्ट्रॉन बिंदु संरचना क्या होंगे?
Show Answer
#missing4. निम्नलिखित यौगिकों की संरचनाएँ चित्रित कीजिए-
(i) एथेनॉइक अम्ल
(ii) ब्रोमोपेन्टेन
(iii) ब्यूटेनोन
(iv) हेक्सेनैल
क्या ब्रोमोपेन्टेन के संरचनात्मक समावयव संभव हैं?
Show Answer
#missing5. निम्नलिखित यौगिकों का नामकरण कैसे करेंगे?
(i)
(ii)
(iii)
Show Answer
#missing4.3 कार्बन यौगिकों के रासायनिक गुणधर्म
इस भाग में हम कार्बन यौगिकों के कुछ रासायनिक गुणधर्मों का अध्ययन करेंगे। चूँकि, हमारे द्वारा उपयोग में लाए जाने वाले अधिकांश ईंधन कार्बन अथवा उसके यौगिक होते हैं, अतः सर्वप्रथम हम दहन के विषय में पढ़ेंगे।
4.3.1 दहन
अपने सभी अपररूपों में कार्बन, ऑक्सीजन में दहन करके ऊष्मा एवं प्रकाश के साथ कार्बन डाइऑक्साइड देता है। दहन पर अधिकांश कार्बन यौगिक भी प्रचुर मात्रा में ऊष्मा एवं प्रकाश को मुक्त करते हैं। निम्नलिखित वे ऑक्सीकरण अभिक्रियाएँ हैं, जिनका अध्ययन आपने पहले अध्याय में किया था-
(i)
(ii)
(iii)
पहले अध्याय में अध्ययन की गई विधि से (ii), (iii) अभिक्रियाओं को संतुलित कीजिए।
क्रियाकलाप 4.3
सावधानी— इस क्रियाकलाप के लिए शिक्षक का पर्यवेक्षण अनिवार्य है।
- एक स्पैचुला में एक-एक करके कुछ कार्बन यौगिकों (नैफ्थलीन, कैम्फर, एल्कोहल) को लेकर जलाइए।
- ज्वाला की प्रकृति का प्रेक्षण कीजिए तथा लिखिए कि धुआँ उत्पन्न हुआ या नहीं।
- ज्वाला के ऊपर धातु की एक तश्तरी रखिए। इनमें से किसी भी यौगिक के कारण क्या तश्तरी पर कोई निक्षेपण हुआ?
क्रियाकलाप 4.4
- एक बुन्सेन बर्नर जलाइए तथा विभिन्न प्रकार की ज्वालाओं अथवा धुएँ की उपस्थिति को प्राप्त करने के लिए उसके आधार पर वायु छिद्र को व्यवस्थित कीजिए।
- पीली, कज्जली ज्वाला कब प्राप्त हुई?
- नीली ज्वाला कब प्राप्त हुई?
संतृप्त हाइड्रोकार्बन से सामान्यतः स्वच्छ ज्वाला निकलेगी, जबकि असंतृप्त कार्बन यौगिकों से अत्यधिक काले धुएँ वाली पीली ज्वाला निकलेगी। इसके परिणामस्वरूप क्रियाकलाप 4.3 में धातु की तश्तरी पर कज्जली निक्षेपण होगा, लेकिन वायु की आपूर्ति को सीमित कर देने से अपूर्ण दहन होने पर संतृप्त हाइड्रोकार्बनों से भी कज्जली ज्वाला निकलेगी। घरों में उपयोग में लाई जाने वाली गैस अथवा केरोसिन के स्टोव में वाय के लिए छिद्र होते हैं, जिनसे पर्याप्त मात्रा में ऑक्सीजन-समृद्ध मिश्रण जलकर स्वच्छ नीली ज्वाला देता है।
यदि कभी बर्तनों के तले काले होते हुए दिखाई दें तो इसका अर्थ होगा कि वायु छिद्र अवरुद्ध हैं तथा ईंधन का व्यर्थ व्यय हो रहा है। कोयले तथा पेट्रोलियम जैसे ईधनों में कुछ मात्रा में नाइट्रोजन तथा सल्फ़र होती हैं। इनके दहन के फलस्वरूप सल्फ़र तथा नाइट्रोजन के ऑक्साइड का निर्माण होता है, जो पर्यावरण में प्रमुख प्रदूषक हैं।
क्या आप जानते हैं?
क्यों जलते हुए पदार्थ ज्वाला उत्पन्न करते हैं अथवा नहीं करते हैं?
क्या आपने कभी कोयले अथवा लकड़ी की अग्नि को देखा है? यदि नहीं, तो अगली बार जब भी अवसर मिले तो आप ध्यान से देखिए कि लकड़ी अथवा कोयले का जलना आरंभ होने पर क्या होता है। आपने देखा कि एक मोमबत्ती या गैस स्टोव की एल.पी.जी., जलते समय ज्वाला उत्पन्न करती है। यद्यपि आप देखेंगे कि अँगीठी में जलने वाला कोयला या तारकोल कभी-कभी लाल रंग के समान उज्ज्वल होता है तथा बिना ज्वाला के ऊष्मा देता है। ऐसा इसलिए होता है क्योंकि केवल गैसीय पदार्थों के जलने पर ही ज्वाला उत्पन्न होती है। लकड़ी या तारकोल जलाने पर उपस्थित वाष्पशील पदार्थ वाष्पीकृत हो जाते हैं तथा आरंभ में ज्वाला के साथ जलते हैं। गैसीय पदार्थों के परमाणुओं को ताप देने पर एक दीप्त ज्वाला दिखाई देती है तथा उज्ज्वल होना आरंभ करती है। प्रत्येक तत्व के द्वारा उत्पन्न रंग उस तत्व का अभिलाक्षणिक गुण होता है। गैस स्टोव की ज्वाला में ताँबे के तार को जलाने का प्रयास कीजिए तथा इसके रंग का प्रेक्षण कीजिए। आपने देखा कि अपूर्ण दहन से कज्जल उत्पन्न होता है, जो कार्बन होता है। इसके आधार पर आप मोमबत्ती की पीले रंग की ज्वाला का क्या कारण बताएँगे?
क्या आप जानते हैं?
कोयले तथा पेट्रोलियम का निर्माण
कोयले तथा पेट्रोलियम का निर्माण जैवमात्रा से हुआ है, जो विभिन्न जैविकीय तथा भूवैज्ञानिक प्रक्रियाओं पर निर्भर करते हैं। कोयला लाखों वर्ष पुराने वृक्षों, फ़र्न तथा अन्य पौधे का अवशेष है। संभवतः भूकंप अथवा ज्वालामुखी फटने के कारण ये धरती में चट्टानों की परतों के नीचे दब गए थे तथा धीर-धीरे क्षय होकर ये कोयला बन गए। तेल तथा गैस लाखों वर्ष पुराने छोटे समुद्री पौधों तथा जीवों के अवशेष हैं। उनके मृत होने पर उनके शरीर समुद्र-तल में डूब गए तथा गाद से ढक गए। उन मृत अवशेषों पर बैक्टीरिया के आक्रमण से प्रबल दाब के कारण तेल तथा गैस का निर्माण हुआ। इसी बीच गाद धीर-धीरे दबकर चट्टान बन गया। चट्टान के छिद्रित भागों से तेल तथा गैस का रिसाव हुआ और ये पानी में स्पंज की तरह फँस गए। क्या आप अनुमान लगा सकते हैं कि कोयले तथा पेट्रोलियम को जीवाश्मी ईंधन क्यों कहते हैं?
4.3.2 ऑक्सीकरण
क्रियाकलाप 4.5
- एक परखनली में लगभग
एथेनॉल लीजिए तथा इसे जल ऊष्मक में सावधानी से गर्म कीजिए। - इस विलयन में क्षारीय पोटैशियम परमैंगनेट का
एक-एक बूँद करके डालिए। - डालने पर आरंभ में क्या पोटैशियम परमैंगनेट का रंग बना रहता है?
- अधिक मात्रा में डालने पर पोटैशियम परमैंगनेट का रंग लुप्त क्यों नहीं होता?
प्रथम अध्याय में आपने ऑक्सीकरण की अभिक्रियाओं का अध्ययन किया। दहन करने पर कार्बन यौगिकों को सरलता से ऑक्सीकृत किया जा सकता है। इस पूर्ण ऑक्सीकरण के अतिरिक्त ऐसी अभिक्रियाएँ भी होती हैं, जिनमें एल्कोहल को कार्बोक्सिलिक अम्ल में बदला जाता है-
हम देखते हैं कि कुछ पदार्थों में अन्य पदार्थों को ऑक्सीजन देने की क्षमता होती है। इन पदार्थों को ऑक्सीकारक कहा जाता है।
क्षारीय पोटैशियम परमैंगनेट अथवा अम्लीकृत पोटैशियम डाइक्रोमेट एल्कोहलों को अम्लों में आक्सीकृत करते हैं अर्थात ये आरंभिक पदार्थ में ऑक्सीजन जोड़ते हैं। अतएव इनको ऑक्सीकारक कहते हैं।
4.3.3 संकलन अभिक्रिया
पैलेडियम अथवा निकैल जैसे उत्प्रेरकों की उपस्थिति में असंतृप्त हाइड्रोकार्बन हाइड्रोजन जोड़कर संतृप्त हाइड्रोकार्बन देते हैं। उत्प्रेरक वे पदार्थ होते हैं, जिनके कारण अभिक्रिया भिन्न दर से आगे बढ़ती है, जो अभिक्रिया को प्रभावित नहीं करते हैं। निकैल उत्प्रेरक का उपयोग करके साधारणतः वनस्पति तेलों के हाड्रोजनीकरण में इस अभिक्रिया का उपयोग होता है। वनस्पति तेलों में साधारणतः लंबी असंतृप्त कार्बन श्रंखलाएँ होती हैं, जबकि जंतु वसा में संतृप्त कार्बन श्रंखलाएँ होती हैं।

आपने देखा होगा कि कुछ विज्ञापनों में कहा जाता है कि वनस्पति तेल ‘स्वास्थ्यवर्धक’ होते हैं। साधारणतः, जंतु वसा में संतृप्त वसा अम्ल होते हैं, जो स्वास्थ्य के लिए हानिकारक माने जाते हैं। भोजन पकाने के लिए असंतृप्त वसा अम्लों वाले तेलों का उपयोग करना चाहिए।
4.3.4 प्रतिस्थापन अभिक्रिया
संतृप्त हाइड्रोकार्बन अत्यधिक अनभिक्रित होते हैं तथा अधिकांश अभिकर्मकों की उपस्थिति में अक्रिय होते हैं। हालाँकि, सूर्य के प्रकाश की उपस्थिति में अति तीव्र अभिक्रिया में क्लोरीन का हाइड्रोकार्बन में संकलन होता है। क्लोरीन एक-एक करके हाइड्रोजन के परमाणुओं का प्रतिस्थापन करती है। इसको प्रतिस्थापन अभिक्रिया कहते हैं, क्योंकि एक प्रकार का परमाणु, अथवा परमाणुओं के समूह दूसरे का स्थान लेते हैं। साधारणतः उच्च समजातीय ऐल्केन के साथ अनेक उत्पादों का निर्माण होता है।
प्रश्न
1. एथनॉल से एथेनॉइक अम्ल में परिवर्तन को ऑक्सीकरण अभिक्रिया क्यों कहते हैं?
Show Answer
#missing2. ऑक्सीजन तथा एथाइन के मिश्रण का दहन वेल्डिंग के लिए किया जाता है। क्या आप बता सकते हैं कि एथाइन तथा वायु के मिश्रण का उपयोग क्यों नहीं किया जाता?
Show Answer
#missing4.4 कुछ महत्वपूर्ण कार्बन यौगिक- एथनॉल तथा एथेनॉइक अम्ल
अनेक कार्बन यौगिक हमारे लिए अनमोल होते हैं, किंतु यहाँ हम व्यावसायिक रूप से महत्वपूर्ण दो यौगिकों- एथनॉल तथा एथेनॉइक अम्लों के गुणधर्मों का अध्ययन करेंगे।
4.4.1 एथनॉल के गुणधर्म
एथनॉल कक्ष के ताप पर द्रव अवस्था में होता है। (एथनॉल के गलनांक एवं क्वथनांक के लिए सारणी 4.1 देखिए) सामान्यतः एथेनॉल को एल्कोहल कहा जाता है तथा यह सभी एल्कोहल पेय पदार्थों का महत्वपूर्ण अवयव होता है। इसके अतिरिक्त यह एक अच्छा विलायक है। इसलिए, इसका उपयोग टिंचर आयोडीन, कफ़ सीरप, टॉनिक आदि जैसी औषधियों में होता है। एथनॉल को किसी भी अनुपात में जल में मिलाया जा सकता है। तनु एथनॉल की थोड़ी सी भी मात्रा लेने पर नशा आ जाता है। हालाँकि एल्कोहल पीना निंदनीय है, लेकिन समाज में बड़े पैमाने पर प्रचलित है, लेकिन शुद्ध एथनॉल (परिशुद्ध एल्कोहल) की थोड़ी सी भी मात्रा घातक सिद्ध हो सकती है। काफ़ी समय तक एल्कोहल का सेवन करने से स्वास्थ्य संबंधी कई समस्याएँ उत्पन्न हो जाती हैं।
क्रियाकलाप 4.6
शिक्षक के द्वारा प्रदर्शन-
- लगभग दो चावल के आकार के बराबर सोडियम के एक छोटे टुकड़े को एथनॉल (परिशुद्ध एल्कोहल) में डालिए।
- आप क्या प्रेक्षित करते हैं?
- उत्सर्जित गैस की आप कैसे जाँच करेंगे?
एथनॉल की अभिक्रियाएँ
(i) सोडियम के साथ अभिक्रिया-
एल्कोहल सोडियम से अभिक्रिया कर हाइड्रोजन गैस उत्सर्जित करता है। एथनॉल के साथ अभिक्रिया में दूसरा उत्पाद सोडियम एथॉक्साइड बनता है। क्या आप बता सकते हैं कि कौन-सा दूसरा पदार्थ धातु से अभिक्रिया कर हाइड्रोजन बनाता है?
(ii) असंतृप्त हाइड्रोकार्बन बनाने की अभिक्रिया-
इस अभिक्रिया में सल्फ़्यूरिक अम्ल निर्जलीकारक के रूप में काम करता है, जो एथनॉल से जल को अलग कर देता है।
क्या आप जानते हैं?
सजीव प्राणियों पर एल्कोहल का क्या प्रभाव पड़ता है?
जब अधिक मात्रा में एथनॉल का सेवन किया जाता है तो इससे उपापचयी प्रक्रिया धीमी हो जाती है तथा केंद्रीय तंत्रिका तंत्र कमजोर हो जाता है। इसके फलस्वरूप समन्वय की कमी, मानसिक दुविधा, उनींदापन, सामान्य अर्न्तबाध का कम हो जाना एवं भावशून्यता आती है। यद्यपि व्यक्ति राहत महसूस करता है, लेकिन उसे पता नहीं चल पाता कि उसके सोचने, समझने की क्षमता तथा मांसपेशी बुरी तरह प्रभावित हुई है। एथनॉल के विपरीत मेथेनॉल की थोड़ी सी थी मात्रा लेने से मृत्यु हो सकती है। यकृत में मेथेनॉल ऑक्सीकृत होकर मेथेनैल बन जाता है। मेथेनैल यकृत की कोशिकाओं के घटकों के साथ शीघ्र अभिक्रिया करने लगता है। इससे प्रोटोप्लाज्म उसी प्रकार स्कंदित हो जाता है,
जिस प्रकार पकाने पर अंडा स्कंदित होता है। मेथैनैल चाक्षुष तंत्रिका को भी प्रभावित करता है, जिससे व्यक्ति अंधा हो सकता है। एथनॉल एक महत्वपूर्ण औद्योगिक विलायक है। औद्योगिक उपयोग के लिए तैयार एथनॉल का दुरुपयोग रोकने के लिए इसमें मेथेनॉल जैसा ज़हरीला पदार्थ मिला दिया जाता है, जिससे यह पीने योग्य न रह जाए। एल्कोहल की पहचान करने के लिए इसमें रंजक मिलाकर इसका रंग नीला बना दिया जाता है। इसे विकृत एल्कोहल कहा जाता है।
क्या आप जानते हैं?
ईंधन के रूप में एल्कोहल
गन्ना सूर्य के प्रकाश को रासायनिक ऊर्जा में बदलने में सर्वाधिक सक्षम होता है। गन्ने का रस मोलेसस (सिरा) बनाने के उपयोग में लाया जाता है, जिसका किण्वन करके एल्कोहल (एथनॉल) तैयार किया जाता है। कुछ देशों में एल्कोहल में पेट्रोल मिलाकर उसे स्वच्छ ईंधन के रूप में इस्तेमाल किया जाता है। यह ईंधन पर्याप्त ऑक्सीजन होने पर केवल कार्बन डाइऑक्साइड एवं जल उत्पन्न करता है।
4.4.2 एथेनॉइक अम्ल के गुणधर्म
एथेनॉइक अम्ल को सामान्यतः ऐसीटिक अम्ल कहा जाता है तथा यह कार्बोक्सिलिक अम्ल समूह से संबंधित है। ऐसीटिक अम्ल के
कार्बोक्सिलिक अम्ल कहा जाने वाला कार्बनिक यौगिकों के समूह का अभिलक्षण इसकी अम्लीयता होती है। हालाँकि, खनिज अम्लों के विपरीत कार्बोक्सिलिक अम्ल दुर्बल अम्ल होते हैं। खनिज अम्ल, जैसे- हाइड्रोक्लोरिक अम्ल पूरी तरह आयनीकृत हो जाते हैं।
क्रियाकलाप 4.7
- लिटमस पत्र एवं सार्वत्रिक सूचक का उपयोग कर तनु ऐसीटिक अम्ल तथा हाइड्रोक्लोरिक अम्ल के
मान की तुलना कीजिए। - क्या लिटमस परीक्षण में दोनों अम्ल सूचित होते हैं?
- सार्वत्रिक सूचक से क्या दोनों अम्लों के प्रबल होने का पता चलता है?
क्रियाकलाप 4.8
- एक परखनली में सांद्र सल्फ़्यूरिक अम्ल की कुछ बूँदें, एक-एक
एथेनॉल (परिशुद्ध एल्कोहल) एवं ग्लैशल ऐसीटिक अम्ल लीजिए। - कम से कम पाँच मिनट तक जल ऊष्मक में उसे गर्म करें जैसा चित्र 4.1 में दिखाया गया है।
- अब इसे उस बीकर में उड़ेल दीजिए जिसमें
जल हो तथा उस मिश्रण को सूँघिए।

चित्र 4. एस्टर का निर्माण
एथेनॉइक अम्ल की अभिक्रियाएँ
(i) एस्टरीकरण अभिक्रिया— एस्टर मुख्य रूप से अम्ल एवं एल्कोहल की अभिक्रिया से निर्मित होते हैं। एथेनॉइक अम्ल किसी अम्ल उत्प्रेक की उपस्थिति में परिशुद्ध एथनॉल से अभिक्रिया करके एस्टर बनाते हैं-

सामान्यतया एस्टर की गंध मृदु होती है। इसका उपयोग इत्र बनाने एवं स्वाद उत्पन्न करने वाले कारक के रूप में किया जाता है। सोडियम हाइड्रॉक्साइड से अभिक्रिया द्वारा, जो एक क्षार है, एस्टर पुनः एल्कोहल एवं कार्बोक्सिलिक अम्ल का सोडियम लवण बनाता है। इस अभिक्रिया को साबुनीकरण कहा जाता है, क्योंकि इससे साबुन तैयार किया जाता है। साबुन दीर्घ श्रंखला वाले कार्बोक्सिलिक अम्लों सोडियम अथवा पोटैशियम लवण होते हैं।
(ii) क्षारक के साथ अभिक्रिया— खनिज अम्ल की भाँति एथेनॉइक अम्ल सोडियम हाइड्रोक्सॉइड जैसे क्षारक से अभिक्रिया करके लवण (सोडियम एथेनोएट या सोडियम ऐसीटेट) तथा जल बनाता है।
एथेनॉइक अम्ल कार्बोनेट एवं हाइड्रोजन कार्बोंनेट से कैसे अभिक्रिया करता है?
आइए, जानने के लिए हम एक क्रियाकलाप करें।
क्रियाकलाप 4.9
- अध्याय 2 के क्रियाकलाप 2.5 के अनुसार उपकरण तैयार कीजिए।
- एक परखनली में एक स्पैचुला भरकर सोडियम कार्बोनेट लीजिए तथा उसमें
तनु एथेनॉइक अम्ल मिलाइए। - आप क्या प्रेक्षित करते हैं?
- ताजे चने के जल में इस गैस को प्रवाहित कीजिए। आप क्या देखते हैं?
- क्या इस परीक्षण से एथेनॉइक अम्ल एवं सोडियम कार्बोनेट की अभिक्रिया से उत्पन्न गैस का पता चल सकता है?
- अब सोडियम कार्बोनेट के स्थान पर सोडियम हाइड्रोजनकार्बोनेट के साथ यह क्रियाकलाप दोहराइए।
(iii) कार्बोनेट एवं हाइड्रोजनकार्बोनेट के साथ अभिक्रिया— एथेनॉइक अम्ल कार्बोनेट एवं हाइड्रोजनकार्बोनेट के साथ अभिक्रिया करके लवण, कार्बन डाइऑक्साइड एवं जल बनाता है। इस अभिक्रिया में उत्पन्न लवण को सोडियम ऐसीटेट कहते हैं।
प्रश्न
1. प्रयोग द्वारा आप एल्कोहल एवं कार्बोक्सिलिक अम्ल में कैसे अंतर कर सकते हैं?
Show Answer
#missing2. ऑक्सीकारक क्या हैं?
Show Answer
#missing4.5 साबुन और अपमार्जक
क्रियाकलाप 4.10
- दो परखनलियों में
जल लीजिए। - दोनों में एक-एक बूँद तेल (पाक तेल) डालिए एवं उन्हें ’
’ तथा ’ ’ नाम दीजिए। - परखनली ’
’ में साबुन के घोल की कुछ बूँदें डालिए। - दोनों परखनलियों को समान समय तक जोर-जोर से हिलाइए।
- क्या हिलाना बंद करने के बाद दोनों परखनलियों में आप तेल एवं जल की परतों को अलग-अलग देख सकते हैं?
- कुछ देर तक दोनों परखनलियों को स्थिर रखिए एवं फिर उस पर ध्यान दीजिए। क्या तेल की परत अलग हो जाती है? ऐसा किस परखनली में पहले होता है।

चित्र 4.12 मिसेल का निर्माण
इस क्रियाकलाप से सफ़ाई में साबुन के प्रभाव का पता चलता है। अधिकांश मैल तैलीय होते हैं और आप जानते हैं कि तेल पानी में अघुलनशील है। साबुन के अणु लंबी श्रंखला वाले कार्बोक्सिलिक अम्लों के सोडियम एवं पोटैशियम लवण होते हैं। साबुन का आयनिक भाग जल से जबकि कार्बन श्रंखला तेल से पारस्परिक क्रिया करती है। इस प्रकार साबुन के अणु मिसेली संरचना, (चित्र 4.12) तैयार करते हैं, जहाँ अणु का एक सिरा तेल कण की ओर तथा आयनिक सिरा बाहर की ओर होता है। इससे पानी में इमल्शन बनता है। इस प्रकार साबुन का मिसेल मैल को पानी बाहर निकलने में मदद करता है और हमारे कपड़े साफ़ (चित्र 4.13) हो जाते है।
क्या आप मिसेल की संरचना बना सकते हैं, जो साबुन को हाइड्रोकार्बन में घोलने से बनता है?
क्या आप जानते हैं?
मिसेल
साबुन के अणु ऐसे होते हैं, जिनके दोनों सिरों के विभिन्न गुणधर्म होते हैं। जल में विलेय एक सिरे को जलरागी कहते हैं तथा हाइड्रोकार्बन में विलेय दूसरे सिरे को जलविरागी कहते हैं। जब साबुन जल >की सतह पर होता है तब इसके अणु अपने को इस प्रकार व्यवस्थित कर लेते हैं कि इसका आयनिक सिरा जल के अंदर होता है ।



चित्र 4.13 मैल हटाने में साबुन का प्रभाव
जबकि हाइड्रोकार्बन पूँछ (दूसरा छोर) जल के बाहर होती है। जल के अंदर इन अणुओं की एक विशेष व्यवस्था होती है, जिससे इसका हाइड्रोकार्बन सिरा जल के बाहर बना होता है। ऐसा अणुओं का बड़ा गुच्छा बनने के कारण होता है, जिसमें जलविरागी पूँछ गुच्छे के आंतरिक हिस्से में होती है, जबकि उसका आयनिक सिरा गुच्छे की सतह पर होता है। इस संरचना को मिसेल कहते हैं। मिसेल के रूप में साबुन स्वच्छ करने में सक्षम होता है, क्योंकि तैलीय मैल मिसेल के केंद्र में एकत्र हो जाते हैं। मिसेल विलयन में कोलॉइड के रूप में बने रहते है तथा आयन-आयन विकर्षण के कारण वे अवक्षेपित नहीं होते। इस प्रकार मिसेल में तैरते मैल आसानी से हटाए जा सकते हैं। साबुन के मिसेल प्रकाश को प्रकीर्णित कर सकते हैं। यही कारण है कि साबुन का घोल बादल जैसा दिखता है।
क्रियाकलाप 4.11
- अलग-अलग परखनलियों में
आसुत जल (अथवा वर्षा जल) एवं कठोर जल (हैंडपंप या कुएँ का जल) लीजिए। - दोनों में साबुन के घोल की कुछ बूँदें मिलाइए।
- दोनों परखनलियों को एक ही समय तक हिलाइए एवं उससे बनने वाले झाग पर ध्यान दीजिए।
- किस परखनली में अधिक झाग बनता है?
- किस परखनली में श्वेत दही जैसा अवक्षेप प्राप्त होता है?
- शिक्षक के लिए निर्देश—यदि आपके आसपास कठोर जल उपलब्ध नहीं है तो साधारण जल में हाइड्रोजन कार्बोनेट अथवा सल्फ़ेट अथवा मैग्नीशियम या कैल्सियम के क्लोराइड को घोलकर कठोर जल तैयार कीजिए।
क्रियाकलाप 4.12
- दो परखनलियाँ लीजिए और प्रत्येक में
कठोर जल डालिए। - एक में साबुन के घोल की पाँच बूँदें तथा दूसरे में अपमार्जक के घोल की पाँच बूँदें डालिए।
- दोनों परखनलियों को एक ही समय तक हिलाएँ।
- क्या दोनों में झाग की मात्रा समान है?
- किस परखनली में दही जैसा ठोस पदार्थ बनता है?
क्या आपने कभी स्नान करते समय अनुभव किया है कि झाग मुश्किल से बन रहा है एवं जल से शरीर धो लेने के बाद भी कुछ अघुलनशील पदार्थ (स्कम) जमा रहता है। ऐसा इसलिए होता है, क्योंकि साबुन कठोर जल में उपस्थित कैल्सियम एवं मैग्नीशियम लवणों से अभिक्रिया करता है। ऐसे में आपको अधिक मात्रा में साबुन का उपयोग करना पड़ता है। एक अन्य प्रकार के यौगिक यानी अपमार्जक का उपयोग कर इस समस्या को निपटाया जा सकता है। अपमार्जक सामान्यतः लंबी कार्बन श्रंखला वाले सल्फ़ोनिक लवण अथवा लंबी कार्बन श्रंखला वाले अमोनियम लवण होते हैं, जो क्लोराइड या बोमाइड आयनों के साथ बनते हैं। इन यौगिकों का आवेशित सिरा कठोर जल में उपस्थित कैल्शियम एवं मैग्नीशियम आयनों के साथ अघुलनशील पदार्थ नहीं बनाते हैं। इस प्रकार वह कठोर जल में भी प्रभावी बने रहते हैं। सामान्यतः अपमार्जकों का उपयोग शैंपू एवं कपड़े धोने के उत्पाद बनाने में होता है।
प्रश्न
1. क्या आप डिटरजेंट का उपयोग कर बता सकते हैं कि कोई जल कठोर है अथवा नहीं?
Show Answer
#missing2. लोग विभिन्न प्रकार से कपड़े धोते हैं। सामान्यतः साबुन लगाने के बाद लोग कपड़े को पत्थर पर पटकते हैं, डंडे से पीटते हैं, ब्रुश से रगड़ते हैं या वाशिंग मशीन में कपड़े रगड़े जाते हैं। कपड़ा साफ़ करने के लिए उसे रगड़ने की क्यों आवश्यकता होती है?
Show Answer
#missingआपने क्या सीखा
- कार्बन एक सर्वतोमुखी तत्व है, जो सभी जीवों एवं हमारे उपयोग में आने वाली वस्तुओं का आधार है। कार्बन की चतु:संयोजकता एवं श्रंखलन प्रकृति के कारण यह कई यौगिक बनाता है।
- अपने-अपने बाहरी कोशों को पूर्ण रूप से भरने के लिए दो परमाणुओं के बीच इलेक्ट्रॉनों की साझेदारी से सहसंयोजक आबंध बनता है।
- कार्बन अपने या दूसरे तत्वों; जैसे- हाइड्रोजन, ऑक्सीजन, सल्फ़र, नाइट्रोजन एवं क्लोरीन के साथ सहसंयोजक आबंध बनाता है।
- कार्बन ऐसे यौगिक भी बनाता है, जिसमें कार्बन परमाणुओं के बीच द्वि या त्रिआबंध होते हैं। कार्बन की यह श्रंखला, सीधी, शाखायुक्त या वलीय किसी भी रूप में हो सकती है।
- कार्बन की श्रंखला बनाने की क्षमता के कारण यौगिकों की एक समजाती श्रेणी उत्पन्न होती है, जिसमें विभिन्न लंबाई वाली कार्बन श्रंखला से समान प्रकार्यात्मक समूह जुड़ा होता है।
- एल्कोहल, ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल जैसे समूह कार्बन यौगिकों का अभिलाक्षणिक गुण प्रदान करते हैं। कार्बन तथा उसके यौगिक हमारे ईंधन के प्रमुख स्रोत हैं।
- कार्बन यौगिक एथॉॉल एवं एथेनॉइक अम्ल का हमारे दैनिक जीवन में काफ़ी महत्व है।
- साबुन एवं अपमार्जक की प्रक्रिया अणुओं में जलरागी तथा जलविरागी दोनों समूहों की उपस्थिति पर आधारित है। इसकी मदद से तैलीय मैल का पायस बनता है और बाहर निकलता है।
अभ्यास
1. एथेन का आण्विक सूत्र
(a) 6 सहसंयोजक आबंध हैं।
(b) 7 सहसंयोजक आबंध हैं।
(c) 8 सहसंयोजक आबंध हैं।
(d) 9 सहसंयोजक आबंध हैं।
Show Answer
#missing2. ब्यूटेनॉन चर्तु-कार्बन यौगिक है, जिसका प्रकार्यात्मक समूह-
(a) कार्बोक्सिलिक अम्ल
(b) ऐल्डिहाइड
(c) कीटोन
(d) एल्कोहल
Show Answer
#missing3. खाना बनाते समय यदि बर्तन की तली बाहर से काली हो रही है तो इसका मतलब है कि-
(a) भोजन पूरी तरह नहीं पका है।
(b) ईंधन पूरी तरह से नहीं जल रहा है।
(c) ईंधन आर्द्र है।
(d) ईंधन पूरी तरह से जल रहा है।
Show Answer
#missing4.
Show Answer
#missing5. इलेक्ट्रॉन बिंदु संरचना बनाइए-
(a) एथेनॉइक अम्ल
(b)
(c) प्रोपेनोन
(d)
Show Answer
#missing6. समजातीय श्रेणी क्या है? उदाहरण के साथ समझाइए।
Show Answer
#missing7. भौतिक एवं रासायनिक गुणधर्मों के आधार पर एथनॉल एवं एथेनॉइक अम्ल में आप कैसे अंतर करेंगे?
Show Answer
#missing8. जब साबुन को जल में डाला जाता है तो मिसेल का निर्माण क्यों होता है? क्या एथनॉल जैसे दूसरे विलायकों में भी मिसेल का निर्माण होगा।
Show Answer
#missing9. कार्बन एवं उसके यौगिकों का उपयोग अधिकतर अनुप्रयोगों में इंधन के रूप में क्यों किया जाता है?
Show Answer
#missing10. कठोर जल को साबुन से उपचारित करने पर झाग के निर्माण को समझाइए।
Show Answer
#missing11. यदि आप लिटमस पत्र (लाल एवं नीला) से साबुन की जाँच करें तो आपका प्रेक्षण क्या होगा?
Show Answer
#missing12. हाइड्रोजनीकरण क्या है? इसका औद्योगिक अनुप्रयोग क्या है?
Show Answer
#missing13. दिए गए हाइड्रोकार्बन-
Show Answer
#missing14. संतृप्त एवं असंतृप्त कार्बन के बीच रासायनिक अंतर समझने के लिए एक परीक्षण बताइए।
Show Answer
#missing15. साबुन की सफ़ाई प्रक्रिया की क्रियाविधि समझाइए।
Show Answer
#missingसामूहिक क्रियाकलाप
I आणविक मॉडल किट का उपयोग कर इस अध्याय में पढ़े यौगिकों का मॉडल बनाइए।
II एक बीकर में
- साबुन को आप आकर्षक आकार में काट सकते हैं। इसके जमने से पहले इसमें आप इत्र भी मिला सकते हैं।










